- 2021-04-29 发布 |
- 37.5 KB |
- 8页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
中考化学专题气体的制备检验与净化
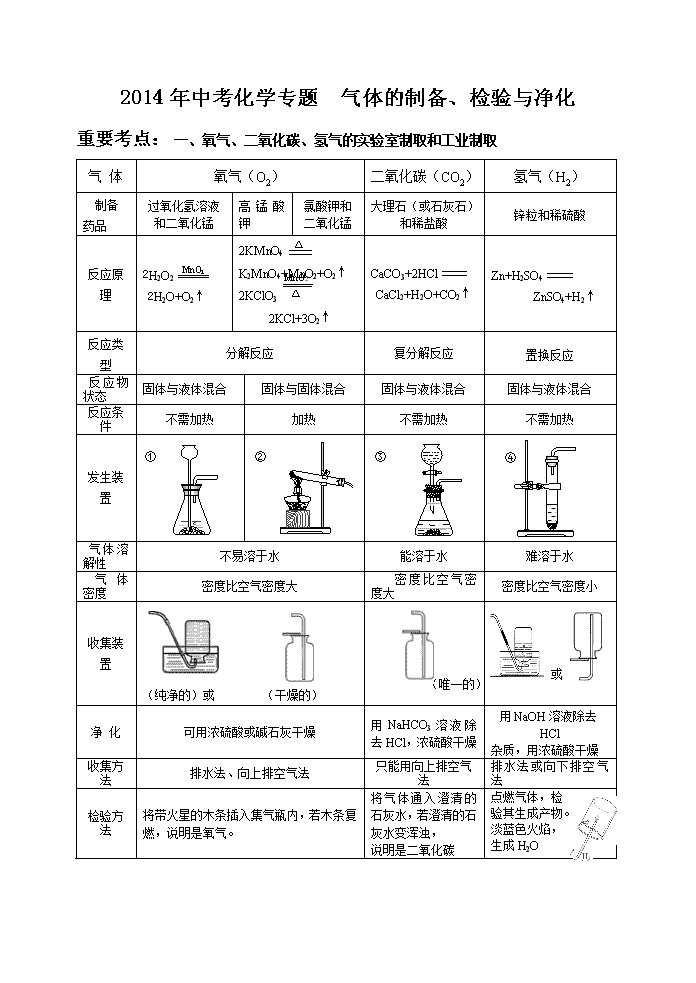
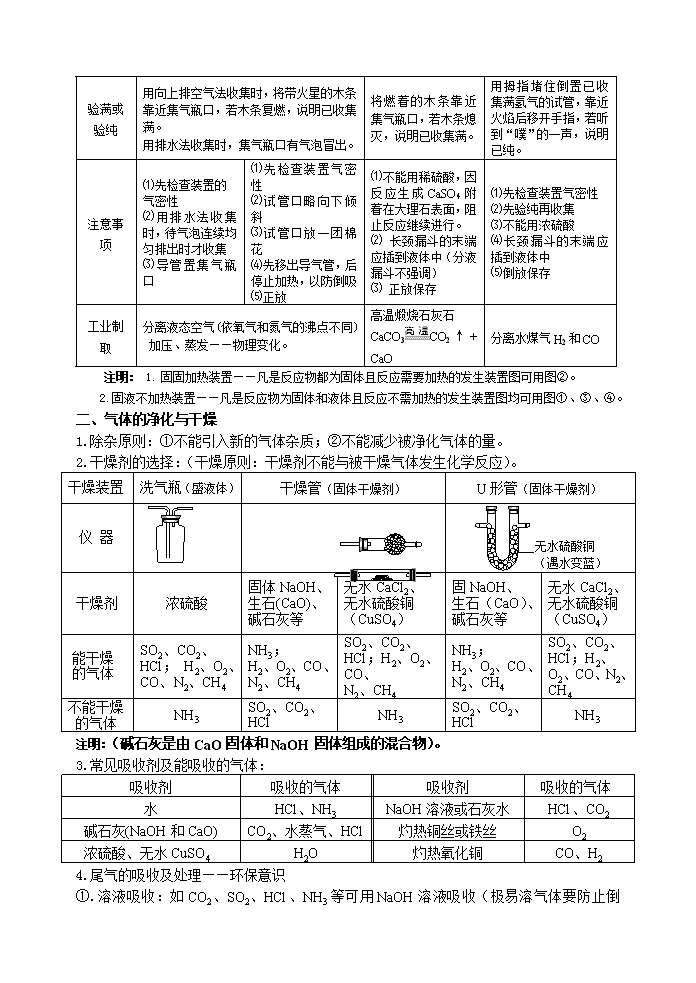
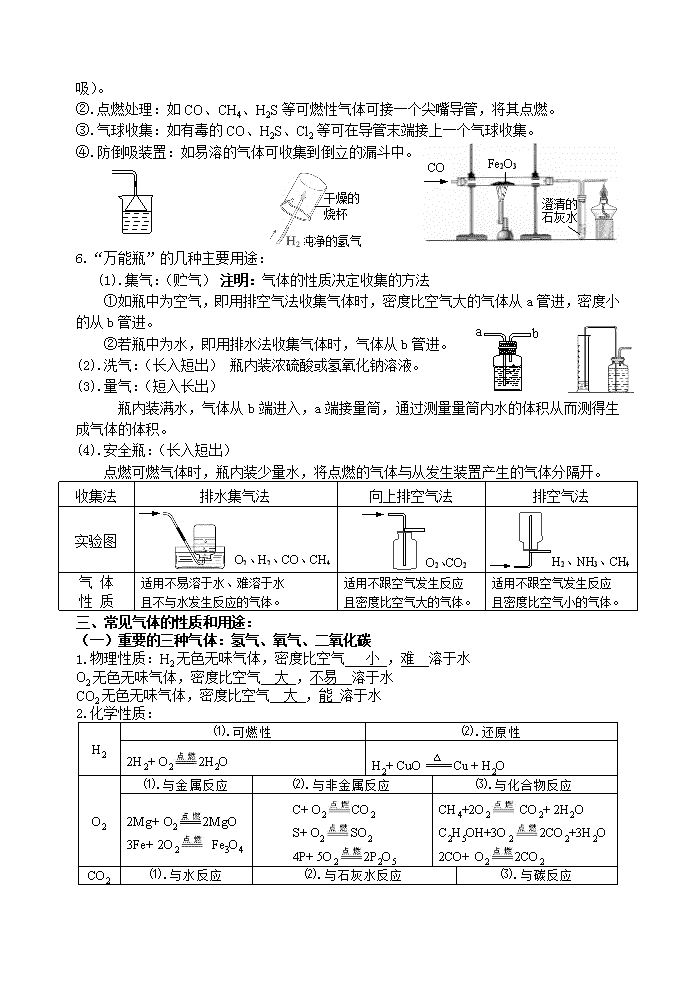
2014年中考化学专题 气体的制备、检验与净化 重要考点:学科王MnO2 △ 一、氧气、二氧化碳、氢气的实验室制取和工业制取 气 体 氧气(O2) 二氧化碳(CO2) 氢气(H2) 制备药品 过氧化氢溶液 和二氧化锰 高锰酸钾 氯酸钾和二氧化锰 大理石(或石灰石) 和稀盐酸 锌粒和稀硫酸 反应原理 2H2O2 2H2O+O2↑ △ 2KMnO4 K2MnO4+MnO2+O2↑ 2KClO3 2KCl+3O2↑ CaCO3+2HCl CaCl2+H2O+CO2↑ Zn+H2SO4 ZnSO4+H2↑ 反应类型 分解反应 复分解反应 置换反应 反应物状态 固体与液体混合 固体与固体混合 固体与液体混合 固体与液体混合 反应条件 不需加热 加热 不需加热 不需加热 发生装置 ③ ① ② ④ 气体溶解性 不易溶于水 能溶于水 难溶于水 气体密度 密度比空气密度大 密度比空气密度大 密度比空气密度小 收集装置 (纯净的)或 (干燥的) (唯一的) 或 净 化 可用浓硫酸或碱石灰干燥 用NaHCO3溶液除去HCl,浓硫酸干燥 用NaOH溶液除去HCl 杂质,用浓硫酸干燥 收集方法 排水法、向上排空气法 只能用向上排空气法 排水法或向下排空气法 检验方法 将带火星的木条插入集气瓶内,若木条复燃,说明是氧气。 将气体通入澄清的石灰水,若澄清的石灰水变浑浊, 说明是二氧化碳 点燃气体,检 验其生成产物。 淡蓝色火焰, 生成H2O 验满或验纯 用向上排空气法收集时,将带火星的木条靠近集气瓶口,若木条复燃,说明已收集满。 用排水法收集时,集气瓶口有气泡冒出。 将燃着的木条靠近集气瓶口,若木条熄灭,说明已收集满。 用拇指堵住倒置已收集满氢气的试管,靠近火焰后移开手指,若听到“噗”的一声,说明已纯。 注意事项 ⑴先检查装置的 气密性 ⑵用排水法收集时,待气泡连续均匀排出时才收集 ⑶导管置集气瓶口 ⑴先检查装置气密性 ⑵试管口略向下倾斜 ⑶试管口放一团棉花 ⑷先移出导气管,后 停止加热,以防倒吸 ⑸正放 ⑴ 不能用稀硫酸,因反应生成CaSO4附着在大理石表面,阻止反应继续进行。 ⑵ 长颈漏斗的末端应插到液体中(分液漏斗不强调) ⑶ 正放保存 ⑴先检查装置气密性 ⑵先验纯再收集 ⑶不能用浓硫酸 ⑷长颈漏斗的末端应插到液体中 ⑸倒放保存 工业制取 分离液态空气(依氧气和氮气的沸点不同) 加压、蒸发——物理变化。 高温煅烧石灰石 CaCO3CO2↑+ CaO 分离水煤气H2和CO 注明: 1. 科王固固加热装置——凡是反应物都为固体且反应需要加热的发生装置图可用图②。 2. 固液不加热装置——凡是反应物为固体和液体且反应不需加热的发生装置图均可用图①、③、④。 二、气体的净化与干燥 1.除杂原则:①不能引入新的气体杂质;②不能减少被净化气体的量。 2.干燥剂的选择:(干燥原则:干燥剂不能与被干燥气体发生化学反应)。 干燥装置 洗气瓶(盛液体) 干燥管(固体干燥剂) U形管(固体干燥剂) 仪 器 无水硫酸铜 (遇水变蓝) 干燥剂 浓硫酸 固体NaOH、生石(CaO)、 碱石灰等 无水CaCl2、 无水硫酸铜(CuSO4) 固NaOH、 生石(CaO)、 碱石灰等 无水CaCl2、 无水硫酸铜(CuSO4) 能干燥 的气体 SO2、CO2、HCl; H2、O2、CO、N2、CH4 NH3; H2、O2、CO、N2、CH4 SO2、CO2、HCl;H2、O2、CO、 N2、CH4 NH3; H2、O2、CO、N2、CH4 SO2、CO2、HCl;H2、O2、CO、N2、CH4 不能干燥 的气体 NH3 SO2、CO2、 HCl NH3 SO2、CO2、 HCl NH3 注明:(碱石灰是由CaO固体和NaOH固体组成的混合物)。 3.常见吸收剂及能吸收的气体: 吸收剂 吸收的气体 吸收剂 吸收的气体 水 HCl、NH3 NaOH溶液或石灰水 HCl、CO2 碱石灰(NaOH和CaO) CO2、水蒸气、HCl 灼热铜丝或铁丝 O2 浓硫酸、无水CuSO4 H2O 灼热氧化铜 CO、H2 4.尾气的吸收及处理——环保意识 ①.溶液吸收:如CO2、SO2、HCl、NH3等可用NaOH 溶液吸收(极易溶气体要防止倒吸)。 ②.点燃处理:如CO、CH4、H2S等可燃性气体可接一个尖嘴导管,将其点燃。 Fe2O3 CO 澄清的 石灰水 ③.气球收集:如有毒的CO、H2S、Cl2等可在导管末端接上一个气球收集。 ④.防倒吸装置:如易溶的气体可收集到倒立的漏斗中。 纯净的氢气 干燥的 烧杯 6.“万能瓶”的几种主要用途: (1).集气:(贮气)学科王注明:气体的性质决定收集的方法 b a ①如瓶中为空气,即用排空气法收集气体时,密度比空气大的气体从a管进,密度小的从b管进。 ②若瓶中为水,即用排水法收集气体时,气体从b管进。 (2).洗气:(长入短出) 瓶内装浓硫酸或氢氧化钠溶液。 (3).量气:(短入长出) 瓶内装满水,气体从b端进入,a端接量筒,通过测量量筒内水的体积从而测得生成气体的体积。 (4).安全瓶:(长入短出) 点燃可燃气体时,瓶内装少量水,将点燃的气体与从发生装置产生的气体分隔开。 收集法 排水集气法 向上排空气法 排空气法 实验图 O2、H2、CO、CH4 O2、CO2 H2、NH3、CH4 气 体 性 质 适用不易溶于水、难溶于水 且不与水发生反应的气体。 适用不跟空气发生反应 且密度比空气大的气体。 适用不跟空气发生反应 且密度比空气小的气体。 三、常见气体的性质和用途: (一)重要的三种气体:氢气、氧气、二氧化碳 1.物理性质:H2无色无味气体,密度比空气 小 ,难 溶于水 O2无色无味气体,密度比空气 大 ,不易 溶于水 CO2无色无味气体,密度比空气 大 ,能 溶于水 2.化学性质: H2 ⑴.可燃性 ⑵.还原性 2H2+ O22H2O H2+ CuOCu + H2O O2 ⑴.与金属反应 ⑵.与非金属反应 ⑶.与化合物反应 2Mg+ O22MgO 3Fe+ 2O2 Fe3O4 C+ O2CO2 S+ O2SO2 4P+ 5O22P2O5 CH4+2O2 CO2+ 2H2O C2H5OH+3O22CO2+3H2O 2CO+ O22CO2 CO2 ⑴.与水反应 ⑵.与石灰水反应 ⑶.与碳反应 CO2+ H2OH2CO3 CO2+Ca(OH)2CaCO3↓+H2O CO2+ C2CO 3.用途的比较:氢气用途⑴填充气球;⑵高能燃料;⑶冶炼重要金属 氧气用途 ⑴支持燃烧;⑵供给呼吸;⑶用于炼钢 二氧化碳:⑴灭火;⑵作工业原料(制饮料、纯碱、化肥等);⑶“干冰”用于人工降雨 ⑷植物的光合作用 (二)具有可燃性的三种气体:氢气、一氧化碳、甲烷 1.化学性质(可燃性): H2 可燃性 H2、CO、CH4的检验 2H2+ O22H2O 点燃后,⑴在火焰上方罩一干冷的小烧杯,烧杯内壁没有 水雾 ,该气体是 CO ;⑵在火焰上方罩一内壁附有澄清石灰水的小烧杯,石灰水变 浑浊 ,该气体是 CH4 ;另一气体就是 H2 。 CO 2CO+ O22CO2 CH4 CH4+2O2 CO2+ 2H2O (三)具有可燃性和还原性的三种物质:氢气、一氧化碳、碳 1.物理性质: 颜 色 气 味 状 态 密 度 溶 解 性 H2 无色 无味 气体 比空气 小 难 溶于水 CO 无色 无味 气体 比空气 略小 难 溶于水 C 金刚石和石墨的物理性质不同,是因为它们中的 碳原子的排列方式 不同。 金刚石和石墨是由 碳 元素组成的 碳单质 的物质;它们的物理性质 不同 ,但化学性质 相同 。(填:相同、不同) 2.化学性质: H2 ⑴.可燃性 ⑵.还原性 2H2+ O22H2O H2+ CuOCu + H2O CO 2CO+ O22CO2 CO+ CuOCu + CO2 C C+ O2CO2 C+2CuO2Cu+CO2↑ [解题策略指导]学科王 一定要熟知常见气体的制取、干燥、除杂、装置的连接顺序和性质的检验。 除杂和干燥的先后顺序:①若用洗气装置除杂,一般除杂在前,干燥在后;②若用加热装置除杂,一般是干燥在前,除杂在后。 洗气瓶和干燥管中气体的进出口顺序:①用洗气瓶除杂和干燥时,气体应长进短出;②用球型干燥管除杂或干燥时,气体应大进(即大管口进气)小出(即小管口出气),以利于气体充分干燥。 检验多种气体的先后顺序:有多种气体需要检验时,应尽量避免前步检验对后步检验的干扰。如被检验的气体中是否含有二氧化碳和水蒸气时,应先检验水(用无水硫酸铜检验),后检验二氧化碳(用澄清石灰水检验),最后干燥水(用浓硫酸干燥)。 记住常见物质的特征反应:CO2能使澄清石灰水变浑浊,白色的无水硫酸铜遇H2O变蓝。要验证H2和CO等还原性气体,可先将净化后的气体通过灼热的CuO,再检验其产物。检验H2的存在是通过其与CuO反应生成H2O,检验H2O时一定要将产物先通过无水 CuSO4检验。要验证CO和CO2的混合气体,可先将混合气体通入澄清石灰水,后通过灼热的CuO,再检验CO。 例题解析: 1.氨气(NH3)是一种无色、有刺激性气味的气体,密度比空气小,极易溶于水。加热氯化铵(NH4Cl)和熟石灰两种固体的混合物可制取氨气,同时生成氯化钙和水。回答下列问题:(1)实验室制取氨气的化学方程式为: ;最好选用下图 (选填装置A、B、C、D)气体发生装置制取氨气 (2)欲制得氨气(氨气溶于水),且能避免倒吸,最好在其发生装置后连接下图 装置。(选填E或F)。 2. 实验室用下图所示装置的部分或全部组合后完成如下实验,请回答下列问题: d e A B C D (1)小明要证明鸡蛋壳的主要成分是碳酸盐,他将A装置中的导气管a与C装置中的导气管 相连,当装置C中产生 的现象时即达到实验目的。 (2)若将A装置中的药品换成稀硫酸和锌粒,产生的H2经干燥后用D装置收集,当D装置的瓶口向下时,导管口的连接顺序应是a→ 。 (3)B装置中使用过的浓硫酸稀释后,还可以用作它用, 用烧杯稀释浓硫酸时,应向烧杯中倒入的物质是 。 3.在实验室中,同学们用如下装置制取纯净的CO2,下列说法不正确的是 [查阅资料]饱和碳酸氢钠溶液可以吸收HCl而不吸收CO2 A.①中固体反应物也可用Na2CO3代替 B.③中没有白色沉淀产生,说明CO2气体中已经不混有HCl气体 C.④中浓H2SO4的作用是吸收CO2气体中混有的H2O D.将燃着的小木条放在⑤中的集气瓶中,可以检验集气瓶是否收集满CO2 思考:各装置的作用? 巩固练习: 1.下列选项中括号内物质为杂质,右边为除杂试剂,其中合理的是 ( ) A.SO2(HCl) 氢氧化钠溶液 B.O2(H2O) 浓硫酸 C.H2(O2) 灼热的氧化铜 D.CO(SO2) 灼热的氧化铜 2.实验室常利用以下装置完成气体制备及性质实验。请回答: ① A B C D E F b a c 混合 气体 澄清的 石灰水 稀盐酸 ② (1)指出编号仪器的名称:① ,② 。 (2)以上 (从A—E中选择)装置有一处明显的错误,请加以改正 。利用改正后的装置继续完成后面的实验。 (3)欲使用高锰酸钾制取氧气,应选择的发生装置是 (填字母),反应原理用化学方程式表示为 ;为防止高锰酸钾粉末进入导管,应采取的措施是 ;若使用C装置收集氧气,实验结束时,应先从水槽中移出导气管,再熄灭酒精灯,原因是 。 (4)将CO2和CO的混合气体通过F装置(液体药品均足量),实验开始时关闭活塞b,打开活塞a,广口瓶中观察到的现象是 ,此时从导管c逸出的气体主要是 。一段时间后,再关闭活塞a,打开活塞b,将分液漏斗中的稀盐酸滴入广口瓶中,此时逸出的气体主要是 ,反应原理用化学方程式表示为 ,欲收集该气体,应选择的装置是 (填字母),验满的方法是 。 3. (2013南宁市)实验室部分仪器或装置如下图所示,请回答下列问题。 (1)实验室常用石灰石和稀盐酸制取二氧化碳气体,发生装置可选择图中的___________(填仪器字母)进行组装,反应的化学方程式为__________________________________________。学科王 (2)在制取过程中,小雨同学选用F装置收集二氧化碳,并用燃着的小木条放在瓶口验证二氧化碳是否收集满,结果发现小木条始终不灭,说明该瓶气体没有集满。出现上述情况的原因可能是1_________________,2_________________,3_________________(写出其中3条)。 (3)采用上述方法制取的二氧化碳中常含有氯化氢气体和水蒸气。为获得纯净、干燥的二氧化碳气体,可选用右图所示的H装置和I装置进行除杂和干燥,导管口连接的正确顺序是: 气体→( )→( )→( )→( )→F。 (4)在实验室中制取氢气,发生装置与制二氧化碳的相同,收集方法可采用(填“向上”或“向下”)排空气法。若用右图所示J装置采用“排空气法”收集氢气,请在图中将导管补画完整。 为了探究二氧化碳的性质,某同学设计了如图所示的实验: (1)写出石灰石与稀盐酸反应的化学方程式: 。 (2)用注射器注入稀盐酸,一段时间后,可观察到在1、2两处中有一处有明显的现象发生,该实验现象是 。 (3)3处的澄清石灰水变浑浊,这是由于 的缘故。 (4)说出该改进装置的优点(写一条) 。 某校化学兴趣小组的同学根据实验室提供的仪器和药品,在老师的指导下从下图中选择装置进行了氧气的制备实验。学科王 A B C D E (1)写出仪器a的名称: 。 (2)甲同学从上图中选择B、E装置的组合制取氧气,反应的化学方程式为: ① 。在用胶皮管连接装置B和E中的玻璃导管时,应先把玻璃管口 ② ,然后稍稍用力把玻璃管插入胶皮管。收集气体前,应将集气瓶装满 ③ 并盖上 ④ 。收集氧气还可选用的装置是 ⑤ 。 (3)乙同学称取一定质量的KMnO4固体放入大试管中,将温度控制在250℃加热制取O2。实验结束时,乙同学发现用排水法收集到的O2大于理论产量。针对这一现象,同学们进行了如下探究: [提出猜想]猜想I:反应生成的MnO2分解放出O2; 猜想II:反应生成的K2MnO4分解放出O2; 猜想III:反应生成的K2MnO4和MnO2分解都放出O2。 [实验验证]同学们分成两组,分别进行下列实验: 第一组同学取一定质量的MnO2,在250℃条件下加热一段时间,冷却后测得MnO2的质量不变,则猜想 ① 错误;第二组同学取K2MnO4在250℃条件下加热,没有用测定质量的方法得出了猜想II正确的结论。该组同学选择的实验方法是 ② 。 [拓展延伸]实验发现,KClO3固体加热制取O2的反应速率很慢,但如果将KMnO4固体与KClO3固体混合加热,则KClO3的分解速率大大加快。请说明KMnO4在KClO3的分解反应中是否作催化剂,为什么? ③ 。 [实验反思]通过以上实验探究,你对“实验室制取氧气”还想探究的问题是 ④ 。 4.氯气有毒,会对上呼吸道黏膜造成伤害,症状严重时会致人死亡,少量氯气可通过碱溶液除去。 某同学利用“多米诺骨牌”效应,设计了如图气体制取与性质验证的组合实验,打开A中分液漏斗的活塞,很快看到E中导管口有气泡冒出,且溶液由紫色变红色.请看图回答问题: (1)A中反应的化学方程式 ;B中白磷不燃烧,原因是 . (2)C、D中看到的现象分别是 、 . (3)用化学方程式表示E中颜色变化的原因 ;用F装置收集气体的依据是 .查看更多