- 2021-04-28 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
【化学】四川省宜宾市叙州区第一中学校2020届高三下学期第四学月考试理综
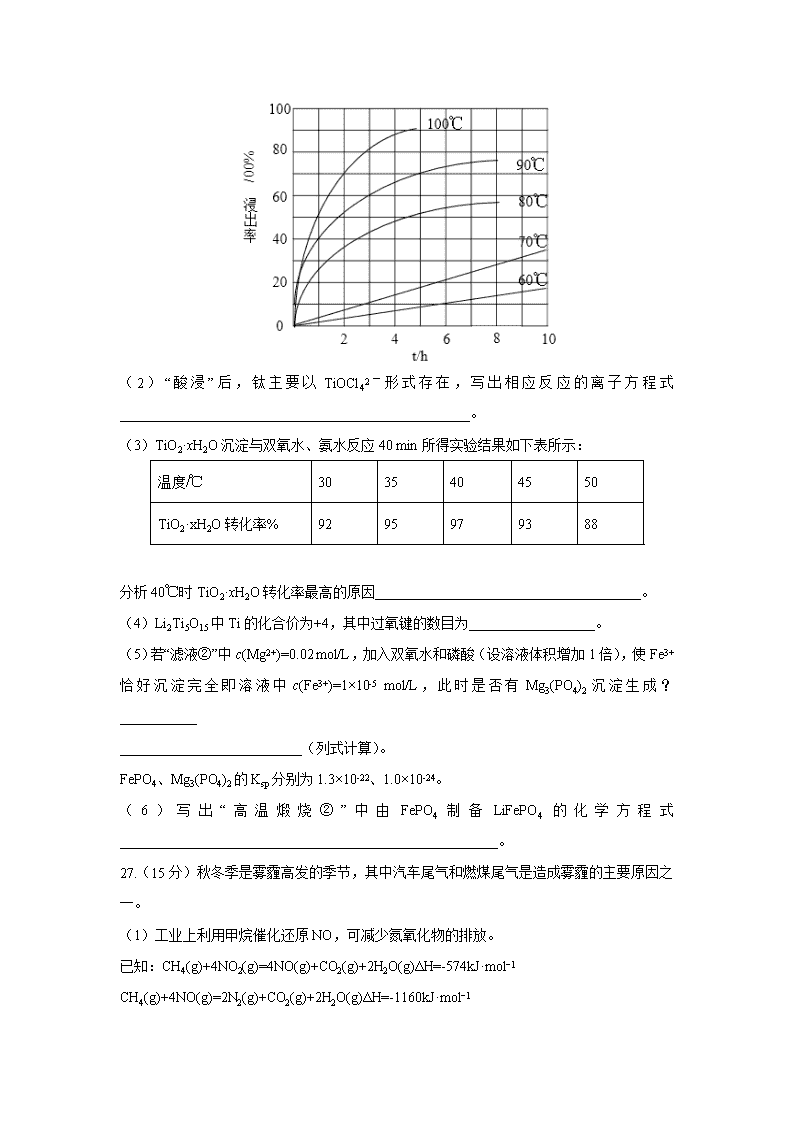
四川省宜宾市叙州区第一中学校2020届高三下学期第四学月考试理综 7.化学与生产、生活密切相关,下列说法不正确的是( ) A.碳酸钠俗称纯碱,可用于去除餐具的油污 B.盐碱地不利于作物生长,可通过施加生石灰进行改良 C.用K2FeO4处理自来水,既可杀菌消毒又可除去悬浮杂质 D.生产医用口罩的聚丙烯树脂原料属于合成有机高分子材料 8.设NA表示阿伏伽德罗常数的值。下列说法正确的是( ) A.由H218O与D216O组成的2.0g物质中所含中子、电子数均为NA B.0.1molFe分别与足量的盐酸和氯气反应,转移的电子数均为0.2NA C.0.1molAl与足量NaOH溶液反应,生成氢分子数为0.3NA D.25℃,将0.1molCH3COONa加入稀醋酸至溶液呈中性时,溶液中CH3COO-数小于0.1NA 9.氨是制造化肥的重要原料,如图为工业合成氨的流程图。下列有关说法错误的是( ) A.工业上制氮气一般用分离液态空气法 B.步骤②、③、④、⑤均有利于提高反应物的平衡转化率 C.步骤①中“净化”N2、H2混合气体可以防止催化剂中毒 D.步骤③中温度选择500℃,主要是考虑催化剂的活性 10.下列指定反应的离子方程式正确的是( ) A.将铜插入稀硝酸中:Cu+4H++2NO3–=Cu2++2NO2↑+H2O B.向Fe2(SO4)3溶液中加入过量铁粉:Fe3++Fe=2Fe2+ C.向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+ D.向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+=H2SiO3↓+2Na+ 11.已知M是短周期金属元素,X和Y是短周期非金属元素,且X、M、Y的原子序数依次增大。三者组成的物质M3XY(可视为M2X∙MY)是一种良好的离子导体。研究者在常压下利用下列反应合成M3XY: 2M + 2MXA +2MY==2M3XY +A2。其中常温常压下A2是无色无味气体,已知上述反应中消耗0.92 g M的单质可得到标准状况下448 mL的A2 。下列有关说法正确的是( ) A.简单离子半径:Y>M>X B.简单氢化物的沸点:X小于Y C.MXA是共价化合物 D.M3XY溶于水后溶液呈碱性 12.设NA为阿伏加德罗常数值。关于常温下pH=2的H3PO4溶液,下列说法正确的是( ) A. 每升溶液中的H+数目为0.02NA B. c(H+)= c()+2c()+3c()+ c(OH−) C. 加水稀释使电离度增大,溶液pH减小 D. 加入NaH2PO4固体,溶液酸性增强 13.支撑海港码头基础的钢管柱,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是( ) A. 通入保护电流使钢管桩表面腐蚀电流接近于零 B. 通电后外电路电子被强制从高硅铸铁流向钢管桩 C. 高硅铸铁的作用是作为损耗阳极材料和传递电流 D. 通入的保护电流应该根据环境条件变化进行调整 26(14分).Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下: 回答下列问题: (1)“酸浸”实验中,铁的浸出率结果如下图所示。由图可知,当铁的净出率为70%时,所采用的实验条件为___________________。 (2)“酸浸”后,钛主要以TiOCl42-形式存在,写出相应反应的离子方程式__________________________________________________。 (3)TiO2·xH2O沉淀与双氧水、氨水反应40 min所得实验结果如下表所示: 温度/℃ 30 35 40 45 50 TiO2·xH2O转化率% 92 95 97 93 88 分析40℃时TiO2·xH2O转化率最高的原因______________________________________。 (4)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为__________________。 (5)若“滤液②”中c(Mg2+)=0.02 mol/L,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1×10-5 mol/L,此时是否有Mg3(PO4)2沉淀生成?___________ __________________________(列式计算)。 FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24。 (6)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式______________________________________________________。 27.(15分)秋冬季是雾霾高发的季节,其中汽车尾气和燃煤尾气是造成雾霾的主要原因之一。 (1)工业上利用甲烷催化还原NO,可减少氮氧化物的排放。 已知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)ΔH=-574kJ·mol−1 CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)ΔH=-1160kJ·mol−1 甲烷直接将NO2还原为N2的热化学方程式为_____________________________________。 (2)汽车尾气催化净化是控制汽车尾气排放、减少汽车尾气污染的最有效的手段,主要原理为2NO(g)+2CO(g)N2(g)+2CO2(g)ΔH<0 T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中,保持温度和体积不变,反应过程(0~15min)中NO的物质的量随时间变化如上图所示。 ①已知:平衡时气体的分压=气体的体积分数×体系的总压强,T℃时达到平衡,此时体系的总压强为p=20MPa,则T℃时该反应的压力平衡常数Kp=___________;平衡后,若保持温度不变,再向容器中充入NO和CO2各0.3mol,平衡将_____(填“向左”、“向右”或“不”)移动。 ②15min时,若改变外界反应条件,导致n(NO)发生如图所示的变化,则改变的条件可能是______(填序号) A.增大CO浓度 B.升温 C.减小容器体积 D.加入催化剂 (3)工业上常采用“碱溶液吸收”的方法来同时吸收SO2,和氮的氧化物气体(NOx),如用氢氧化钠溶液吸收可得到Na2SO3、NaHSO3、NaNO2、NaNO3等溶液。已知:常温下,HNO2的电离常数为Ka=7×10-4,H2SO3的电离常数为Ka1=1.2×10-2、Ka2=5.8×10-8。 ①常温下,相同浓度的Na2SO3、NaNO2溶液中pH较大的是______溶液。 ②常温下,NaHSO3显_______性(填“酸”“碱”或“中”,判断的理由是(通过计算说明)_________ ________________________________________________________________________。 (4)铈元素(Ce)是镧系金属中自然丰度最高的一种,常见有+3、+4两种价态。雾霾中含有大量的污染物NO,可以被含Ce4+的溶液吸收,生成NO2-、NO3-(二者物质的量之比为1∶1)。可采用电解法将上述吸收液中的NO2-转化为无毒物质,同时再生Ce4+,其原理如图所示。 ①Ce4+从电解槽的_____(填字母代号)口流出。②写出阴极的电极反应式:________________。 28.(14分)高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题: 相关金属离子[c0(Mn+)=0.1 mol·L−1]形成氢氧化物沉淀的pH范围如下: 金属离子 Mn2+ Fe2+ Fe3+ Al3+ Mg2+ Zn2+ Ni2+ 开始沉淀的pH 8.1 6.3 1.5 3.4 8.9 6.2 6.9 沉淀完全的pH 10.1 8.3 2.8 4.7 10.9 8.2 8.9 (1)“滤渣1”含有S和___________;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式_________________________________________________。 (2)“氧化”中添加适量的MnO2的作用是将____________________________。 (3)“调pH”除铁和铝,溶液的pH范围应调节为_______~6之间。 (4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是______________。 (5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是_________________________________________________。 (6)写出“沉锰”的离子方程式_____________________________。 (7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnzO2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y=时,z=___________。 35.(15分)东晋《华阳国志•南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题: (1)镍元素基态原子的电子排布式为_________,3d能级上的未成对的电子数为______。 (2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。 ①SO42−中阴离子的立体构型是_________。 ②在[Ni(NH3)6]SO4中Ni2+与NH3之间形成的化学键称为______________,提供孤电子对的成键原子是_________。 ③氨的沸点_____(填“高于”或“低于”)膦(PH3),原因是________________________________;氨是_____分子(填“极性”或“非极性”),中心原子的轨道杂化类型为_______。 (3)单质铜及镍都是由______键形成的晶体:元素铜与镍的第二电离能分别为:ICu=1959kJ/mol,INi=1753kJ/mol,ICu>INi的原因是__________________________________。 (4)某镍白铜合金的立方晶胞结构如图所示。 ①晶胞中铜原子与镍原子的数量比为_____。 ②若合金的密度为dg/cm3,晶胞参数a=________nm。 36(15分).吡喹酮(H)是一种治疗血吸虫病的药物,合成路线如下图所示: 已知:I R-Cl+NaCNR-CN+NaCl ii +R′-NH-R"+NaOH+NaCl+H2O(R、R′表示烃基,R"表示烃基或H) (1)A 属于芳香烃,其名称是________________________。 (2)步骤②的反应类型是_______________________________。 (3)B 的一种同分异构体,含苯环且核磁共振氢谱中出现三组峰,其结构简式为______________。 (4)③中 1mol C 理论上需要消耗______mol H2生成 D。 (5)④的化学方程式是 ____________________________________________。 (6)F 中含氧官能团是 和_______________________(填名称)。 (7)试剂 a 的结构简式是___________________。 (8)G→H 分为三步反应,J 中含有 3 个六元环,写出 I、J 的结构简式。 I:_____________;J:_____________。 【参考答案】 7-13:BABCDBC 26. 100℃、2h,90℃,5h FeTiO3+ 4H++4Cl− = Fe2++ TiOCl42− + 2H2O 低于40℃,TiO2·xH2O转化反应速率随温度升高而增加;超过40℃,双氧水分解与氨气逸出导致TiO2·xH2O转化反应速率下降 4 Fe3+恰好沉淀完全时,c(PO43-)= mol·L−1=1.3×10-17 mol·L−1,c3(Mg2+)×c2(PO43-)=(0.01)3×(1.3×10-17)2=1.7×10-40<Ksp [Mg3(PO4)2],因此不会生成Mg3(PO4)2沉淀。 2FePO4 + Li2CO3+ H2C2O42LiFePO4+ H2O↑+ 3CO2↑ 27.CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ΔH=-867kJ·mol−1 0.0875(MPa)-1或(MPa)-1 不 AC Na2SO3 酸 因为HSO3-的电离常数Ka2=5.8×10-8,水解常数Kh=≈8.3×10-13,电离常数大于水解常数,所以溶液显酸性 a 2NO2-+8H++6e−=N2↑+4H2O 28.SiO2(不溶性硅酸盐) MnO2+MnS+2H2SO4=2MnSO4+S+2H2O 将Fe2+氧化为Fe3+ 4.7 NiS和ZnS F−与H+结合形成弱电解质HF,MgF2Mg2++2F−平衡向右移动 Mn2++2=MnCO3↓+CO2↑+H2O 35.1s22s22p63s23p63d84s2或 [Ar]3d84s2 2 正四面体 配位键 N 高于 NH3分子间可形成氢键 极性 sp3 金属 Cu+:3d10,全满,能量低,稳定,难失去3d10的电子,Ni+:3d104s1,镍失去的是4s1电子 3:1 36.甲苯 取代反应 2 ++NaOH→+NaCl+H2O 羟基 查看更多