- 2021-04-28 发布 |
- 37.5 KB |
- 5页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学第一轮复习课件第4讲 难溶电解质的溶解平衡-8沉淀溶解平衡常数及其应用
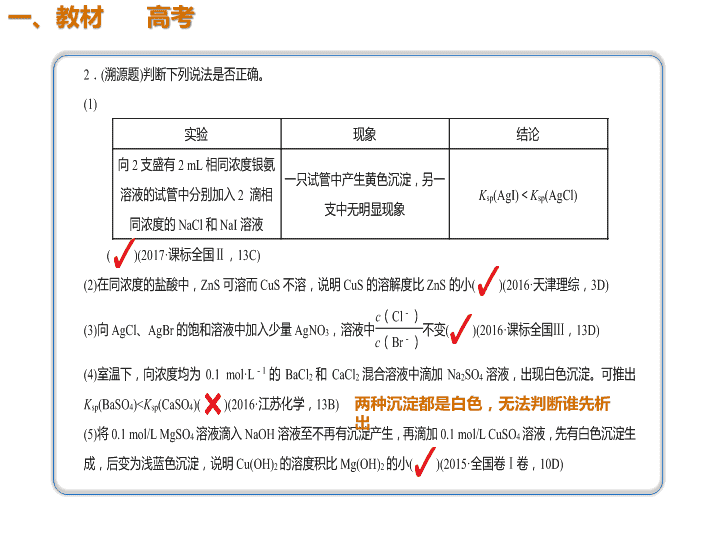
01 02 03 04 典例剖析 方法归纳 教材 高考 两种沉淀都是白色,无法判断谁先析 出 3.25 ℃时,FeS和ZnS的饱和溶液中,金属阳离子 与S2-的物质的量浓度的负对数关系如图所示。下列说 法正确的是( ) A.溶解度:S(FeS)<S(ZnS) B.a点表示FeS的不饱和溶液,且c(Fe2+)>c(S2-) C.向b点对应溶液中加入Na2S溶液,可转化为c点对 应的溶液 D.向c点对应的溶液中加入Na2S溶液,ZnS的Ksp增 大 B K值只与温度有 关 解析 由题图可知ZnS的溶度积远小于FeS,又因 为FeS和ZnS的摩尔质量相差不大,故溶解度S(FeS) >S(ZnS),A项错误;a点FeS的离子浓度积小于其 溶度积,故为不饱和溶液,根据图中数据知c(Fe2+) >c(S2-),故B项正确;向b点对应溶液中加入Na2S 溶液,c(S2-)增大,而b点到c点c(S2-)减小,C项错 误;Ksp只与温度有关,向c点对应的溶液中加入 Na2S溶液,ZnS的Ksp不变,D项错误。 沉淀溶解平衡图像题的解题策略 1.沉淀溶解平衡曲线类似于溶解度曲线, 曲线上任一点都表示饱和溶液,曲线上方 的任一点均表示过饱和溶液,此时有沉淀 析出,曲线下方的任一点均表示不饱和溶 液。 2.从图像中找到数据,根据Ksp公式计算得 出Ksp的值。 3.比较溶液的Qc与Ksp的大小,判断溶液中 有无沉淀析出。 4.涉及Qc的计算时,所代入的离子浓度一 定是混合溶液中的离子浓度,因此计算离 子浓度时,所代入的溶液体积也必须是混 合溶液的体积。查看更多