2020-2021学年高三上学期月考理综-化学试题(四川省仁寿第一中学校北校区)
7.化学与生活、生产密切相关,下列说法正确的是()
A. 月饼因富含油脂而易被氧化,保存时常放入装有硅胶的透气袋
B. 离子交换膜在工业上应用广泛,在氯碱工业中使用阴离子交换膜
C. 钢铁在潮湿的空气中,易发生化学腐蚀生锈
D.《本草经集注》中关于鉴别硝石(KNO3)和朴硝(Na2SO4)的记载:“以火烧之,紫青烟起,乃真硝石也”,该方法应用了焰色反应
8.设NA为阿伏伽德罗常数的值。下列说法正确的是()
A. 标准状况下, L的C2H4和C3H6的混合物中含有的碳碳双键数目为NA
B. 100 g 质量分数17%H2O2溶液中极性键数目为NA
C. 0.1mol MnO2与40mL 10mol/L的浓盐酸充分反应,生成的氯气分子数为0.1NA
D. 65 g Zn溶于浓硫酸中得混合气体分子数为NA
9.短周期元素W、X、Y、Z的原子序数依次增加。W、X、Y简单离子的电子层结构相同,X元素在短周期主族元素中原子半径最大;W的简单氢化物常温下呈液态,Y的氧化物和氯化物熔融时都能导电,X、Y和Z原子的最外层电子数之和为10。下列说法正确的是()
A. W、Z形成的化合物可做消毒剂
B. 原子半径:W
Ksp(CuS)
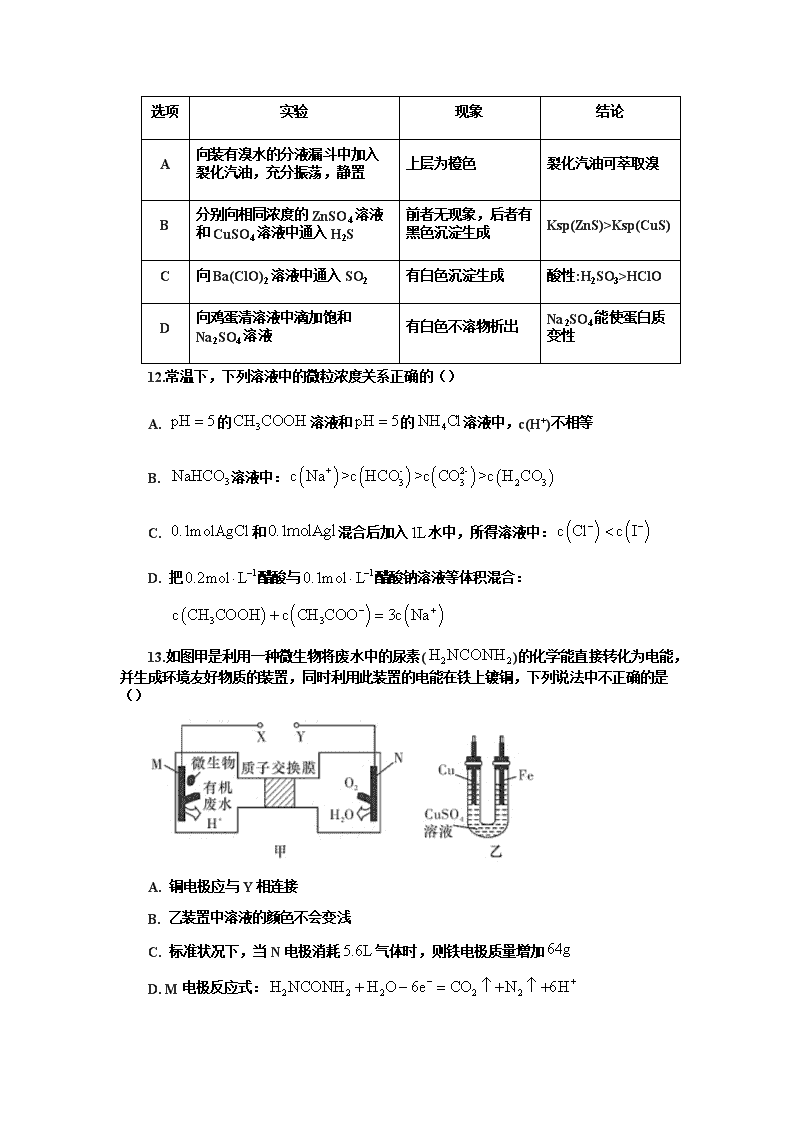
C
向Ba(ClO)2溶液中通入SO2
有白色沉淀生成
酸性:H2SO3>HClO
D
向鸡蛋清溶液中滴加饱和Na2SO4溶液
有白色不溶物析出
Na2SO4能使蛋白质变性
12.常温下,下列溶液中的微粒浓度关系正确的()
A. 的溶液和的溶液中,c(H+)不相等
B. 溶液中:
C. 和混合后加入水中,所得溶液中:
D. 把醋酸与醋酸钠溶液等体积混合:
13.如图甲是利用一种微生物将废水中的尿素()的化学能直接转化为电能,并生成环境友好物质的装置,同时利用此装置的电能在铁上镀铜,下列说法中不正确的是()
A. 铜电极应与Y相连接
B. 乙装置中溶液的颜色不会变浅
C. 标准状况下,当N电极消耗气体时,则铁电极质量增加
D. M电极反应式:
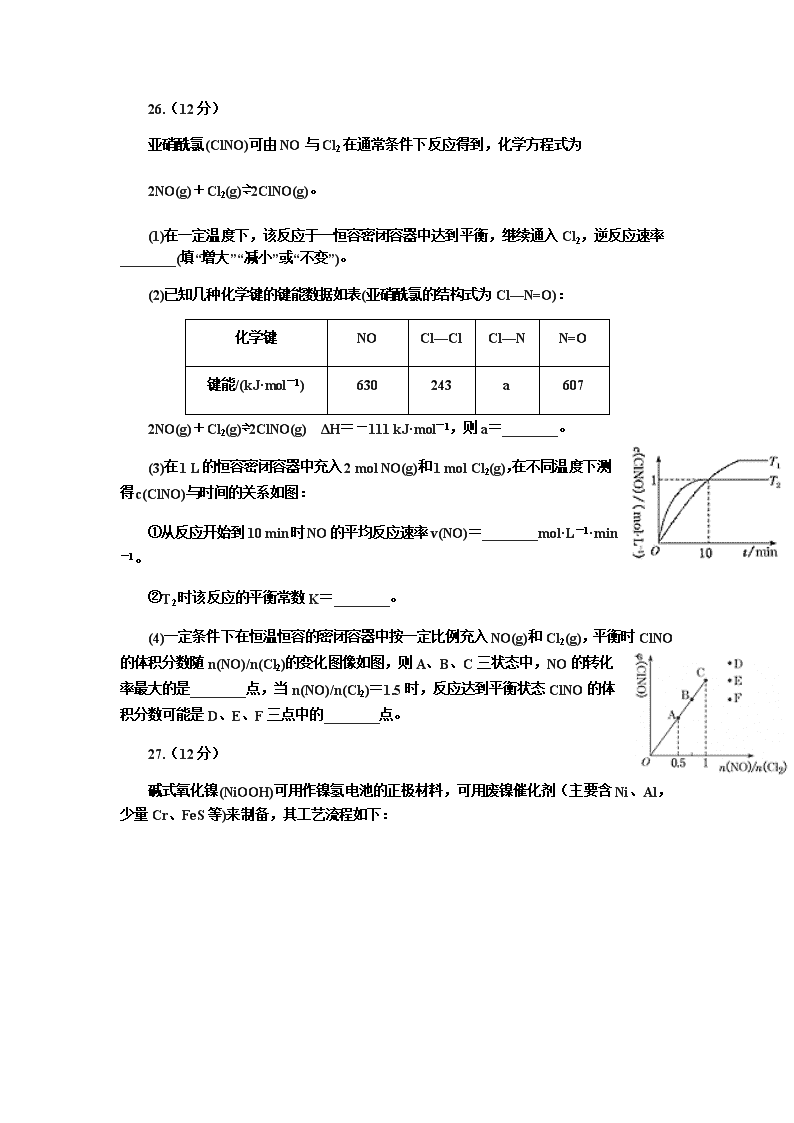
26.(12分)
亚硝酰氯(ClNO)可由NO与Cl2在通常条件下反应得到,化学方程式为
2NO(g)+Cl2(g)⇌2ClNO(g)。
(1)在一定温度下,该反应于一恒容密闭容器中达到平衡,继续通入Cl2,逆反应速率________(填“增大”“减小”或“不变”)。
(2)已知几种化学键的键能数据如表(亚硝酰氯的结构式为Cl—N=O):
化学键
NO
Cl—Cl
Cl—N
N=O
键能/(kJ·mol-1)
630
243
a
607
2NO(g)+Cl2(g)⇌2ClNO(g) ΔH=-111 kJ·mol-1,则a=________。
(3)在1 L的恒容密闭容器中充入2 mol NO(g)和1 mol Cl2(g),在不同温度下测得c(ClNO)与时间的关系如图:
①从反应开始到10 min时NO的平均反应速率v(NO)=________mol·L-1·min-1。
②T2时该反应的平衡常数K=________。
(4)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(Cl2)的变化图像如图,则A、B、C三状态中,NO的转化率最大的是________点,当n(NO)/n(Cl2)=1.5时,反应达到平衡状态ClNO的体积分数可能是D、E、F三点中的________点。
27.(12分)
碱式氧化镍(NiOOH)可用作镍氢电池的正极材料,可用废镍催化剂(主要含Ni、Al,少量Cr、FeS等)来制备,其工艺流程如下:
回答下列问题:
(1)“浸泡除铝”时,发生反应的离子反应方程式为。
(2)“溶解”时放出的气体为(填化学式)。
(3)已知该条件下金属离子开始沉淀和完仝沉淀的pH如下表:
开始沉淀的pH
完全沉淀的pH
Ni2+
6.2
8.6
Fe2+
7.6
9.1
Fe3+
2.3
3.3
Cr3+
4.5
5.6
“调pH 1”时,溶液pH范围为;
(4)在空气中加热Ni(OH)2可得NiOOH,请写出此反应的化学方程式
。
(5)金属铬在溶液中有多种存在形式,CrO42-和Cr2O72-在溶液中可相互转化。用离子方程式表示Na2CrO4溶液中的转化反应,温度升髙,溶液中CrO42-的平衡转化率减小,则该反应的△H0 (填“>”、“<”或“=”)。
28.(16分)
为了探究乙二酸的不稳定性、弱酸性和还原性,某化学兴趣小组设计如下实验。
[查阅资料]乙二酸俗称草酸,草酸晶体(H2C2O4·2H2O)在100℃时开始升华,157℃时大量升华并开始分解;草酸蒸气在低温下迅速冷凝为固体;草酸钙不溶于水,草酸蒸气能使澄清石灰水变浑浊。
I.乙二酸的不稳定性:根据草酸晶体的组成,猜想其受热分解产物为CO、CO2和H2O。
(1)请用下列装置组成一套探究并验证其产物的实验装置。请回答下列问题:
①装置的连接顺序为:A→D→____→____→F→E→C→G。
②装置中冰水混合物的作用是。
③整套装置存在不合理之处。
Ⅱ.乙二酸的弱酸性:
该小组同学为验证草酸性质需0.1mol/L的草酸溶液480mL。
(2)配制该溶液需要草酸晶体g。
(3)为验证草酸具有弱酸性设计了下列实验,其中能达到实验目的是
。
A.将草酸晶体溶于含酚酞的NaOH溶液中,溶液褪色
B.测定0.1mol/L草酸溶液的pH
C.将草酸溶液加入Na2CO3溶液中,有CO2放出
D.测定草酸钠溶液的pH
(4)该小组同学将0.1mol/L草酸溶液和0.1mol/L的NaOH等体积混合后,测定反应后溶液呈酸性,则所得溶液中各离子浓度由大到小的顺序为。
Ⅲ.乙二酸的还原性:
(5)该小组同学向用硫酸酸化的KMnO4溶液中滴入过量的草酸溶液,发现酸性KMnO4溶液褪色,从而判断草酸具有较强的还原性。该反应的离子方程式为
。
34.【化学——选修3】(15分)
东晋《华阳国志·南中志》已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子价层电子排布式为,能级上未成对电子数为。
(2)硫酸镍溶于氨水形成蓝色溶液。
①中阴离子的立体构型是。
②在中与之间形成的化学键称为,提供孤电子对的成健原子是。
③氨是分子(填“极性”或“非极性”),中心原子的轨道杂化类型为。
④向硫酸铜溶液逐滴加入氨水,会先生成难溶物而后溶解也能形成深蓝色溶液,写出难溶物溶于氨水的离子方程式:。
(3)单质铜及镍都是由键形成的晶体;元素铜与镍的第二电离能分别为:,,的原因是。
(4)某镍白铜合金的立方晶胞结构如图所示。
①晶胞中铜原子与镍原子的数量比为。
②若合金的密度为,
该立方晶胞的边长约为。
1
2
3
4
5
6
7
D
D
A
B
B
D
C
26.(12分)每空2分
(1). 增大 (2). 200 (3).① 0.1 ② 2 (4). A D
27.(15分)
(1). 2Al+2OH-+2H2O==2AlO2-+3H2↑ (2分)
(2) . H2、H2S (2分)
(3) . 5.6~6.2 (2分)
(4) . 4Ni(OH)2+O2 == 4NiOOH+2H2O (2分)
(5) . 2CrO42— + 2H+ ⇌ Cr2O72— + H2O;(2分)(不写可逆符号不得分)
1014(2分) <(2分) 减小(1分)
28.(16分)每空2分
(1).① B G ②除去草酸蒸气,防止干扰实验 ③没有CO尾气处理装置
(2). 6.3
(3). BD
(4). c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-)
(5). 2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
34.【化学——选修3】(15分)
(1). (1分) 2 (1分)
(2). ①正四面体(1分) ②配位键(1分) ③极性(1分) (1分)
④Cu(OH)2+4NH3•H2O=[Cu(NH3)4]2+ +2OH- +4H2O(2分)
(3). 金属(1分) 失去的是全充满的电子,失去的是电子(2分)
(4). ①3∶1(2分) ② (2分)