- 2021-04-28 发布 |
- 37.5 KB |
- 7页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019高考化学总复习化学实验1021考点一物质的分离和提纯基础小题快练新人教版
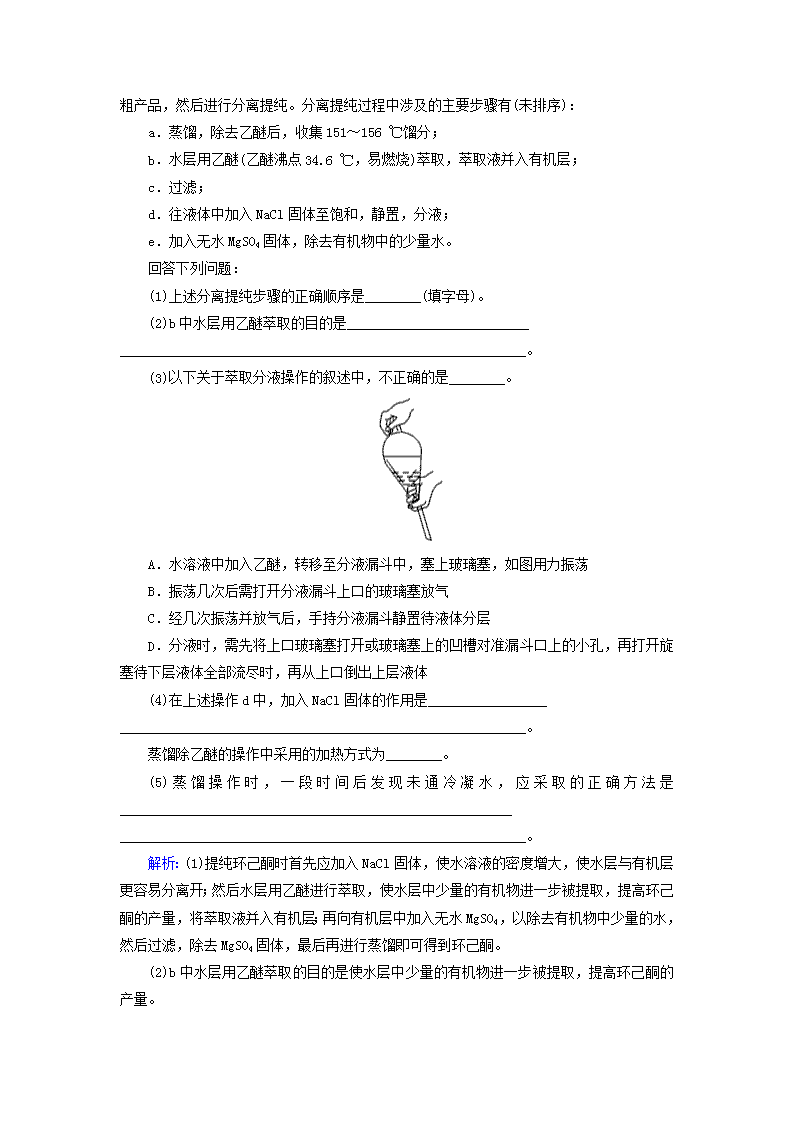
10-2-1 考点一 物质的分离和提纯 一、物质分离、提纯的装置和操作 1.完成下列实验所选择的装置或仪器都正确的是( ) 选项 A B C D 实验 分离植物 油和氯化 钠溶液 除去氯化钠晶体 中混有的氯化铵 晶体 分离CCl4 中的Br2 除去CO2 气体中的 HCl气体 装置或仪器 解析:植物油和氯化钠溶液互不相溶,可用分液法分离,A项正确;除去氯化钠晶体中混有的氯化铵晶体应用加热分解法,而不能用蒸馏法,B项错误;分离CCl4中的Br2应用蒸馏法,不能用过滤法,C项错误;NaOH溶液可以同时吸收CO2和HCl,D项错误。 答案:A 2.下列有关实验装置进行的相应实验,能达到实验目的的是( ) A.利用图1装置可从氯化铁溶液中直接蒸发结晶获得氯化铁晶体 B.利用图2装置可分离石油,得到汽油、煤油和柴油等各种馏分 C.利用图3装置可分离CH3CH2OH和CH3COOC2H5 D.利用图4和图1可进行粗盐提纯 解析:加热FeCl3溶液,FeCl3水解产生的HCl挥发,直接蒸干得到的是Fe(OH)3或Fe2O3,A项错误;石油分馏时,温度计的水银球应放在蒸馏烧瓶的支管口处,B项错误;乙醇和乙酸乙酯互溶,不能用分液法分离,C项错误。 答案:D 3.环己酮是一种重要的有机化工原料。实验室合成环己酮的反应如下: 环己醇和环己酮的部分物理性质见下表: 物质 相对分 子质量 沸点 (℃) 密度 (g·cm-3,20 ℃) 溶解性 环己醇 100 161.1 0.962 4 能溶于水和醚 环己酮 98 155.6 0.947 8 微溶于水,能溶于醚 现以20 mL环己醇与足量Na2Cr2O7 和硫酸的混合液充分反应,制得主要含环己酮和水的粗产品,然后进行分离提纯。分离提纯过程中涉及的主要步骤有(未排序): a.蒸馏,除去乙醚后,收集151~156 ℃馏分; b.水层用乙醚(乙醚沸点34.6 ℃,易燃烧)萃取,萃取液并入有机层; c.过滤; d.往液体中加入NaCl固体至饱和,静置,分液; e.加入无水MgSO4固体,除去有机物中的少量水。 回答下列问题: (1)上述分离提纯步骤的正确顺序是________(填字母)。 (2)b中水层用乙醚萃取的目的是__________________________ __________________________________________________________。 (3)以下关于萃取分液操作的叙述中,不正确的是________。 A.水溶液中加入乙醚,转移至分液漏斗中,塞上玻璃塞,如图用力振荡 B.振荡几次后需打开分液漏斗上口的玻璃塞放气 C.经几次振荡并放气后,手持分液漏斗静置待液体分层 D.分液时,需先将上口玻璃塞打开或玻璃塞上的凹槽对准漏斗口上的小孔,再打开旋塞待下层液体全部流尽时,再从上口倒出上层液体 (4)在上述操作d中,加入NaCl固体的作用是_________________ __________________________________________________________。 蒸馏除乙醚的操作中采用的加热方式为________。 (5)蒸馏操作时,一段时间后发现未通冷凝水,应采取的正确方法是________________________________________________________ __________________________________________________________。 解析:(1)提纯环己酮时首先应加入NaCl固体,使水溶液的密度增大,使水层与有机层更容易分离开;然后水层用乙醚进行萃取,使水层中少量的有机物进一步被提取,提高环己酮的产量,将萃取液并入有机层;再向有机层中加入无水MgSO4,以除去有机物中少量的水,然后过滤,除去MgSO4固体,最后再进行蒸馏即可得到环己酮。 (2)b中水层用乙醚萃取的目的是使水层中少量的有机物进一步被提取,提高环己酮的产量。 (3)应将分液漏斗倒转过来用力振荡,A项错误;振荡时,分液漏斗中某些物质挥发变成气体,会使分液漏斗中压强增大,所以要将漏斗倒置,旋开旋塞放气,B项错误;经振荡放气后,应将分液漏斗固定在铁架台上静置待液体分层,C项错误。 (4)提纯环己酮时加入NaCl固体,可降低环己酮的溶解度,使水溶液的密度增大,水层与有机层更容易分离开。由于乙醚的沸点为34.6 ℃,采用水浴加热的方式能更好地控制加热温度。 (5)蒸馏操作时未通冷凝水,要停止加热,待冷却后再通冷凝水,以防冷凝管炸裂。 答案:(1)dbeca (2)使水层中少量的有机物进一步被提取,提高产品的产量 (3)ABC (4)降低环己酮的溶解度;增大水层的密度,有利于液体分层 水浴加热 (5)停止加热,冷却后通冷凝水 二、物质分离提纯方法的选择 4.在中学化学实验中可用来分离或提纯物质的方法很多,如蒸馏、过滤、结晶、渗析、盐析等,分离或提纯下列各组混合物所选用方法最合适的是( ) A.FeCl3溶液得到FeCl3固体——加热蒸干 B.除去Cu粉中混有的CuO——加入稀硝酸溶解、过滤、洗涤、干燥 C.分离NaNO3和BaSO4的混合物——溶解、过滤 D.除去NaOH溶液中混有的少量Na2SO4——加入BaCl2溶液、过滤 解析:FeCl3溶液会发生水解,加热蒸干最后得不到FeCl3,A项错误;稀硝酸与Cu反应,B项错误;NaNO3溶于水,BaSO4不溶于水,C项正确;引入了新的杂质Cl-,D项错误。 答案:C 5.下列混合物的分离方法正确的是( ) A.粗盐可采用除杂和重结晶等过程提纯 B.提纯混有少量硝酸钾的氯化钠,应采用在较高温度下制得浓溶液再冷却结晶、过滤、干燥的方法 C.用分液漏斗分液时,先放出下层液体后,再从分液漏斗下口放出上层液体 D.1己醇的沸点比己烷的沸点高,1己醇和己烷不能通过蒸馏初步分离 解析:粗盐中的钙离子、镁离子等可采用沉淀法除去,所得氯化钠溶液可采用重结晶等过程提纯,A项正确;提纯混有少量硝酸钾的氯化钠的正确操作是:蒸发结晶、趁热过滤、洗涤、干燥,B项错误;分液时,将下层液体从下口放出后,再将上层液体从上口倒出,C项错误;互溶的液体物质沸点相差较大的,可以用蒸馏的方法分离,D项错误。 答案:A 6.下列实验中,所采取的分离方法与对应原理都正确的是( ) 选项 目的 分离方法 原理 A 分离溶于水中的碘 乙醇萃取 碘在乙醇中的溶解度较大 B 分离乙酸乙酯和乙醇 分液 乙酸乙酯和乙醇的密度不同 C 除去KNO3固体中混杂的NaCl 重结晶 NaCl在水中的溶解度很大 D 除去丁醇中的乙醚 蒸馏 丁醇与乙醚的沸点相差较大 解析:乙醇与水互溶,不能用作碘水的萃取剂,A项错误;乙酸乙酯和乙醇互溶,不能用分液法分离,应该用蒸馏法分离,B项错误;NaCl的溶解度随温度的降低变化不大,而KNO3的溶解度随温度降低而减小很大,故应采用降温结晶的方法提纯KNO3,C项错误;丁醇和乙醚互溶,但二者沸点相差较大,故可采用蒸馏法分离,D项正确。 答案:D 7.除去下列物质中含有的杂质(括号内为杂质),选用试剂正确的是( ) A.FeCl2溶液(FeCl3):Fe粉 B.CO2(SO2):饱和的Na2CO3溶液 C.Al2O3(SiO2):NaOH溶液 D.NaHCO3溶液(Na2CO3):Ca(OH)2溶液 解析:铁和氯化铁反应生成氯化亚铁,A正确;二氧化碳也能和碳酸钠反应生成碳酸氢钠,B错误;氧化铝和二氧化硅都能和氢氧化钠反应,C错误;氢氧化钙也能和碳酸氢钠反应生成碳酸钙沉淀,应该向溶液中通入过量二氧化碳,D错误。 答案:A 8.为提纯下列物质(括号内为杂质)选用的试剂和分离方法都正确的是( ) 序号 物质 试剂 分离方法 ① 硝酸钾(氯化钠) 蒸馏水 冷却结晶 ② 二氧化碳(氯化氢) 饱和碳酸钠溶液 洗气 ③ 乙醇(水) 金属钠 蒸馏 ④ NaCl溶液(Na2S) AgCl 过滤 A.①③ B.①④ C.只有② D.③④ 解析:硝酸钾的溶解度受温度的影响较大,而氯化钠的溶解度受温度的影响较小,故可以通过把混合物溶于蒸馏水后降温结晶的办法除去氯化钠,①正确;二氧化碳中混有的氯化氢应通过饱和碳酸氢钠溶液除去,②错误;金属钠与乙醇和水都能发生反应,③错误;Na2S溶液和AgCl反应,生成Ag2S和NaCl,过滤除去Ag2S,④正确。 答案:B 9.下图表示从固体混合物中分离X的两种方案,请根据方案1和方案2指出下列说法合理的是( ) A.可以选用方案1分离碳酸氢钠中含有的氯化铵 B.方案1中残留物应该具有的性质是受热易挥发 C.方案2中加入的试剂一定能够与除X外的物质发生化学反应 D.方案2中加入NaOH溶液可以分离出SiO2和Fe2O3混合物中的Fe2O3 解析:NaHCO3受热分解,A项错误;由易升华的I2可知B项错误;由从CaCO3中分离出NaCl可知C项错误。 答案:D 10.除去下列常见物质中的杂质,填写表格中的空白: 答案:加热 CO2与H2O 加热 过量铁粉 过滤 通氯气 加热 升华 过量NaOH溶液 过滤 适量氨水 过滤结晶 水 结晶、重结晶 稀盐酸 过滤 过量NaOH溶液 过滤查看更多