- 2021-04-28 发布 |
- 37.5 KB |
- 2页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
铁、铜及其化合物的应用知识点总结
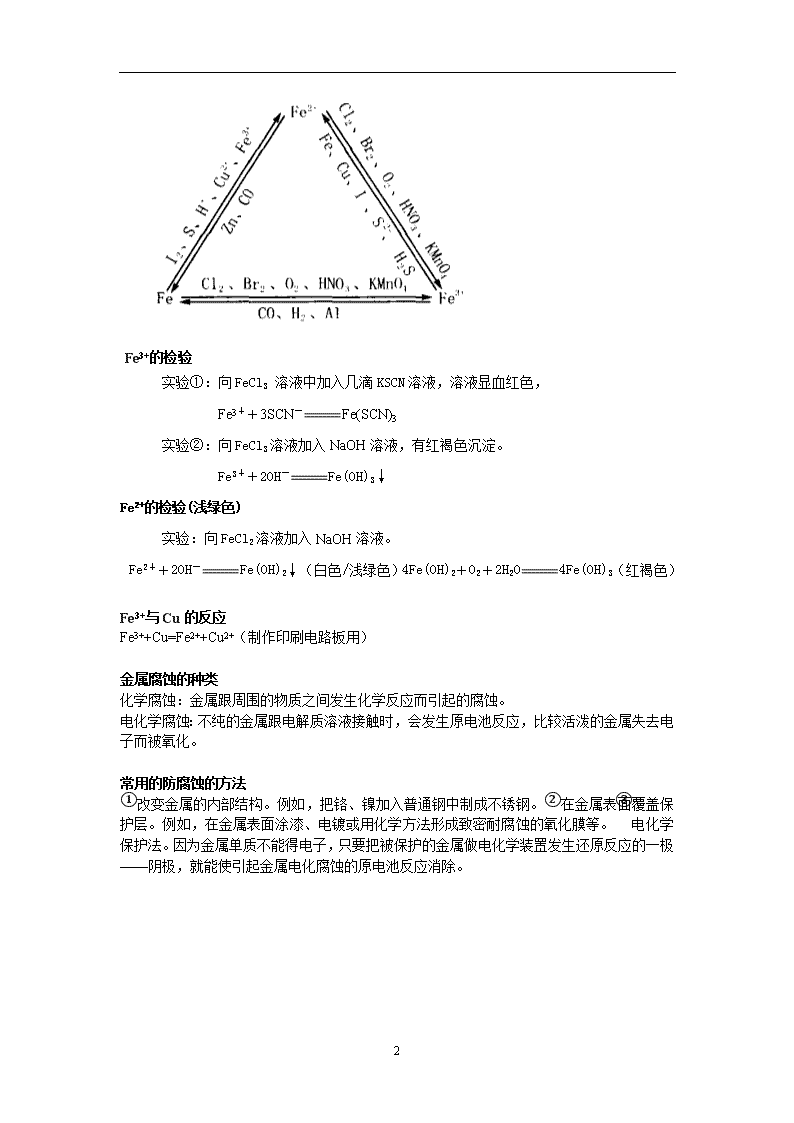
专题3 从矿物到基础材料 第二单元 铁、铜及其化合物的应用 常见的铁矿石和铜矿石 铁的冶炼方法 (1)制取CO:C+O2 === CO2,CO2+C ===CO 高温 高温 (2)还原(炼铁原理):Fe2O3 + 3CO === 2Fe + 3CO2 (1) 除SiO2:CaCO3===CaO+CO2↑,CaO+SiO2===CaSiO3 铜的冶炼方法 1.高温冶炼黄铜矿→电解精制;2.湿法炼铜:Fe + CuSO4 = FeSO4 + Cu;3.生物炼铜 铁、铜的化学性质 铁的化学性质:铁是较活泼的金属(或中等活泼金属)表现为还原性。 铁 △ 铜 (1)与非金属反应 ①铁生锈(铁在潮湿空气中被腐蚀生成Fe2O3) 点燃 ②2Fe+3Cl2 === 2FeCl3 点燃 点燃 ③2Fe+3Br2 === 2FeBr3 还原性:Fe2+>Br ④3Fe+2O2 === Fe3O4(2价Fe占 ,2价Fe占2/3) Cu +O2 === 2CuO 点燃 Cu + Cl2=== CuCl2 △ 2Cu + S === Cu2S (2)与酸反应 ①非强氧性的酸:Fe + 2H+ == Fe2+ + H2↑ ②强氧性的酸(浓H2SO4、HNO3): a.常温下钝化(浓H2SO4、浓HNO3用铁制容器盛装) b.一定条件下反应生成Fe(Ⅲ) ①非强氧性的酸: 不反应 ②强氧性的酸(浓H2SO4、HNO3):在一定条件下生成Cu(Ⅱ) (3)与盐溶液反应 (1) Fe + Cu2+ == Fe2+ + Cu (2) Fe + 2Fe3+ == 3Fe2+ Cu + 2Ag+=2Ag + Cu2+ Cu + 2Fe3+=2Fe2+ + Cu2+(实验现象:铜粉溶解,溶液颜色发生变化。) Fe2+与Fe3+的相互转化: 2 Fe3+的检验 实验①:向FeCl3 溶液中加入几滴KSCN溶液,溶液显血红色, Fe3++3SCN-Fe(SCN)3 实验②:向FeCl3溶液加入NaOH溶液,有红褐色沉淀。 Fe3++2OH-Fe(OH)3↓ Fe2+的检验(浅绿色) 实验:向FeCl2溶液加入NaOH溶液。 Fe2++2OH-Fe(OH)2↓(白色/浅绿色)4Fe(OH)2+O2+2H2O4Fe(OH)3(红褐色) Fe3+与Cu的反应 Fe3++Cu=Fe2++Cu2+(制作印刷电路板用) 金属腐蚀的种类 化学腐蚀:金属跟周围的物质之间发生化学反应而引起的腐蚀。 电化学腐蚀:不纯的金属跟电解质溶液接触时,会发生原电池反应,比较活泼的金属失去电子而被氧化。 常用的防腐蚀的方法 ①改变金属的内部结构。例如,把铬、镍加入普通钢中制成不锈钢。②在金属表面覆盖保护层。例如,在金属表面涂漆、电镀或用化学方法形成致密耐腐蚀的氧化膜等。③电化学保护法。因为金属单质不能得电子,只要把被保护的金属做电化学装置发生还原反应的一极——阴极,就能使引起金属电化腐蚀的原电池反应消除。 2查看更多