- 2021-04-28 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
备战2021 高考化学 加餐练23 化学平衡常数
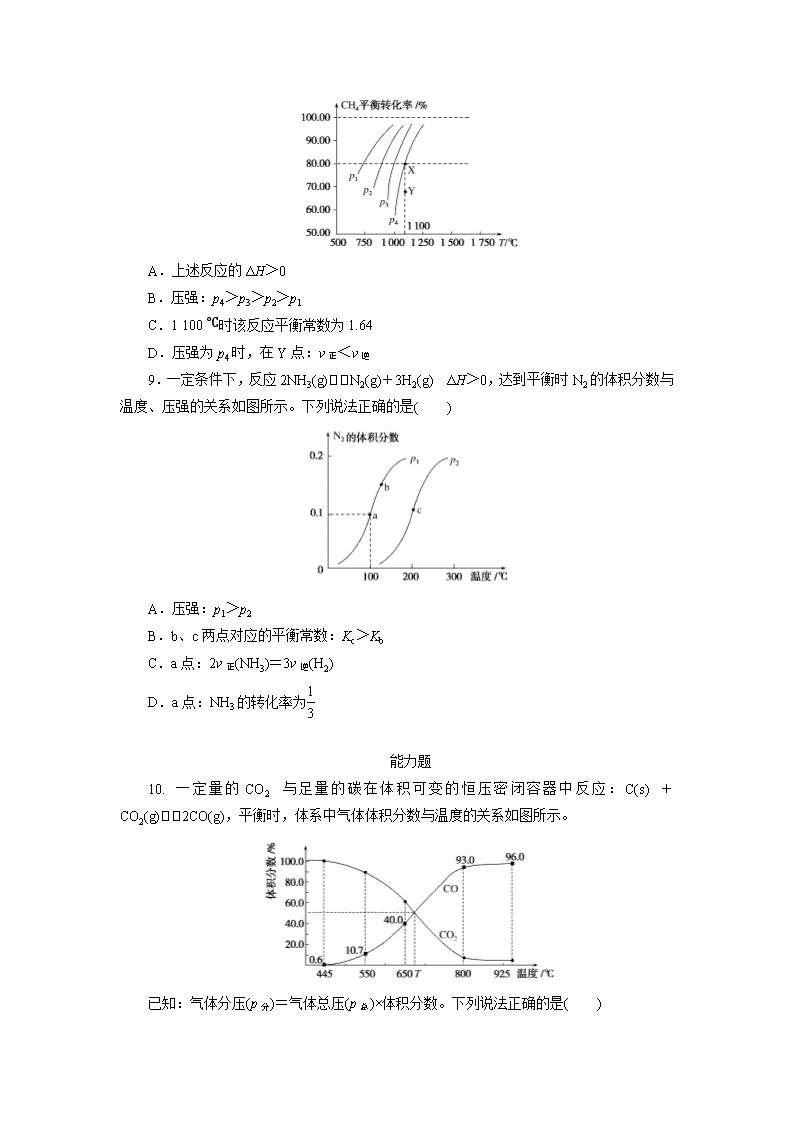
加餐练 23 化学平衡常数 基础题 1.下列说法正确的是( ) A.放热反应均是自发反应 B.ΔS 为正值的反应均是自发反应 C.物质的量增加的反应,ΔS 为正值 D.如果ΔH 和ΔS 均为正值,当温度升高时,反应可能自发进行 2.在一定条件下,已达平衡的可逆反应:2A(g)+B(g) 2C(g),下列说法中正确的是 ( ) A.平衡时,此反应的平衡常数 K 与各物质的浓度有如下关系:K= c2 C c2 A ·c B B.改变条件后,该反应的平衡常数 K 一定不变 C.如果改变压强并加入催化剂,平衡常数会随之变化 D.若平衡时增加 A 和 B 的浓度,则平衡常数会减小 3.某恒定容器内发生的可逆反应的化学平衡常数表达式为 K=c CO ·c H2 c H2O 。能 判断该反应一定达到化学平衡状态的依据是( ) ①容器中气态物质的平均相对分子质量不随时间而变化;②v 正(H2O)=v 逆(H2);③容器 中气态物质的密度不随时间而变化;④气态物质的总压强不随时间而变化;⑤消耗 n mol H2 的同时消耗 n mol CO。 A.①②③ B.①②③④ C.② D.①④⑤ 4.反应 Fe(s)+CO2(g) FeO(s)+CO(g),700 ℃时平衡常数为 1.47,900 ℃时平衡常数 为 2.15。下列说法正确的是( ) A.升高温度该反应的正反应速率增大,逆反应速率减小 B.该反应的化学平衡常数表达式为 K=c FeO ·c CO c Fe ·c CO2 C.该反应的正反应是吸热反应 D.增大 CO2 浓度,平衡常数增大 5.已知①碳酸钙的分解 CaCO3(s)===CaO(s)+CO2(g) ΔH1 仅在高温下自发进行;②氯 酸钾的分解 2KClO3(s)===2KCl(s)+3O2(g) ΔH2 在任何温度下都自发进行,下面有几组焓变 数据,其中可能正确的是( ) A.ΔH1=-178.32 kJ·mol-1ΔH2=-78.3 kJ·mol-1 B.ΔH1=178.32 kJ·mol-1ΔH2=-78.3 kJ·mol-1 C.ΔH1=-178.32 kJ·mol-1ΔH2=78.3 kJ·mol-1 D.ΔH1=178.32 kJ·mol-1ΔH2=78.3 kJ·mol-1 6.将 E 和 F 加入密闭容器中,在一定条件下发生反应:E(g)+F(s) 2G(g),忽略固 体体积,平衡时 G 的体积分数(%)随温度和压强的变化如下表所示: 压强/Mpa 体积分数/% 温度/℃ 1.0 2.0 3.0 810 54.0 a b 915 c 75.0 d 1 000 e f 83.0 ①b<f ②915 ℃、2.0MPa 时 E 的转化率为 60% ③该反应的ΔS>0 ④K(1 000 ℃)>K(810 ℃) 上述①~④中正确的有( ) A.4 个 B.3 个 C.2 个 D.1 个 7.碘单质难溶于水却易溶于 KI 溶液。碘水中加入 KI 溶液发生反应:I2(aq)+I - (aq) I- 3 (aq),该反应的平衡常数与温度的关系如图,下列说法不正确的是( ) A.上述正反应为放热反应 B.上述体系中加入苯,平衡不移动 C.可运用该反应原理除去硫粉中少量的碘单质 D.实验室配制碘水时,为增大碘单质的溶解度可加入适量 KI 溶液 8.在一恒容的密闭容器中充入 0.1 mol·L-1 CO2、0.1 mol·L-1 CH4,在一定条件下发生 反应:CH4(g)+CO2(g) 2CO(g)+2H2(g),测得 CH4 平衡时转化率与温度、压强关系如图。 下列有关说法不正确的是( ) A.上述反应的ΔH>0 B.压强:p4>p3>p2>p1 C.1 100 ℃时该反应平衡常数为 1.64 D.压强为 p4 时,在 Y 点:v 正<v 逆 9.一定条件下,反应 2NH3(g) N2(g)+3H2(g) ΔH>0,达到平衡时 N2 的体积分数 与温度、压强的关系如图所示。下列说法正确的是( ) A.压强:p1>p2 B.b、c 两点对应的平衡常数:Kc>Kb C.a 点:2v 正(NH3)=3v 逆(H2) D.a 点:NH3 的转化率为1 3 能力题 10. 一 定 量 的 CO2 与 足 量 的 碳 在 体 积 可 变 的 恒 压 密 闭 容 器 中 反 应 : C(s) + CO2(g) 2CO(g),平衡时,体系中气体体积分数与温度的关系如图所示。 已知:气体分压(p 分)=气体总压(p 总)×体积分数。下列说法正确的是( ) A.550 ℃时,若充入惰性气体,v 正、v 逆均减小,平衡不移动 B.650 ℃时,反应达平衡后 CO2 的转化率为 25.0% C.T ℃时,若充入等体积的 CO2 和 CO,平衡向逆反应方向移动 D.925 ℃时,用平衡分压代替平衡浓度表示的化学平衡常数 Kp=24.0p 总 11.在工业上常用 CO 与 H2 合成甲醇,热化学方程式为 CO(g)+2H2(g) CH3OH(g) ΔH=-574.4 kJ·mol-1。 (1)在 T1 时,向体积为 2 L 的恒容容器中充入物质的量之和为 3 mol 的 CO 和 H2,发生 反应 CO(g)+2H2(g) CH3OH(g),反应达到平衡时 CH3OH(g)的体积分数[φ(CH3OH)]与 n H2 n CO 的关系如图 1 所示。 ①当起始 n H2 n CO =2 时,经过 5 min 反应达到平衡,CO 的转化率为 0.6,则 0~5 min 内平均反应速率 v(H2)=____________________。若此刻再向容器中加入 CO(g)和 CH3OH(g) 各 0.4 mol,达到新平衡时 H2 的转化率将________(填“增大”“减小”或“不变”)。 ②当 n H2 n CO =3.5 时,反应达到平衡后,CH3OH 的体积分数可能是图 1 中的 ________(填“D”“E”或“F”)点。 (2)在一容积可变的密闭容器中充有 10 mol CO 和 20 mol H2。CO 的平衡转化率[α(CO)] 与温度(T)、压强(p)的关系如图 2 所示。 ①A、B、C 三点对应的平衡常数 KA、KB、KC 的大小关系为________。 ②若达到平衡状态 A 时,容器的体积为 10 L,则在平衡状态 B 时容器的体积为 ________L。 12.近期发现,H2S 是继 NO、CO 之后的第三个生命体系气体信号分子,它具有参与 调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题: (1)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。 通 过 计 算 , 可 知 系 统 (Ⅰ) 和 系 统 (Ⅱ) 制 氢 的 热 化 学 方 程 式 分 别 为__________ 、 __________,制得等量 H2 所需能量较少的是________。 (2)H2S 与 CO2 在高温下发生反应:H2S(g)+CO2(g) COS(g)+H2O(g)。在 610 K 时, 将 0.10 mol CO2 与 0.40 mol H2S 充入 2.5 L 的空钢瓶中,反应平衡后水的物质的量分数为 0.02。 ①H2S 的平衡转化率α1=________%,反应平衡常数 K=________。 ②在 620 K 重复试验,平衡后水的物质的量分数为 0.03,H2S 的转化率α2______α1,该 反应的ΔH______0。(填“>”“<”或“=”) ③向反应器中再分别充入下列气体,能使 H2S 转化率增大的是________(填标号)。 A.H2S B.CO2 C.COS D.N2 加餐练 23 化学平衡常数 1.解析:放热反应不一定能自发进行,如铝热反应为放热反应,在常温下不能自发进 行,A 错误;ΔS 为正值的反应不一定是自发反应,如水的分解,B 错误;只有气体的物质 的量增加的反应,ΔS 为正值,C 错误;如果ΔH 和ΔS 均为正值,当温度升高时,可满足ΔH -T·ΔS<0 时,反应可自发进行,D 正确。 答案:D 2.解析:K 只随温度的改变而改变,除改变温度外,改变其他条件都不会引起平衡常 数的改变。 答案:A 3.解析:根据题给化学平衡常数表达式可知,该可逆反应为 C(s)+H2O(g) CO(g) +H2(g),因为该反应前后气态物质的体积不相等,所以平均相对分子质量不变可说明反应 已经达到平衡状态,①正确;v 正(H2O)=v 逆(H2),说明反应达到平衡,②正确;虽然容器的 体积不变,但是气态物质的质量可变,当气态物质的密度和总压强不变时,说明反应达到了 平衡状态,③、④正确;消耗 H2 和 CO 的反应均为逆反应,不能说明反应达到了平衡状态, ⑤错误。 答案:B 4.解析:A 项,升温,正、逆反应速率均增大,不正确;B 项,该化学平衡常数表达 式为 c CO c CO2 ,故不正确;C 项,升温,平衡常数增大,表明平衡向正反应方向移动,即 正反应为吸热反应, 故正确;D 项,增大反应物浓度,平衡常数不变,故不正确。 答案:C 5.答案:B 6.解析:同温下,增大压强,平衡逆向移动,平衡时 G 的体积分数变小,故可知 54.0>a>b, 因 75.0>a,故升温平衡正向移动,从而可知 f>75.0,所以①正确;在 915 ℃、2.0 MPa 下, 设 E 的起始物质的量为 a mol,转化率为 x,则平衡时 G 的物质的量为 2ax mol,由题意得 [2ax/(a-ax+2ax)]×100%=75.0%,解得 x=0.6,②正确;该反应是气体体积增大的反应, 因此为熵增反应,③正确;结合前面分析知升温平衡正向移动,则平衡常数增大,④正确。 答案:A 7.解析:由图中可看出,随着温度的升高,平衡常数减小,故升高温度平衡逆向移动, 正反应为放热反应,A 项正确;加入苯后能将溶液的碘单质萃取,降低了溶液中 c(I2),平衡 逆向移动,B 项错误;硫粉中的碘单质在加入 KI 后,碘单质生成 KI3 而除去,C 项正确; 配制碘水时,加入 KI 溶液,使得平衡正向移动,增大碘单质的溶解度,D 项正确。 答案:B 8.解析:由图像知,压强一定时,温度越高,甲烷的平衡转化率越高,故正反应为吸 热反应,ΔH>0,A 项正确;该反应为气体分子数增加的反应,压强越大,甲烷的平衡转化 率越小,故 p4>p3>p2>p1,B 项正确;1 100 ℃时,甲烷的平衡转化率为 80.00%,故平衡 时各物质的浓度分别为 c(CH4)=0.02 mol·L-1,c(CO2)=0.02 mol·L-1,c(CO)=0.16 mol·L-1, c(H2)=0.16 mol·L-1,即平衡常数 K=0.162×0.162 0.02×0.02 ≈1.64,C 项正确;压强为 p4 时,Y 点未达 到平衡,需增大 CH4 转化率达到平衡,此时 v 正>v 逆,D 项错误。 答案:D 9.解析:该反应为气体分子数增大的反应,恒温时,压强越大,N2 的体积分数越小, 则 p1<p2,故 A 错误;b、c 两点对应温度 b<c,该反应为吸热反应,温度越高,平衡常数 越大,则 Kc>Kb,故 B 正确;反应速率之比等于化学计量数之比,3v 正(NH3)=2v 逆(H2),故 C 错误;对于反应 2NH3(g) N2(g)+3H2(g),假设反应前氨气的物质的量为 1 mol,反应 的氨气的物质的量为 x mol,则 x 2 1+x =0.1,解得 x=1 4 ,因此氨气的转化率为1 4 ,故 D 错误。 答案:B 10.解析:A 项,C(s)+CO2(g) 2CO(g)的正反应是气体物质的量增加的反应,由于 反应容器为体积可变的恒压密闭容器,充入惰性气体容器体积扩大,对反应体系相当于减小 压强,故 v 正、v 逆均减小,平衡正向移动,错误;B 项,由图可知,650 ℃时若设起始时 CO2 的体积为 1 L,平衡时 CO2 消耗的体积为 x,则 C(s)+CO2(g) 2CO(g) V 始 1 0 V 变 x 2x V 平 1-x 2x 2x 1-x+2x×100%=40.0%,x=0.25 L,CO2 的转化率为 25%,正确;C 项,由图可知,T ℃ 时平衡体系中 CO 和 CO2 的体积分数均为 50%,故若恒压时充入等体积的 CO2 和 CO 两种 气体,平衡不发生移动,错误;D 项,925 ℃时,CO 的平衡分压 p(CO)=p 总×96.0%,CO2 的 平衡分压 p(CO2)=p 总×4%,根据化学平衡常数的定义可知 Kp= p2 CO p CO2 = p 总×96% 2 p 总×4.0% = 23.04p 总,错误。 答案:B 11.答案: (1)①0.12 mol·L-1·min-1 增大 ②F (2)①KA=KB>KC ②2 12.解析:(1)系统Ⅰ制氢,反应③中有 H2 生成,要消掉 HI,②中有 HI 还有 SO2,要 消掉 SO2,要和①相加,将系统(Ⅰ)中三个反应相加得 H2O(l)===H2(g)+1 2O2(g),计算反应热 ΔH=327+(-151)+110=+286(kJ/mol)。同理将系统(Ⅱ)中三个反应相加得 H2S(g)===H2(g) +S(s) ΔH=+20 kJ/mol,制得等量 H2,系统Ⅱ所需能量较少。 (2)① H2S(g)+CO2(g) COS(g)+H2O(g) n(始)/mol 0.40 0.10 0 0 n(变)/mol x x x x n(平)/mol 0.40-x 0.10-x x x H2O%= x 0.10-x + 0.40-x +x+x =0.02,x=0.01。H2S 的转化率为0.01 0.4 ×100% =2.5%。K= 0.01 2.5 ×0.01 2.5 0.39 2.5 ×0.09 2.5 =2.8×10-3。②水的物质的量分数增大,说明平衡正向移动,H2S 的 转化率增大;温度升高,平衡正向移动,说明正反应是吸热反应。③增大 H2S 浓度,平衡 正向移动,CO2 转化率增大,H2S 转化率降低,A 错误;同理,增大 CO2 浓度,H2S 转化率 增大,CO2 转化率降低,B 正确,增大 COS 浓度,平衡向逆反应方向移动,H2S 转化率降 低,C 错误;加入不反应的 N2,反应物、生成物浓度均不变,平衡不移动,H2S 转化率不 变,D 错误。 答案:(1)H2O(l)===H2(g)+1 2O2(g) ΔH=+286 kJ/mol H2S(g)===H2(g)+S(s) ΔH=+20 kJ/mol 系统(Ⅱ) (2)①2.5 2.8×10-3 ②> > ③B查看更多