- 2021-04-28 发布 |
- 37.5 KB |
- 14页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
【化学】湖北省名师联盟2020届高三下学期4月月考仿真卷(解析版)
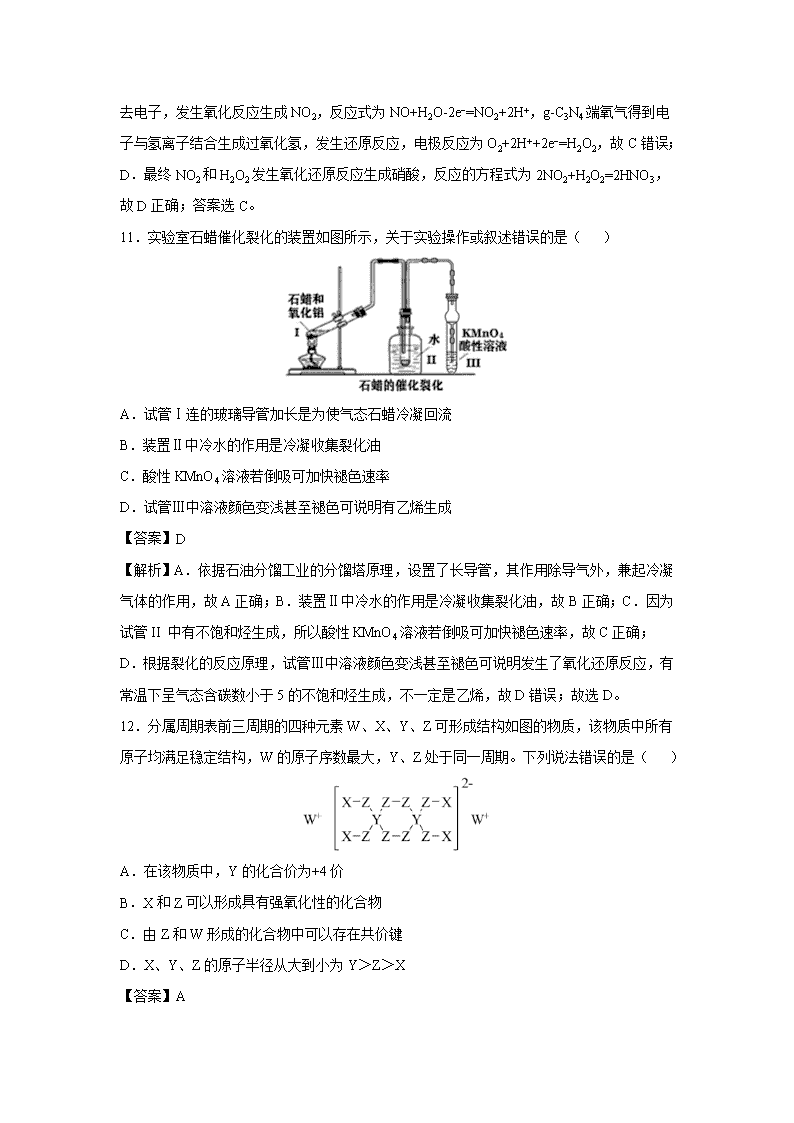
湖北省名师联盟2020届高三下学期4月月考仿真卷 相对原子质量:H 1 C 12 N 14 O 16 Cl 35.5 Fe 56 Mn 55 Ba 137 一、单选题(每小题6分,共42分。每小题只有一个选项符合题目要求。) 7.不断进步的材料逐渐构筑了我们现代社会的文明。下列说法错误的是( ) A.“唐三彩”和景德镇瓷器的主要化学成分都是硅酸盐 B.玻璃是一种常见的无机非金属材料,在一定温度下软化可制得玻璃仪器 C.高铁和城铁所用镁合金具有密度小、强度高、耐腐蚀等特点 D.以高纯硅制成的光导纤维内窥镜可直接窥视有关器官部位的变化 【答案】D 【解析】A.“唐三彩”和景德镇瓷器都是陶瓷,陶瓷的主要化学成分都是硅酸盐,故A正确;B.玻璃是一种常见的无机非金属材料,玻璃属于混合物,没有固定的熔点,在一定温度下软化可制得玻璃仪器,故B正确;C.镁合金具有密度小、强度高、耐腐蚀等特点,常用于高铁和城铁的设备制造,故C正确;D.光导纤维的主要成份是二氧化硅,不是硅,故D错误;故选D。 8.关于有机物的说法正确的是( ) A.a、b互为同系物 B.c中所有碳原子可能处于同一平面 C.b的同分异构体中含有羧基的结构还有7种(不含立体异构) D.a、b、c均能使酸性高锰酸钾溶液褪色 【答案】C 【解析】A.a是酯类,b是羧酸类,结构不相似,不互为同系物,故A错误;B.c是在环己烷上连了两个羟基,环己烷的碳原子不都在同一平面上,故B错误;C.b是1-戊酸,含有羧基的结构的同分异构体,在正戊烷的碳链上还有两种,在异戊烷的碳链上还有4种,新戊烷的碳链上有1种,共7种,故C正确;D.只有c能使酸性高锰酸钾溶液褪色,故D错误;故选C。 9.常温下,将0.20mol/L KMnO4酸性溶液0.l0L与一定量pH=3.0的草酸(HOOC-COOH)溶液混合,放出VL气体。NA表示阿伏加德罗常数的值,下列说法正确的是( ) A.9g HOOC-COOH含共用电子对数目为0.9NA B.当0.01mol KMnO4被还原时,强酸提供的H+数目为0.01NA C.pH=3.0的草酸溶液含有H+数目为0.001NA D.该反应释放CO2分子数目为V NA/22.4 【答案】A 【解析】A.1个HOOC−COOH分子中含有9对共用电子对,则9g HOOC-COOH物质的量为=0.1mol,含共用电子对数目为0.9NA,故A正确;B.KMnO4与草酸反应的方程式为2KMnO4+5H2C2O4+3H2SO4=10CO2↑+2MnSO4+K2SO4+8H2O,根据方程式可知当1mol KMnO4被还原时,强酸提供的H+的物质的量为3mol,因此反应消耗的H+数目为3NA,故B错误;C.缺少溶液的体积,不能计算H+的数目,故C错误;D.不确定CO2气体所处的温度压强条件,因此不能计算其物质的量,也就不能确定其分子数,故D错误;故答案选A。 10.用Pt-g-C3N4光催化氧化法脱除NO的过程如图所示。该脱除过程中,下列说法不正确的是( ) A.该脱除过程中太阳能转化为化学能 B.在Pt端发生的是氧化反应 C.过程①发生的反应为H2O2-2e−=O2↑+2H+ D.过程③的化学方程式2NO2+H2O2=2HNO3 【答案】C 【解析】A.根据图示,脱除过程中,太阳能转化为化学能,故A正确;B.根据图示,Pt端NO失去电子,发生氧化反应生成NO2,反应式为NO+H2O-2e−=NO2+2H+,最终NO2和H2O2 发生氧化还原反应生成硝酸,故B正确;C.由脱除NO的过程图可知,Pt端NO失去电子,发生氧化反应生成NO2,反应式为NO+H2O-2e−=NO2+2H+,g-C3N4端氧气得到电子与氢离子结合生成过氧化氢,发生还原反应,电极反应为O2+2H++2e−=H2O2,故C错误;D.最终NO2和H2O2发生氧化还原反应生成硝酸,反应的方程式为2NO2+H2O2=2HNO3,故D正确;答案选C。 11.实验室石蜡催化裂化的装置如图所示,关于实验操作或叙述错误的是( ) A.试管Ⅰ连的玻璃导管加长是为使气态石蜡冷凝回流 B.装置Ⅱ中冷水的作用是冷凝收集裂化油 C.酸性KMnO4溶液若倒吸可加快褪色速率 D.试管Ⅲ中溶液颜色变浅甚至褪色可说明有乙烯生成 【答案】D 【解析】A.依据石油分馏工业的分馏塔原理,设置了长导管,其作用除导气外,兼起冷凝气体的作用,故A正确;B.装置Ⅱ中冷水的作用是冷凝收集裂化油,故B正确;C.因为试管II 中有不饱和烃生成,所以酸性KMnO4溶液若倒吸可加快褪色速率,故C正确;D.根据裂化的反应原理,试管Ⅲ中溶液颜色变浅甚至褪色可说明发生了氧化还原反应,有常温下呈气态含碳数小于5的不饱和烃生成,不一定是乙烯,故D错误;故选D。 12.分属周期表前三周期的四种元素W、X、Y、Z可形成结构如图的物质,该物质中所有原子均满足稳定结构,W的原子序数最大,Y、Z处于同一周期。下列说法错误的是( ) A.在该物质中,Y的化合价为+4价 B.X和Z可以形成具有强氧化性的化合物 C.由Z和W形成的化合物中可以存在共价键 D.X、Y、Z的原子半径从大到小为Y>Z>X 【答案】A 【解析】根据W、X、Y、Z分属周期表前三周期的四种元素,可形成结构如图的物质,该物质中所有原子均满足稳定结构,W的原子序数最大,则W为钠,Y、Z处于同一周期,根据价键理论:Y为硼,Z为氧,X为氢,由此分析解答。A.根据上述分析,Y为硼,根据价键理论在该物质中,Y的化合价为+5价,故A错误;B.根据上述分析,Z为氧,X为氢,X和Z可以形成具有强氧化性的化合物H2O2,故B正确;C.根据上述分析,Z为氧,W为钠,由Z和W形成的化合物Na2O2中既有离子键又有共价键,故C正确;D.根据上述分析,Y为硼,Z为氧,X为氢,X、Y、Z的原子半径从大到小为Y>Z>X,故D正确;选A。 13.“太阳水”电池装置如图所示,该电池由三个电极组成,其中a为TiO2电极,b为Pt电极,c为WO3电极,电解质溶液为pH=3的Li2SO4-H2SO4溶液。锂离子交换膜将电池分为A、B两个区,A区与大气相通,B区为封闭体系并有N2保护。下列关于该电池的说法错误的是( ) A.若用导线连接a、c,则a为负极,该电极附近pH减小 B.若用导线连接a、c,则c电极的电极反应式为HxWO3-xe−=WO3+xH+ C.若用导线先连接a、c,再连接b、c,可实现太阳能向电能转化 D.若用导线连接b、c,b电极的电极反应式为O2+4H++4e−=2H2O 【答案】B 【解析】A.用导线连接a、c,a极发生氧化,为负极,发生的电极反应为2H2O-4e−=4H++O2↑,a电极周围H+浓度增大,溶液pH减小,故A正确;B.用导线连接a、c,c极为正极,发生还原反应,电极反应为WO3+xH++xe−=HxWO3,故B错误;C.用导线先连接a、c,再连接b、c,由光电池转化为原电池,实现太阳能向电能转化,故C正确;D.用导线连接b、c,b电极为正极,电极表面是空气中的氧气得电子,发生还原反应,电极反应式为O2+4H++4e−=2H2O,故D正确;故答案为B。 二、非选择题(共43分) 26.(14分)常温下,三硫代碳酸钠(Na2CS3)是玫瑰红色针状固体,与碳酸钠性质相近。在工农业生产中有广泛的用途。某小组设计实验探究三硫代碳酸钠的性质并测定其溶液的浓度。 实验一:探究Na2CS3的性质 (1)向Na2CS3溶液中滴入酚酞试液,溶液变红色。用离子方程式说明溶液呈碱性的原因________________________________________________________。 (2)向Na2CS3溶液中滴加酸性KMnO4溶液,紫色褪去。该反应中被氧化的元素是______。 实验二:测定Na2CS3溶液的浓度 按如图所示连接好装置,取50.0mL Na2CS3溶液置于三颈瓶中,打开分液漏斗的活塞,滴入足量2.0mol·L−1稀H2SO4,关闭活塞。 已知:Na2CS3+H2SO4=Na2SO4+CS2+H2S↑。CS2和H2S均有毒。CS2不溶于水,沸点46℃,密度1.26g·mL−1,与CO2某些性质相似,与NaOH作用生成Na2COS2和H2O。 (3)盛放碱石灰的仪器的名称是 ,碱石灰的主要成分是 (填化学式)。 (4)反应结束后打开活塞K,再缓慢通入热N2一段时间,其目的是 。 (5)C中发生反应的离子方程式是 。 (6)为了计算Na2CS3溶液的浓度,对充分反应后B中混合物进行过滤、洗涤、干燥、称重,得8.4g固体,则三颈瓶中Na2CS3的物质的量浓度为 。 (7)分析上述实验方案,还可以通过测定C中溶液质量的增加值来计算Na2CS3溶液的浓度,若反应结束后将通热N2改为通热空气,计算值______(填“偏高”、“偏低”或“无影响”)。 【答案】(1)CS+H2OHCS+OH− (2)S (3)球形干燥管 CaO和NaOH (4)将装置中残留的CS2和H2S全部排入后续装置中,使其被完全吸收 (5)CS2+2OH−=COS+H2O (6)1.75mol/L (7)偏高 【解析】(1)碳酸钠溶液因碳酸根离子水解而显碱性,因为三硫代碳酸钠(Na2CS3)与碳酸钠性质相近,所以Na2CS3溶液中CS也会发生水解显碱性,其反应的离子方程式为CS+H2OHCS+OH−,所以滴入酚酞试液后,溶液也会变红色。故答案:CS+H2OHCS+OH−;(2)由Na2CS3化学式可知:S为-2价具有还原性,碳为+4价具有氧化性,Na为+1价,所以向溶液中滴加酸性KMnO4溶液,紫色褪去说明发生了氧化还原反应,该反应中被氧化的元素是硫,故答案:S;(3)由装置图可知,盛放碱石灰的仪器是干燥管,碱石灰的主要成分是氧化钙和氢氧化钠的混合物,故答案:干燥管;CaO和NaOH;(4)因为CS2和H2S均有毒,CS2不溶于水。装置中有CS2和H2S残留,所以反应结束后打开活塞K,再缓慢通入热N2将残留在装置中的CS2和H2S气体全部赶出到下一个装置被全部吸收,故答案:赶出残留在装置中的CS2和H2S气体到下一个装置被全部吸收;(5)CS2不溶于水,和CO2某些性质相似,能与NaOH作用,生成Na2COS2和H2O,所以C中发生反应的离子方程式是CS2+2OH−=COS+H2O,故答案:CS2+2OH−=COS+H2O;(6)由Na2CS3+H2SO4=Na2SO4+CS2+ H2S↑和H2S+Cu2+=2H++CuS↓可知。Na2CS3~CuS,B中的固体8.4g是CuS的质量,所以物质的量为n(Na2CS3)=n(CuS)=,Na2CS3溶液的浓度c==1.75mol/L,故答案:1.75mol/L;(7)因为C中溶液为氢氧化钠溶液,如果反应结束后将通热N2改为通热空气,空气中含有二氧化碳也会和氢氧化钠反应,在成C中的质量偏高,使测量的结果也偏高,故答案:偏高。 27.(14分)目前,处理烟气中SO2常采用两种方法:碱液吸收法和水煤气还原法。 Ⅰ.碱液吸收法 25℃时,Kb(NH3·H2O)=1.8×10−5; H2SO3:Ka1=1.5×10−2,Ka2=1.0×10−7; Ksp(CaSO4)=7.1×10−5。 第1步:用过量的浓氨水吸收SO2,并在空气中氧化; 第2步:加入石灰水,发生反应Ca2++2OH−+2NH+SOCaSO4↓+2NH3·H2O K。 (1)25℃时,0.1mol·L−1 (NH4)2SO3溶液的pH_____(填“>”“<”或“=”)7。 (2)计算第2步中反应的K=_________。 Ⅱ.水煤气还原法 已知:①2CO(g)+SO2(g)=S(l)+2CO2(g) ΔH1=-37.0kJ·mol−1 ②2H2(g)+SO2(g)=S(l)+2H2O(g) ΔH2=+45.4kJ·mol−1 ③CO的燃烧热ΔH3=-283kJ·mol−1 (3)表示液态硫(S)的燃烧热的热化学方程式为____________________________________。 (4)反应②中,正反应活化能E1_____(填“>”“<”或“=”)ΔH2。 (5)在一定压强下,发生反应①。平衡时SO2的转化率α(SO2)与投料比的比值[=y]、温度T的关系如图所示。 比较平衡时CO的转化率α(CO):N_____M。逆反应速率:N_____P(填“>”“<”或“=”)。 (6)某温度下,向10L恒容密闭容器中充入2mol H2、2mol CO和2mol SO2发生反应①、②,第5min时达到平衡,测得混合气体中CO2、H2O(g)的物质的量分别为1.6mol、1.8mol。 ①该温度下,反应②的平衡常数K为_____。 ②其他条件不变,在第7min时缩小容器体积,SO2的平衡浓度_____(填“增大”“减小”或“不变”)。 【答案】(1)> (2)4.3×1013 (3)S(l)+O2(g)=SO2(g) ΔH=-529kJ·mol−1 (4)> (5)> < (6)2700 增大 【解析】(1)由于Kb(NH3·H2O)=1.8×10−5>Ka2(H2SO3)=1.0×10−7,根据盐的水解规律:“谁弱谁水解,谁强显谁性”可知,(NH4)2SO3溶液呈碱性,pH>7;故答案为:>;(2)第2步:加入石灰水,发生反应Ca2++2OH−+2NH+SOCaSO4↓+2NH3·H2O,化学平衡常数K====4.3×1013,故答案为:4.3×1013;(3)①2CO(g)+SO2(g)S(l)+2CO2(g) ΔH1=-37.0kJ/mol,②2H2(g)+SO2(g)=S(l)+2H2O(g) ΔH2=+45.4kJ/mol,CO的燃烧热ΔH3=-283kJ/mol,即③CO(g)+O2(g)=CO2(g) ΔH3=-283kJ/mol,根据盖斯定律③×2-①计算S(l)+O2(g)=SO2(g)的ΔH=(-283kJ/mol)×2- (-37.0kJ/mol)=-529kJ/mol,热化学方程式为S(l)+O2(g)=SO2(g) ΔH=-529kJ/mol,故答案为:S(l)+O2(g)=SO2(g) ΔH=-529kJ/mol;(4)反应②的正反应为吸热反应,焓变ΔH2=E1-E2(逆反应活化能)>0,E1=E2+ΔH2,由于E2>0,所以E1>ΔH2,故答案为:>;(5)反应①的正反应是气体体积减小的放热反应,温度相同、投料比的比值[=y]越大,SO2的转化率α越大、CO的转化率越小,即y1>y2,投料比相同时,温度越高,SO2的转化率α越低,所以N点的投料比小、温度低,则CO的转化率大于M点CO的转化率;N、P投料比相同,但P点温度高,所以P点反应速率大于N点,逆反应速率:N<P,故答案为:>;<; (6)①对于 2CO(g)+SO2(g)S(l)+2CO2(g) 开始(mol/L) 0.2 0.2 0 变化(mol/L) 0.16 0.08 0.16 平衡(mol/L) 0.04 0.12 0.16 对于 2H2(g)+SO2(g)S(l)+2H2O(g) 开始(mol/L) 0.2 0.12 0 变化(mol/L) 0.18 0.09 0.18 平衡(mol/L) 0.02 0.03 0.18 所以反应②的化学平衡常数K===2700,故答案为:2700;②其他条件不变,在第7min时缩小容器体积,即使容器的压强增大,由于两个反应的正反应都是气体体积减小的反应,所以缩小体积,容器的压强增大,化学平衡正向移动,二氧化硫的物质的量减小,但由于容器体积减小,所以二氧化硫的浓度仍然会增大,故答案为:增大。 28.(15分)铬是一种银白色的金属,常用于金属加工、电镀等。工业以铬铁矿[主要成分是Fe(CrO2)2]为原料冶炼铬及获得强氧化剂Na2Cr2O7。其工艺流程如图所示: 已知:高温氧化时发生反应Fe(CrO2)2+Na2CO3+O2→Na2CrO4+Fe2O3+CO2(未配平) 回答下列问题: (1)将铬铁矿的主要成分Fe(CrO2)2写成氧化物的形式: ,高温氧化时可以提高反应速率的方法为 (写出一条即可)。 (2)Na2CrO4加入硫酸酸化的离子方程式为 ;在实验室中,操作a所用到的玻璃仪器有 。 (3)Na2CrO4中铬元素化合价为 ;生成1mol Na2CrO4时共转移电子的物质的量为________mol。 (4)根据有关国家标准,含CrO的废水要经化学处理,使其浓度降至5.0×10−7mol·L−1以下才能排放,可采用加入可溶性钡盐生成BaCrO4沉淀[Ksp(BaCrO4)=1.2×10−10],再加入硫酸处理多余的Ba2+的方法处理废水,加入可溶性钡盐后,废水中Ba2+的浓度应大于 mol·L−1,废水处理后达到国家标准才能排放。 【答案】(1)FeO·Cr2O3 将固体磨碎或不断搅拌 (2)2CrO+2H+=Cr2O+H2O 烧杯、漏斗、玻璃棒 (3)+6 3.5 (4)2.4×10−4 【解析】铬铁矿[主要成分是Fe(CrO2)2]中加入碳酸钠并通入氧气,高温下将Fe(CrO2)2氧化得到Fe2O3、Na2CrO4,同时生成CO2,将得到的固体溶于水得到Na2CrO4溶液。向一份Na2CrO4溶液中加入硫酸酸化,硫酸和Na2CrO4反应生成Na2Cr2O7和硫酸钠,通过蒸发浓缩、冷却结晶,过滤得到固体a和溶液a;另一份Na2CrO4溶液中加入Na2S发生氧化还原反应,铬元素转化为Cr(OH)3沉淀,过滤后灼烧Cr(OH)3得到Cr2O3,可以利用热还原法制备金属铬。(1)Fe(CrO2)2中铁元素化合价是+2价,氧化物为FeO,铬元素化合价+3价,氧化物为Cr2O3,所以Fe(CrO2)2写成氧化物形式为FeO·Cr2O3;增大反应物的接触面积可以加快反应速率,升高温度可以加快反应速率,不断搅拌,使固体混合物充分混合也可以加快反应速率,故答案为:FeO·Cr2O3 ;将固体磨碎或不断搅拌等;(2)Na2CrO4加入硫酸酸化反应生成重铬酸钠,反应的离子方程式为2CrO+2H+=Cr2O+H2O;操作a为过滤,所用到的玻璃仪器有烧杯、漏斗、玻璃棒,故答案为:2CrO+2H+=Cr2O+H2O;烧杯、漏斗、玻璃棒; (3)Na2CrO4中Na元素为+1价,O为-2价,则铬元素化合价为+6价;根据Fe(CrO2)2+Na2CO3+O2→ Na2CrO4+Fe2O3+CO2,反应中铬元素由+3价升高为+6价,铁元素由+2价升高为+3价,1mol Fe(CrO2)2被氧化转移7mol电子,因此生成1mol Na2CrO4时转移3.5mol电子,故答案为:+6;3.5;(4)CrO+Ba2+BaCrO4,根据题意CrO的浓度降至5.0×10−7mol·L−1以下才能排放,则Ksp(BaCrO4)=c(CrO)×c(Ba2+)=5.0×10−7×c(Ba2+)=1.2×10−10,解得:c(Ba2+)=2.4×10−4mol/L,即Ba2+的浓度应大于2.4×10−4mol/L,故答案为:2.4×10−4。 三、选考题(共15分,请考生从以下题中任选一题作答,如果多做,则按所做的第一题计分。) 35.【化学——选修3:物质结构与性质】(15分) 金属钛因为其优越的性能被称为“未来金属”,其工业冶炼涉及到的反应如下:TiO2+2C+2Cl2TiCl4+2CO。回答下列相关问题: (1)基态钛原子的价层电子排布式为____________________,上述反应中非金属元素电负性由大到小是__________________________________。 (2)已知部分物质熔沸点如下: 名称 金红石 金刚石 四氯化钛 四溴化钛 四碘化钛 化学式 TiO2 C TiCl4 TiBr4 TiI4 熔点/℃ 1830 3550 -24.1 38 150 沸点/℃ 2927 4827 136.4 233.1 377.2 自左向右,表中的三种钛的卤化物熔沸点依次升高的原因是___________________________。 (3)配位数为6,组成为TiCl3·6H2O的晶体有两种:化学式为[TiCl(H2O)5]Cl2·H2O的X呈绿色,定量实验表明,X与AgNO3以1∶2物质的量比反应生成沉淀。Y呈紫色,且Y与AgNO3以1∶3物质的量之比反应生成沉淀,则Y的化学式为______。 (4)钙钛矿是重要的含钛矿物之一。其主要成分Z的晶胞如图所示。推测Z的化学式为__________,Ca填充在O围成的_________空隙中。 (5)若晶胞参数a=384.1pm,Z晶体的密度为_________(列出计算表达式并计算出两位有效数字结果,3.8413≈56.67,阿伏加德罗常数用6.0×1023 mol−1) 【答案】(1)3d24s2 O>Cl>C (2)三种物质都是分子晶体,组成和结构相似时,相对分子质量越大,分子间作用力越大,熔沸点越高 (3)[Ti(H2O)6]Cl3 (4)CaTiO3 (正)八面体 (5)4.0g/cm3 【解析】(1)Ti位于周期表中第4周期第ⅣB族,所以钛的价层电子排布式为3d24s2;元素的非金属性越强其电负性越强,故上述反应中非金属元素电负性由大到小是O>Cl>C;(2)三种钛的卤化物均为分子晶体,结构相似,相对分子质量越大,分子间作用力越强,熔沸点越高;(3)配合物外界能够完全电离,Y与AgNO3以1∶3物质的量比反应生成沉淀,所以Y的外界能够解离出3份Cl−,则Y的化学式为[Ti(H2O)6]Cl3;(4)根据晶胞结构,顶点粒子占,面心粒子占,内部粒子为整个晶胞所有,所以一个晶胞中有Ti为8×=1个,有Ca为1个,有O为6×=3个,所以Z的化学式为CaTiO3,根据晶胞结构示意图可知Ca填充在O围成的正八面体空隙中;(5)不妨设有1mol这样的晶胞,即有NA个这样的晶胞,1个晶胞的体积为V=a3pm3=a3×10−30cm3,1mol晶胞的质量为m=1mol×136g/mol=136g,所以晶体密度为ρ==g/cm3=g/cm3=4.0g/cm3。 36.【化学——选修5:有机化学基础】(15分) 苯酚是一种重要的化工原料。以苯酚为主要起始原料,经下列反应可制得香料M和高分子化合物N。(部分产物及反应条件已略去) (1)B的官能团的名称是_______________。 (2)已知C的分子式为C5H12O,C能与金属Na反应,C的核磁共振氢谱有3组峰,则C的结构简式______________________。 (3)由D生成N的反应类型是_________,B与C反应生成M的反应类型是_________。 (4)写出M与NaOH溶液反应的化学方程式是__________________________________。 (5)物质F的结构是:,则符合下列条件的F的同分异构体有______种。 ①能发生银镜反应 ②能与NaHCO3溶液反应 ③分子中有苯环,无结构。其中苯环上只有两个取代基,且核磁共振氢谱有4组峰,峰面积之比为1∶2∶2∶1的为___________(写结构简式)。 (6)已知:,写出以苯酚、乙醇和ClCH2COOH为原料制备的合成路线流程图(无机试剂任用)。_______________________________________________________________ 【答案】(1)羧基、羟基(酚羟基) (2) (3)缩聚反应 取代反应(酯化反应) (4) (5)13 (6) 【解析】苯酚与氢氧化钠反应生成苯酚钠,则A为,由合成流程可知B为,C的分子式为C5H12 O,C能与金属Na反应,说明属于饱和一元醇,C分子中有3中不同化学环境的氢原子,故C的结构简式是,B与C发生酯化反应生成M,M为;苯酚与丙酮反应生成D,D的分子式为C15H16O2,再结合N的结构可知D为。(1)B的结构简式为,其含有的官能团为羧基、醛基,故答案为:羧基、羟基(酚羟基);(2)C的分子式为C5H12O,C能与金属Na反应,说明属于饱和一元醇,C分子中有3中不同化学环境的氢原子,故C的结构简式是,故答案为:;(3)D生成N的反应为与发生缩聚反应生成;B与C反应生成M的反应为在浓硫酸作用下,与共热发生酯化反应生成,故答案为:缩聚反应;取代反应(酯化反应);(4)含有羟基和酯基,与NaOH溶液反应生成、和水,反应的化学方程式为:,故答案为: ;(5)由结构简式可知F的分子式为C8H6O4,由F的同分异构体符合条件可知分子中有苯环,含有—COOH,HCOO—或—CHO和—OH,若苯环上连有—COOH和HCOO—,有邻、间、对3种位置异构;若苯环上连有—COOH、—CHO和—OH共有10种结构,则符合F的同分异构体条件共有13种;若苯环上只有两个取代基,核磁共振氢谱有4组峰,峰面积之比为1∶2∶2∶1的结构简式为,故答案为:13;;(6)由题给信息可知应先生成ClCH2COOH和苯酚钠,然后在酸性条件下反应生成,进而与乙醇发生酯化反应可生成目标物,合成路线为: ,故答案为:。查看更多