- 2021-04-28 发布 |
- 37.5 KB |
- 9页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018届一轮复习苏教版原子结构与性质学案
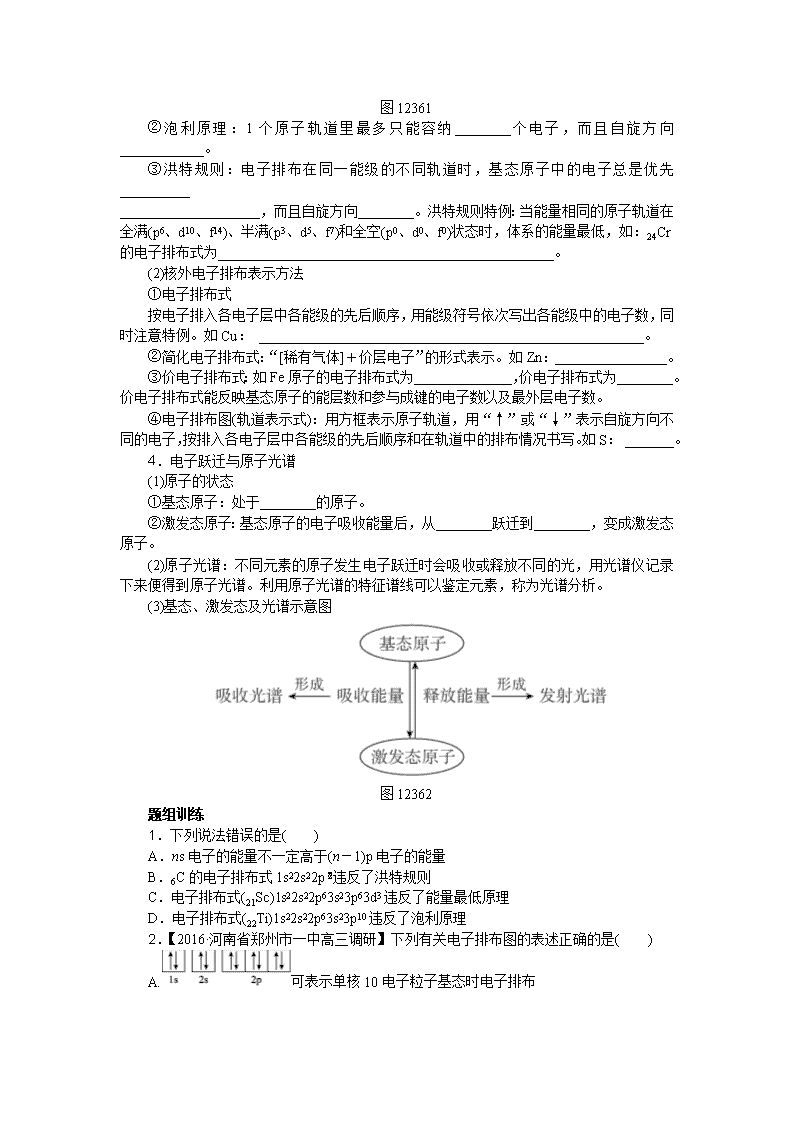
专题十二单元 物质结构与性质 第三十六单元 原子结构与性质 考试说明 1.了解原子核外电子的运动状态、能级分布和排布原理,能正确书写1~36号元素原子核外电子、价电子的电子排布式和轨道表达式。 2.了解电离能的含义,并能用以说明元素的某些性质。 3.了解电子在原子轨道之间的跃迁及其简单应用。 4.了解电负性的概念,并能用以说明元素的某些性质。 【考点互动探究】 考点一 原子核外电子排布原理 知识梳理 1.能层与能级 (1)能层(n):在多电子原子中,核外电子的________是不同的,按照电子的________差异将其分成不同能层。通常用K、L、M、N、O、P、Q……表示相应的第一、二、三、四、五、六、七……能层,能量依次升高。 (2)能级:同一能层的电子的________也可能不同,又将其分成不同的能级,通常用________等表示,同一能层里,各能级的能量按s、p、d、f的顺序升高,即_______________。 2.原子轨道 (1)原子轨道:表示电子在原子核外的一个空间运动状态。电子云轮廓图给出了电子在________________的区域。 原子轨道 轨道形状 轨道个数 s p (2)能量关系 ①相同能层上原子轨道能量的高低:________________________________________。 ②形状相同的原子轨道能量的高低:1s<2s<3s<4s…。 ③同一能层内形状相同而伸展方向不同的原子轨道的能量相等,如npx、npy、npz轨道的能量相等。 3.原子核外电子的排布规律 (1)原子核外电子排布遵循三个原理 ①能量最低原理:原子的核外电子排布遵循构造原理,使整个原子的能量处于__________,即电子尽先占有能量低的轨道,然后依次进入能量较高的轨道。构造原理示意图如下: 图12361 ②泡利原理:1个原子轨道里最多只能容纳________个电子,而且自旋方向____________。 ③洪特规则:电子排布在同一能级的不同轨道时,基态原子中的电子总是优先__________ ____________________,而且自旋方向________。洪特规则特例:当能量相同的原子轨道在全满(p6、d10、f14)、半满(p3、d5、f7)和全空(p0、d0、f0)状态时,体系的能量最低,如:24Cr的电子排布式为________________________________________________。 (2)核外电子排布表示方法 ①电子排布式 按电子排入各电子层中各能级的先后顺序,用能级符号依次写出各能级中的电子数,同时注意特例。如Cu: _______________________________________________________。 ②简化电子排布式:“[稀有气体]+价层电子”的形式表示。如Zn:________________。 ③价电子排布式:如Fe原子的电子排布式为______________,价电子排布式为________。价电子排布式能反映基态原子的能层数和参与成键的电子数以及最外层电子数。 ④电子排布图(轨道表示式):用方框表示原子轨道,用“↑”或“↓”表示自旋方向不同的电子,按排入各电子层中各能级的先后顺序和在轨道中的排布情况书写。如S: _______。 4.电子跃迁与原子光谱 (1)原子的状态 ①基态原子:处于________的原子。 ②激发态原子:基态原子的电子吸收能量后,从________跃迁到________,变成激发态原子。 (2)原子光谱:不同元素的原子发生电子跃迁时会吸收或释放不同的光,用光谱仪记录下来便得到原子光谱。利用原子光谱的特征谱线可以鉴定元素,称为光谱分析。 (3)基态、激发态及光谱示意图 图12362 题组训练 1.下列说法错误的是( ) A.ns电子的能量不一定高于(n-1)p电子的能量 B.6C的电子排布式1s22s22p违反了洪特规则 C.电子排布式(21Sc)1s22s22p63s23p63d3违反了能量最低原理 D.电子排布式(22Ti)1s22s22p63s23p10违反了泡利原理 2.【2016·河南省郑州市一中高三调研】下列有关电子排布图的表述正确的是( ) A.可表示单核10电子粒子基态时电子排布 B.此图错误,违背了泡利原理 C.表示基态N原子的价电子排布 D.表示处于激发态的B的电子排布 3.(1) 【2016·全国卷Ⅱ】东晋《华阳国志·南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。镍元素基态原子的电子排布式为____________,3d能级上的未成对电子数为________。 (2) 【2016·全国卷Ⅰ】锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。基态Ge原子的核外电子排布式为[Ar]__________,有__________个未成对电子。 (3) 【2015·福建卷】基态Ni原子的电子排布式为____________,该元素位于元素周期表中的第________族。 (4) 【2015·安徽卷】N的基态原子核外电子排布式为____________;Cu的基态原子最外层有________个电子。 (5) 【2014·新课标全国卷Ⅰ】基态Fe原子有________个未成对电子,Fe3+ 的电子排布式为____________。可用硫氰化钾检验Fe3+,形成的配合物的颜色为________。 规律小结 基态原子核外电子排布表示方法中的常见误区 (1)在写基态原子的电子排布图时,常出现以下错误: ① (违反能量最低原理) ② (违反泡利原理) ③ (违反洪特规则) ④ (违反洪特规则) (2)注意元素电子排布式、简化电子排布式、元素价电子排布式的区别与联系。如Cr的电子排布式:1s22s22p63s23p63d54s1;简化电子排布式:[Ar]3d54s1;价电子排布式:3d54s1。 考点二 原子结构与元素性质 知识梳理 1.原子结构与元素周期表的关系 (1)各周期原子核外电子排布 周期 电子层数 每周期第一种元素 每周期最后一种元素 原子 序数 基态原子的 电子排布式 原子 序数 基态原子的 电子排布式 二 2 3 [He]2s1 10 1s22s22p6 三 3 11 ________ ____ ________ 四 4 19 ________ ____ ________ 五 5 37 [Kr]5s1 54 1s22s22p63s23p63d10 4s24p64d105s25p6 六 6 55 [Xe]6s1 86 1s22s22p63s23p63d104s24p6 4d104f145s25p65d106s26p6 (2)各族元素的价电子排布特点 ①主族: 主族 ⅠA ⅡA ⅢA ⅣA 价电子排布特点 ns1 ns2 ns2np1 ns2np2 主族 ⅤA ⅥA ⅦA 价电子排布特点 ns2np3 ns2np4 ns2np5 ②0族:He:1s2;其他:ns2np6。 ③过渡元素(副族和第Ⅷ族):(n-1)d1~10ns1~2(钯为4d10)。 (3)元素周期表的分区与价电子排布的关系 ①元素周期表的分区: ②各区元素价电子排布特点: 分区 价电子排布 s区 ________ p区 ________(除He外) d区 (n-1)d1~9ns1~2(除钯外) ds区 (n-1)d10ns1~2 f区 (n-2)f0~14(n-1)d0~2ns2 2.元素周期律 (1)电离能 ①第一电离能:气态电中性基态原子失去一个电子转化为__________________所需要的最低能量,符号:I1;单位:kJ·mol-1。 ②规律 a.同周期:第一种元素的第一电离能________,最后一种元素的第一电离能________,总体呈现__________________的变化趋势。第二、三、四周期的同周期主族元素,第ⅡA族(ns2np0)和第ⅤA族(ns2np3),因p轨道处于全空或半充满状态,比较稳定,所以其第一电离能________同周期相邻的ⅢA和ⅥA族元素,如第一电离能Mg________Al,P________S。 b.同族元素:从上至下第一电离能________。 c.同种原子:随着电子的逐个失去,阳离子所带的正电荷数越来越________ ,再失去电子需克服的电性引力越来越________,消耗的能量越来越________,逐级电离能越来越________(即I1________I2________I3……)。 (2)电负性 ①含义:元素的原子在化合物中吸引键合电子能力的标度。元素的电负性越大,表示其原子在化合物中吸引键合电子的能力越________。 ②标准:以最活泼的非金属氟的电负性为________作为相对标准,计算得出其他元素的电负性(稀有气体未计)。 ③变化规律 金属元素的电负性一般________,非金属元素的电负性一般________,而位于非金属三角区边界的“类金属”(如锗、锑等)的电负性则在________。 在元素周期表中,同周期从左至右,元素的电负性逐渐________,同主族从上至下,元素的电负性逐渐________。 ③电负性的应用。 a.判断元素金属性、非金属性强弱。电负性越大,非金属性________,金属性________。 b.判断化学键的类型。一般认为如果两种成键原子间的电负性差值大于1.7,通常形成________;若差值小于1.7,通常形成________。 题组训练 1.【2016·福建四地六校联考】已知X、Y是主族元素,I为电离能,单位是kJ·mol-1。请根据表中所列数据判断,下列说法错误的是( ) 元素 I1 I2 I3 I4 X 500 4600 6900 9500 Y 580 1820 2750 11 600 A.元素X的常见化合价是+1价 B.元素Y是第ⅢA族元素 C.元素X与氯形成化合物时,化学式可能是XCl D.若元素Y处于第三周期,它可与冷水剧烈反应 2.已知X、Y元素同周期,且电负性X>Y,则下列说法正确的是( ) A.X与Y形成化合物时,X显负价,Y显正价 B.第一电离能Y一定小于X C.最高价含氧酸的酸性:X对应的酸性弱于Y对应的酸性 D.气态氢化物的稳定性:HmY大于HmX 3.(1) 【2016·全国卷Ⅲ】砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。 ①写出基态As原子的核外电子排布式:____________。 ②根据元素周期律,原子半径Ga________As,第一电离能Ga________As。(填“大于”或“小于”) (2) 【2015·全国卷Ⅱ】A、B、C、D为原子序数依次增大的四种元素,A2- 和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。四种元素中电负性最大的是__________(填元素符号),其中C原子的核外电子排布式为____________。 (3) 【2015·福建卷】 CH4和CO2所含的三种元素电负性从小到大的顺序为____________。 规律小结 原子结构与元素性质的关系 项目 同周期(从左到右) 同主族(从上到下) 原子核外 电子排布 电子层数相同,最外层电子数逐渐增多,1→7(第一周期1→2) 最外层电子数相同,电子层数递增 原子得、失 电子能力 得电子能力逐渐增强 失电子能力逐渐减弱 得电子能力逐渐减弱 失电子能力逐渐增强 元素的第 一电离能 第一电离能呈增大的趋势 第一电离能逐渐减小 (续表) 项目 同周期(从左到右) 同主族(从上到下) 元素的电 负性 电负性逐渐增大 电负性逐渐减小 元素金属 性、非金 属性 金属性逐渐减弱 非金属性逐渐增强 金属性逐渐增强 非金属性逐渐减弱 单质氧 化性、 还原性 氧化性逐渐增强 还原性逐渐减弱 氧化性逐渐减弱 还原性逐渐增强 【考例考法直击】 1.(1) 【2016·江苏卷节选】[Zn(CN)4]2- 在水溶液中与HCHO发生如下反应: 4HCHO+[Zn(CN)4]2-+4H++4H2O===[Zn(H2O)4]2++4HOCH2CN,Zn2+ 基态核外电子排布式为______________。 (2) 【2016·四川卷节选】M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素。M基态原子L层中p轨道电子数是s电子的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,Z的基态原子 4s 和3d轨道半充满。R基态原子的电子排布式是____________,X和Y中电负性较大的是____________(填元素符号)。 2.(1) 【2015·全国卷Ⅰ节选】处于一定空间运动状态的电子在原子核外出现的概率密度分布可用__________形象化描述。在基态14C原子中,核外存在__________对自旋相反的电子。 (2) 【2015·海南卷节选】钒在元素周期表中的位置为__________,其价层电子排布图为____________。 3.(1) 【2014·新课标全国卷Ⅱ节选】周期表前四周期的元素a、b、c、d、e,原子序数依次增大。a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子。b、c、d中第一电离能最大的是__________(填元素符号),e的价层电子轨道示意图为____________。 (2) 【2014·四川卷节选】X、Y、Z、R为前四周期元素,且原子序数依次增大。XY2是红棕色气体;X与氢元素可形成XH3;Z基态原子的M层与K层电子数相等;R2+ 离子的3d轨道中有9个电子。Y基态原子的电子排布式是______________;Z所在周期中第一电离能最大的主族元素是____________。 (3) 【2014·江苏卷节选】Cu+基态核外电子排布式为______________。 (4) 【2014·安徽卷节选】①Na位于元素周期表第______周期第________族;S的基态原子核外有________个未成对电子;Si的基态原子核外电子排布式为____________。 ②用“>”或“<”填空: 第一电离能 离子半径 熔点 酸性 Si____S O2-____Na+ NaCl____Si H2SO4____HClO4 参考答案 第三十六单元 原子结构与性质 【考点互动探究】 考点一 知识梳理 1.(1)能量 能量 (2)能量 s、p、d、f E(s)查看更多