- 2021-04-27 发布 |
- 37.5 KB |
- 7页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
湖北省武汉市2020届高三毕业生六月供题(一)理综化学试题
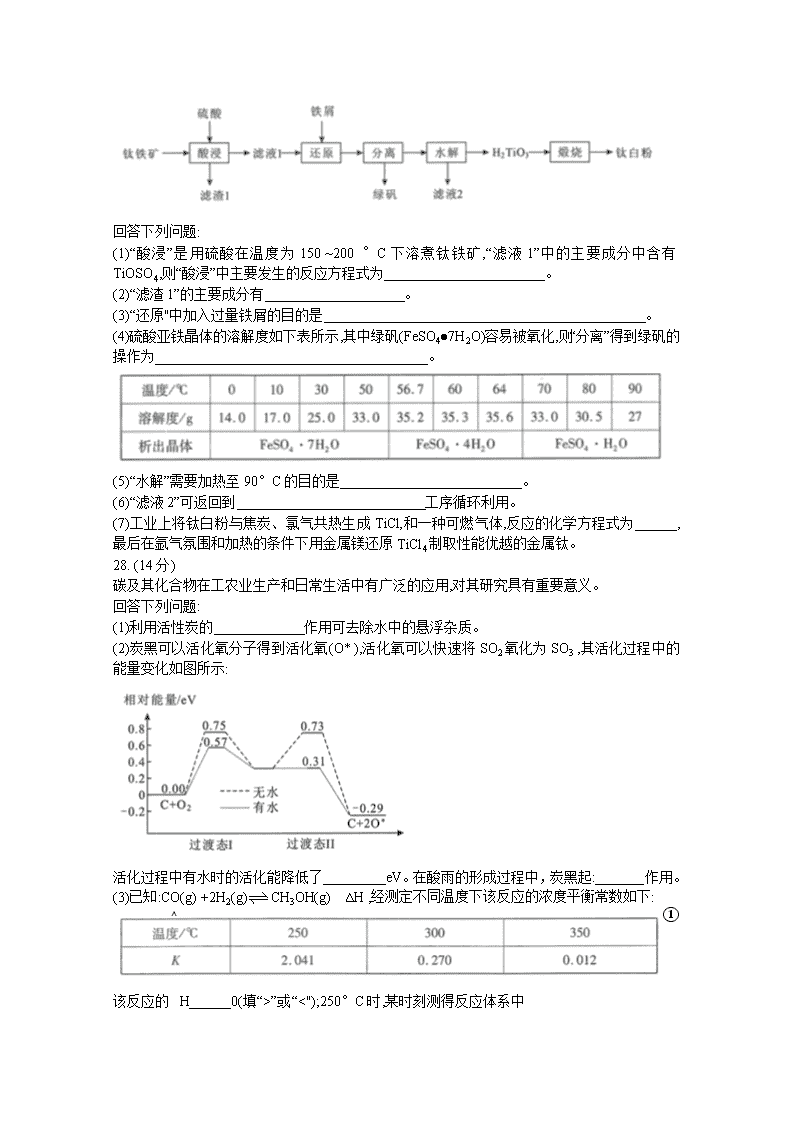
武汉市2020届高中毕业生六月供题(一) 理科综合试卷化学部分 7.常用杀菌消毒的物质有75%酒精、84消毒液、过氧乙酸(CH3C000H)和氯仿等。下列说 法错误的是 A.95%酒精可以更高效灭活新冠病毒 B.84消毒液不能与洁厕灵混合使用 C.过氧乙酸含过氧键而具有强氧化性 D.氯仿可溶解病毒的蛋白质外壳 8.设NA是阿伏加德罗常数的值。下列说法正确的是 A.1 mol NaHSO4固体中含有离子总数为3NA B.11.2 L(标准状况)HF含有质子数为5NA C.50 g 46%的乙醇水溶液中,含有O-H键数为3.5NA D.1 mol Cu与足量的硫蒸气反应,转移电子数为2NA 9.甲在--定条件下能与醋酸反应转化为乙。下列说法正确的是 A.甲与环戍二烯互为同系物 B.乙不能发生加成聚合反应 C.乙的二氯代物共有5种 D.甲和乙均难溶于水 10.从煤的干馏产物中可获得重要的化工原料,实验装置如图所示。下列关于实验操作或叙述错误的是 A.冰水起冷凝作用 B.水层中滴入酚酞溶液后变为红色 C.可用分馏方法从煤焦油中分离出苯、甲苯、二甲苯 D.焦炉气可使酸性KMn04溶液褪色,说明产物中有H2S 11.某科研团队报道了以LiAlCl4离子液体作为电解质的铝离子 二次电池,其放电工作原理如图所示。下列说法错误的是 A.充电时,b极质量减小 B.放电时,阴离子向a极移动 C.充电时,正极反应为4Al2C17- +3e- = Al + 7AlCl4 D.放电时,阴极反应为FePO4+Li+ +e-=LiFePO4 12.已知w、X.Y、Z是四种原子序数依次增大的短周期元素。甲、乙、丙分别是W与X、Y、Z形成的18电子二元化合物,且都存在极性键和非极性键。下列说法 正确的是 A.最简单氢化物沸点:X> Y B.原子半径:X>Y>Z>W C. X的最高价氧化物对应水化物是一元强酸 D.常温下,甲、乙、丙都是液体且都具有对称结构 13.某科研小组利用电导率(电导率越大,导电能力越强)传感器、pH传感器探究NaHCO3和CaCl2能否发生化学反应。向25. 00 mL0.1 mol●L-1 NaHCO3溶液中滴人等体积、等浓度CaCl2 溶液,电导率以及pH变化曲线如下图所示。下列说法错误的是 A.电导率下降的原因是生成了CaCO3沉淀导致溶液中离子浓度降低 B. a点后pH下降的原因是Ca2+促进HCO3H+ +CO3-平衡右移 C. pH =7.3时,溶液中溶质主要为NaCl、CaCl2 D.可用0.1 mol●L-1 CaCl2溶液鉴别浓度均为0.1 mol· L-1的NaHCO3和Na2CO3溶液 26. (15分) 草酸合铁( III )酸钾晶体[K3[Fe(C2O4)3]·3H2O]是制备负载型活性铁催化剂的主要原料。某科研团队以硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O]为原料制备草酸合铁(III)酸钾晶体的具体流程如下: 回答下列问题: (1)配制100mL1.00mol●L-1的硫酸亚铁铵溶液。溶液配制过程中需用到的玻璃仪器除烧杯、玻璃棒、量筒外,还有______。 在配制时需加入适量稀硫酸的目的是___________ (2)取12. 5 mL硫酸亚铁铵溶液于烧杯中,水浴加热至100°C ,缓缓滴入饱和H2C2O4溶 液,有黄色沉淀( FeC2O4●2H2O)生成,反应的离子方程式为________________ (3)在“酸溶”操作中,需保持溶液的pH为3.5,溶液中 (H2C2O4的Ka1=10-1.25 ,Ka2=10-4.27)。 (4)在“反应”中,先维持40°C水浴加热,滴加10mL6%H2O2溶液,一段时间后,再微沸2 min;然后冷却,继续交替滴加H2C2O4和K2C2O4溶液直至溶液呈亮绿色。维持40°C水浴加热使最终所得产品产率最高的原因是_______ ,溶液微沸的目的是_______________。 (5)经“步骤I”结晶、抽滤、洗涤、避光干燥,最终得到产品5.45 g,产品的产率为_______(保留1位小数)。 (6)草酸合铁(I)酸钾晶体为光敏配合物,应避光保存,光照时会发生光化学分解反应生成草酸钾和草酸亚铁,同时有气体生成,反应的化学方程式为____________________。 27. (14分) 钛白粉(TiO2)作为白色颜料和增白剂,广泛用于油漆、造纸等工业生产中。一种以钛铁矿(含FeTiO3及少量的CaO、Fe2O3、SiO2 )为原料生产钛白粉的工艺流程如下: 回答下列问题: (1)“酸浸”是用硫酸在温度为150 ~200 °C下溶煮钛铁矿,“滤液1”中的主要成分中含有TiOSO4,则“酸浸”中主要发生的反应方程式为_______________________。 (2)“滤渣1”的主要成分有____________________。 (3)“还原"中加入过量铁屑的目的是______________________________________________。 (4)硫酸亚铁晶体的溶解度如下表所示,其中绿矾(FeSO4●7H2O)容易被氧化,则“分离”得到绿矾的操作为_______________________________________。 (5)“水解”需要加热至90°C的目的是__________________________。 (6)“滤液2”可返回到___________________________工序循环利用。 (7)工业上将钛白粉与焦炭、氯气共热生成TiCl,和一种可燃气体,反应的化学方程式为______,最后在氩气氛围和加热的条件下用金属镁还原TiCl4制取性能优越的金属钛。 28. (14分) 碳及其化合物在工农业生产和日常生活中有广泛的应用,对其研究具有重要意义。 回答下列问题: (1)利用活性炭的_____________作用可去除水中的悬浮杂质。 (2)炭黑可以活化氧分子得到活化氧(O* ),活化氧可以快速将SO2氧化为SO3 ,其活化过程中的能量变化如图所示: 活化过程中有水时的活化能降低了_________eV。在酸雨的形成过程中,炭黑起:_______作用。 (3)已知:CO(g) +2H2(g)CH3OH(g) ∆H ,经测定不同温度下该反应的浓度平衡常数如下: ①该反应的△H______0(填“>”或“<");250°C时,某时刻测得反应体系中 c(CO)=0.4 mol●L-1、c(H2) =0.4 mol●L-1、c(CH3OH) =0.8 mol·L-1,则此时v正____v逆(填“>”、“=”或“<”)。. ②某温度下,在2L刚性容器中,充入0.8molCO和1.6molH2,压强为p, tmin后达到平衡,测得压强为P。则v(H2) =__________mol●L-1·min-1, 平衡时的Kp=___________。 (4)科研人员设计了甲烷燃料电池电解饱和食盐水装置如下图所示,电池的电解质是掺杂了Y2O3与ZrO2的固体,可在高温下传导O2-。 ①该电池工作时负极反应方程式为___________________. ②用该电池电解100mL饱和食盐水,若在两极产生的气体体积分别为V1L、V2L(标准状况),且V1> V2,则电解所得溶液的c(OH-) =._______mol·L-1(忽略气体溶解和溶液体积变化)。 35.[化学一选 修3 :物质结构与性质](15分) 光刻技术需利用深紫外激光,我国是唯一掌握通过非线性光学晶体变频来获得深紫外激光技术的国家。目前唯一.实用化的晶体是氟硼铍酸钾( KBBF,含K、B、Be 、O、F元素)。 回答下列问题: (1)-群均处于激发态1s22s13s1的铍原子,若都回到基态,最多可发出_______种波长不同的光。 A.1 B.2 C. 3 D.4 (2)Be和B都容易与配体形成配位键,如[BeF4]-、[B(OH)4]-等,从原子结构分析其原因是_____________________. (3)氟硼酸钾是制备KBBF的原料之一,高温下分解为KF和BF3。KF的沸点比BF3的高,原因是____________________________。 (4)BF3易水解得到H3BO3 (硼酸)和氢氟酸。氢氟酸浓溶液中因F-与HF结合形成HF2-使酸性大大增强。HF2-的结构式为_____;H3BO3 和BF4-中, B原子的杂化类型分别为______、____。 (5) KBBF晶体为层片状结构,图1为其中一层的局部示意图。平面六元环以B--O键和Be-O键交织相连,形成平面网状结构,每个Be都连接一个F,且F分别指向平面的上方或下方,K+分布在层间。KBBF 晶体的化学式为_____________。 (6):BeO晶体也是制备KBBF的原料,图2为其晶胞结构示意图。 ①沿着晶胞体对角线方向的投影,下列图中能正确描述投影结果的是__________。 ②BeO晶胞中,O的堆积方式为_______;设O与Be的最近距离为a cm,NA表示阿伏加德罗常数的值,则BeO晶体的密度为________g. cm-3。 36. [化学一选修 5:有机化学基础](15分) 双氯芬酸钠( G)是常用的抗炎镇痛药,一种合成路线如下(-Ph为苯基): 回答下列问题: (1)9.8g A完全燃烧生成26.4 g CO2和9.0g H2O,且A的核磁共振氢谱中有3组峰,峰面积之比为1:2:2,则A的结构简式是_____________ (2)B中的官能团名称是______________ (3)E到F的反应类型是_______________ (4)写出F到G的反应方程式_______________ (5)能发生银镜反应且为环状结构的A的同分异构体多达14种,写出其中只含一条侧链且侧链上的一氯代物为2种的结构简式________ (不考虑立体异构)。 (6)设计由2-丙醇和对苯二胺()制备的合成路线_____________________________(无机试剂任选)。查看更多