- 2021-04-27 发布 |
- 37.5 KB |
- 20页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020年高考化学一轮复习课件:模块3 第七单元 小专题九 化学工艺流程题的突破策略
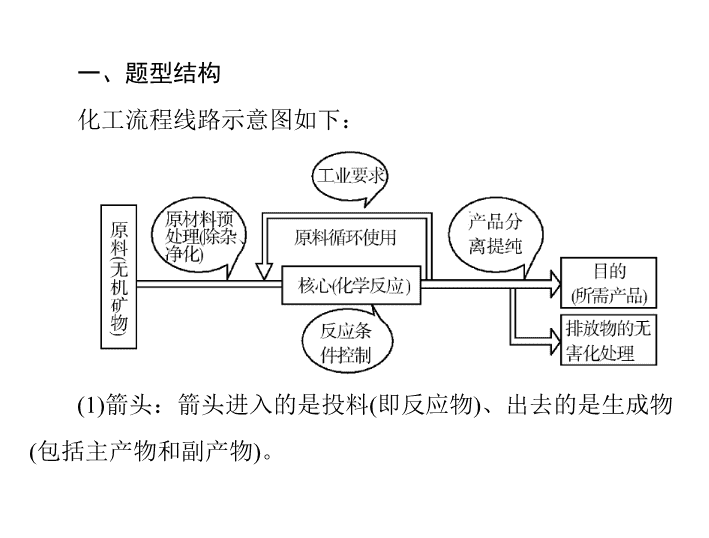
小专题九 化学工艺流程题的突破策略 一、题型结构 化工流程线路示意图如下: (1) 箭头:箭头进入的是投料 ( 即反应物 ) 、出去的是生成物 ( 包括主产物和副产物 ) 。 (2) 三线:出线和进线均表示物料流向或操作流程,可逆线 表示该物质循环使用。 (3) 规律:主线主产品,分支副产品,回头为循环。 二、解题方法 (1) 首尾分析法:对线型流程工艺 ( 从原料到产品为一条龙的 生产 工序 ) 试题,首先对比分析流程图中的第一种物质 ( 原材料 ) 与最后一种物质 ( 产品 ) ,从此分析中找出它们的关系,弄清原 料转化的 基本原理和除杂、分离、提纯的化工工艺,再结合题 设问题,逐一解答。 (2) 分段分析法:对于用同样的原料生产多种 ( 两种或两种以 上 ) 产品 ( 含副产品 ) 的工艺流程题,用此法更容易找到解题的 切 入点。 (3) 交叉分析法:有些化工生产选用多组原材料,先合成一 种或几种中间产品,再用这一中间产品与部分其他原材料生产 所需的主流产品,这种题适合用交叉分析法。即将提供的流程 示意图结合常见化合物的制取原理划分成几条生产流水线,然 后上下交叉分析。 三、考查角度 角度 1 考查原料预处理方式 1. 研磨、粉碎、喷洒 (1) 可增大反应物的接触面和接触机会,加快反应速率,以 提高原料转化率、利用率、浸取率等。 (2) 增大接触面积的具体措施有:固体采用粉碎、研磨的方 法;液体采用喷洒的方法;气体采用多孔分散器 ;等。 2. 浸出 浸出即浸取、溶解,向固体中加入适量溶剂,使其中可溶 性的物质溶解或通过反应进入溶液。浸出可分为水浸、酸浸、 碱浸、醇浸等。 (1) 水浸:是为了分离水溶性和非水溶性的物质; (2) 酸浸:是为了溶解金属、金属氧化物、调节 pH 促进某 离子的水解而转化为沉淀等; (3) 碱浸:是为了除去油污、溶解酸性氧化物、溶解铝及其 化合物、调节 pH 等; (4) 醇浸:为了提取有机物。 3. 灼烧 ( 煅烧、焙烧 ) 是指在高温下使固体原料分解、反应或改变结构。 4. 搅拌、加热 加速溶解;增大反应物的接触面积,加快反应速率;对于 吸热反应,加热可同时提高原料的转化率,但要避免反应物或 生成物的过热分解。 5. 表面处理 如除去表面油污;金属晶体可用机械法打磨;化学法除去 表面氧化物;等。 角度 2 考查反应条件控制 反应条件 条件内容 调节溶液 的 pH (1) 目的:使某些金属离子形成氢氧化物沉淀而分离。 (2) 方法:加入能消耗 H + 的物质且不引入新的杂质。如要除去 Cu 2 + 中混有的 Fe 3 + ,可加入 CuO 、 Cu(OH) 2 、 Cu 2 (OH) 2 CO 3 等来调节溶液的 pH ( 续表 ) 反应条件 条件内容 控制温度 (1) 加热:加快反应速率或溶解速率;促进平衡向吸热方向移动;除杂,除去热不稳定的杂质,如 NaHCO 3 、 Ca(HCO 3 ) 2 、 KMnO 4 、 NH 4 Cl 等物质;使沸点相对较低或易升华的原料气化。 (2) 降温:防止某物质在高温时溶解 ( 或分解 ) ;使化学平衡向着题目要求的方向移动 ( 放热方向 ) ;使某个沸点较高的产物液化,使其与其他物质分离;降低晶体的溶解度,减少损失。 (3) 控温 ( 用水浴带温度计便于控温且受热均匀 ) :防止某种物质温度在过高时分解或挥发;为了使某物质达到沸点挥发出来;使催化剂的活性达到最好;防止副反应的发生。 (4) 降温或减压可以减少能源成本,降低对设备的要求,达到绿色化学的要求 反应条件 条件内容 控制压强 改变速率,使平衡向需要的方向移动 使用催化剂 大大提高反应速率、降低能耗,但不影响化学平 衡。使用时必须注意其活性温度,且防止杂质使 催化剂“中毒”,延长使用寿命 ( 续表 ) 方法 目的 水溶法 除去可溶性杂质 酸溶法 除去碱性杂质 碱溶法 除去酸性杂质 氧化剂或还原剂法 除去还原性或氧化性杂质 加热灼烧法 除去受热易分解或易挥发的杂质 调节 pH 法 如除去酸性铜溶液中的 Fe 3+ 等 角度 3 考查混合物的提纯方法 角度 4 考查混合物的分离方法 (1) 过滤 ( 趁热过滤或抽滤 ) :分离难溶物和易溶物,根据特 殊需要采用趁热过滤或者抽滤等方法。 (2) 萃取和分液:利用溶质在互不相溶的溶剂里的溶解度不 同提取分离物质,如用 CCl 4 萃取溴水中的溴。 (3) 结晶:蒸发结晶、冷却热饱和溶液。 (4) 蒸馏或分馏:分离沸点不同且互溶的液体混合物,如分 离乙醇和甘油。 (5) 冷却法:利用气体易液化的特点分离气体,如合成氨工 业采用冷却法分离氨气 与氮气、氢气。 角度 5 考查绿色化学 物质的循环利用、废物处理、原子利用率、能量的充分利 用等。 角度 6 考查化工安全 防爆、防污染、防中毒等。 角度 7 考查反应原理 离子反应、氧化还原反应、化学平衡、电离平衡、溶解平 衡、水解原理等。 角度 8 考查循环操作与副产物利用 (1) 对可逆反应:可将未转化的反应物分离出来后送入反应 器重新反应。如合成氨反应是可逆反应,分离氨后的尾气中还 含有大量原料气 (N 2 和 H 2 ) 可送入合成塔,实施循环生成。 (2) 若某种物质在流程中既是辅助原料又是副产品 ( 既流进 又流出 ) ,则可考虑循环利用。 (3) 注意某些隐形存在物质,在循环操作中因累积导致浓度 过高,可能影响 产品的纯度。 [ 典例 ] (2018 年北京卷 ) 磷精矿湿法制备磷酸的一种工艺 流 程如下: 已知:磷精矿主要成分为 Ca 5 (PO 4 ) 3 (OH) ,还含有 Ca 5 (PO 4 ) 3 F 和有机碳等。 溶解度: Ca 5 (PO 4 ) 3 (OH)查看更多