- 2021-04-27 发布 |
- 37.5 KB |
- 6页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学二轮复习化学实验常用仪器及基本操作专题练习
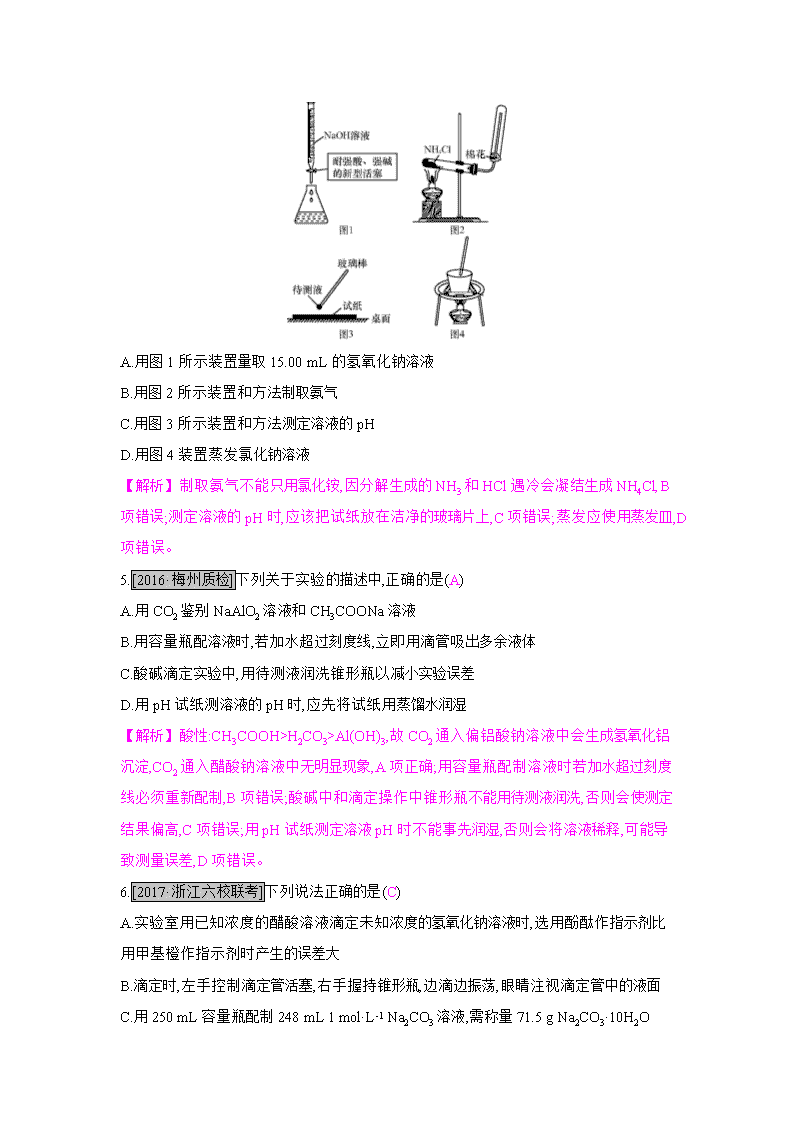
化学实验常用仪器及基本操作 一、选择题(每小题6分,共66分) 1.[2016·西安铁一中模拟]下列操作中,所用仪器合理的是(C) A.用托盘天平称量5.22 g食盐 B.用瓷坩埚加热熔融NaOH C.用漏斗向小口容器添加液体 D.用25 mL的碱式滴定管量取15.12 mL高锰酸钾溶液 【解析】A项,托盘天平的精确度为0.1 g,不合理;B项,瓷坩埚中的二氧化硅与NaOH反应,不合理;D项,高锰酸钾溶液有强氧化性,应该用酸式滴定管量取,不合理。 2.[2016·河南中奥维也维音乐学校月考]实验室下列物质的保存方法中,不正确的是(B) A.铝片放在不密封的容器里 B.新制氯水保存在带玻璃塞的细口瓶中 C.氢氧化钠溶液盛装在带橡胶塞的试剂瓶中 D.浓硝酸用带玻璃塞的棕色细口瓶保存在阴暗处 【解析】新制氯水中的次氯酸见光分解生成盐酸和氧气,所以应该保存在带玻璃塞的棕色细口瓶中,B项错误。 3.[2017·南阳期中检测]下列关于仪器使用的说法正确的是(B) A.在量取液体后,量筒中残留的液体要用蒸馏水洗涤并转入相应容器 B.熔融纯碱、烧碱时,不能选用石英坩埚,应该选用铁坩埚 C.蒸发结晶实验中,蒸发皿应放在石棉网上加热 D.在测量或监测温度时,温度计水银球碰到容器内壁不影响测量结果 【解析】A项,量筒是粗量仪器,制作量筒时已经把残留考虑进去了;石英的成分是SiO2,在高温情况下能和纯碱、烧碱反应,因此应用铁坩埚,B项正确;蒸发皿直接加热,不需要垫石棉网,C项错误;使用温度计,水银球不能碰容器内壁,D项错误。 4.用下列实验装置和方法进行相应实验,能达到实验目的的是(A) A.用图1所示装置量取15.00 mL的氢氧化钠溶液 B.用图2所示装置和方法制取氨气 C.用图3所示装置和方法测定溶液的pH D.用图4装置蒸发氯化钠溶液 【解析】制取氨气不能只用氯化铵,因分解生成的NH3和HCl遇冷会凝结生成NH4Cl,B项错误;测定溶液的pH时,应该把试纸放在洁净的玻璃片上,C项错误;蒸发应使用蒸发皿,D项错误。 5.[2016·梅州质检]下列关于实验的描述中,正确的是(A) A.用CO2鉴别NaAlO2溶液和CH3COONa溶液 B.用容量瓶配溶液时,若加水超过刻度线,立即用滴管吸出多余液体 C.酸碱滴定实验中,用待测液润洗锥形瓶以减小实验误差 D.用pH试纸测溶液的pH时,应先将试纸用蒸馏水润湿 【解析】酸性:CH3COOH>H2CO3>Al(OH)3,故CO2通入偏铝酸钠溶液中会生成氢氧化铝沉淀,CO2通入醋酸钠溶液中无明显现象,A项正确;用容量瓶配制溶液时若加水超过刻度线必须重新配制,B项错误;酸碱中和滴定操作中锥形瓶不能用待测液润洗,否则会使测定结果偏高,C项错误;用pH试纸测定溶液pH时不能事先润湿,否则会将溶液稀释,可能导致测量误差,D项错误。 6.[2017·浙江六校联考]下列说法正确的是(C) A.实验室用已知浓度的醋酸溶液滴定未知浓度的氢氧化钠溶液时,选用酚酞作指示剂比用甲基橙作指示剂时产生的误差大 B.滴定时,左手控制滴定管活塞,右手握持锥形瓶,边滴边振荡,眼睛注视滴定管中的液面 C.用250 mL容量瓶配制248 mL 1 mol·L-1 Na2CO3溶液,需称量71.5 g Na2CO3·10H2O D.容量瓶、滴定管使用前均需检漏,并需要润洗以减小实验误差 【解析】用醋酸溶液滴定未知浓度的氢氧化钠溶液时,反应终点时pH为7~8,选用酚酞作指示剂,A项错误;滴定时,左手控制滴定管活塞,右手握持锥形瓶,边滴边振荡,眼睛注视锥形瓶内溶液颜色的变化,故B项错误;m(Na2CO3·10H2O)=250×10-3 L×1 mol·L-1×286 g·mol-1=71.5 g,C项正确;容量瓶不能润洗,D项错误。 7.仅用下表提供的玻璃仪器(非玻璃仪器任选)不能实现相应实验目的的是(D) 选项 实验目的 玻璃仪器 A 配制一定质量分数的NaCl溶液 胶头滴管、量筒、烧杯、玻璃棒 B 测定NaOH溶液浓度 滴定管、锥形瓶、烧杯 C 鉴别葡萄糖和蔗糖 试管、烧杯、酒精灯 D 实验室用浓氨水和生石灰制备氨气 长颈漏斗、烧杯、玻璃棒 【解析】浓氨水与生石灰制备氨气一般在锥形瓶或大试管中进行,D项不能达到实验目的。 8.某学生做完实验后,采用下列方法清洗所用仪器: ①用浓氨水清洗做过银镜反应后的试管 ②用酒精清洗做过碘升华的烧杯 ③用浓盐酸清洗做过高锰酸钾分解实验的试管 ④用盐酸清洗长期存放三氯化铁溶液的试剂瓶 ⑤用氢氧化钠溶液清洗盛过苯酚的试管 ⑥用热氢氧化钠的浓溶液清洗沾有硫黄的试管 下列对以上操作的判断正确的是(A) A.除①外都对 B.除⑥外都对 C.④⑤不对 D.全都正确 【解析】①做过银镜反应后的试管应用硝酸进行洗涤。 9.下列实验操作正确的是(C) A.将带火星的木条伸入集气瓶内检验氧气是否收集满 B.用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口放出 C.NaCl溶液蒸发结晶时,蒸发皿中有晶体析出并剩余少量液体时停止加热 D.测定溶液pH时,可用pH试纸蘸取少量待测液,并与标准比色卡比较 【解析】A项,检验氧气是否收集满应将带火星的木条放在集气瓶口,错误;B项,苯的密度小于水,萃取溴时,苯层在上层,上层溶液应从分液漏斗上口放出,错误;D项,测定溶液pH时,应把pH试纸放在洁净、干燥的玻璃片上,用玻璃棒蘸取待测液滴在pH试纸上,待变色后和标准比色卡比较,错误。 10.“绿色化学实验”已走进课堂,下列做法符合“绿色化学”的是(C) ①实验室收集氨气采用图一所示装置 ②实验室中做氯气与钠反应实验时采用图二所示装置 ③实验室中用玻璃棒分别蘸取浓盐酸和浓氨水做氨气与酸生成铵盐的实验 ④实验室中采用图三所示装置进行铜与稀硝酸的反应 A.②③④ B.①②③ C.①②④ D.①③④ 【解析】①实验室收集氨气采用题图一所示装置,可以吸收逸出的氨气,防止污染环境,符合绿色化学的要求;②实验室中做氯气与钠的反应实验时采用图二所示装置,沾有碱液的棉团可以吸收多余的氯气,防止污染环境,符合绿色化学的要求;③用玻璃棒分别蘸取浓盐酸和浓氨水做氨气与酸生成铵盐的实验,挥发的氯化氢和氨气会污染大气,不符合绿色化学的要求;④实验室中采用图三所示装置进行铜与稀硝酸的反应,生成的氮氧化物及时收集在气球里面,符合绿色化学的要求。 11.下列装置中,不添加其他仪器无法检查气密性的是(A) 【解析】B项,利用液差法:夹紧弹簧夹,通过长颈漏斗向试管内加水,长颈漏斗中会形成一段液柱,停止加水后,观察液柱是否变化即可判断;C项,利用加热(手捂)法:用酒精灯微热 (或用手捂热)试管,通过观察烧杯中有无气泡放出即可判断;D项,利用抽气法:向外轻轻拉动注射器活塞,通过观察浸没在水中的玻璃导管中口是否有气泡放出即可判断。 二、非选择题(共34分) 12.(15分)以下是实验室常用的部分仪器,请回答下列问题: (1)序号为⑧和⑩的仪器的名称分别为 容量瓶 、 冷凝管 。 (2)在分液操作中,必须用到上述仪器中的 ②⑥ (填序号)。 (3)能作反应容器且可直接加热的仪器是上述中的 试管 (填名称)。 (4)在配制一定物质的量浓度的溶液时,需要用到的仪器是 ②④⑧⑨ (填序号)。 (5)仪器上标有温度的是 ⑧⑨ (填序号)。 (6)如图是温度计、量筒、滴定管的一部分,下述读数(虚线刻度)及说法正确的是 B 。 A.①是量筒,读数为2.5 mL B.②是量筒,读数为2.5 mL C.③是滴定管,读数为2.5 mL D.②是温度计,读数为2.5 ℃ 【解析】(2)在分液操作中必须用到分液漏斗和烧杯。(3)能作为反应容器且能够直接加热的仪器是试管。(4)配制溶液时要用到的玻璃仪器是容量瓶、量筒、烧杯、玻璃棒、胶头滴管。(5)容量瓶、量筒上标有温度。(6)分析刻度可知①是温度计;②是量筒,精确到0.1 mL;③是滴定管,精确到0.01 mL,B项正确。 13.(19分)[2016·河南中原名校联考]溴乙烷是一种重要的化工合成原料。实验室合成溴乙烷的反应和实验装置如下: 反应:CH3CH2OH+HBrCH3CH2Br+H2O 装置: 实验中可能用到的数据如下表: 物质 相对分子质量 沸点/℃ 密度/(g·cm-3) 水溶性 CH3CH2OH 46 78.4 0.79 互溶 CH3CH2Br 109 38.4 1.42 难溶 CH3CH2OCH2CH3 74 34.5 0.71 微溶 CH2CH2 28 -103.7 0.38 不溶 浓硫酸(H2SO4) 98 338.0 1.38 易溶 ①合成反应:在仪器B中加入适量NaBr、浓硫酸和50 mL 乙醇,安装好仪器,缓缓加热,收集馏出物。 ②分离提纯:将馏出物加水后振荡,再加入适量酸除去乙醚,分液,最后得到52 mL溴乙烷。 回答下列问题: (1)仪器B的名称是 蒸馏烧瓶 。 (2)仪器C为直形冷凝管,冷水进口是 b (填“a”或“b”)。 (3)仪器D置于盛有 冰水混合物 的烧杯中,目的是 冷却溴乙烷 。 (4)装置A的名称为牛角管,其结构中的c支管的作用是 平衡装置D、装置B之间的气压,便于装置D接收馏出液 。 (5)溴乙烷粗产品分离提纯阶段,加水的目的是 除去溶解在溴乙烷中的乙醇 。 (6)该实验所得溴乙烷的产率为 78.9%(或79%或78.89%) 。 【解析】由题表中信息可知,产品的沸点为38.4 ℃,在制备过程可被蒸出,冷凝后可获得粗产品,为了防止产品的挥发,锥形瓶应置于冰水混合物中。粗产品中的乙醇可溶于水,故可在粗产品中加水,通过分液初步除去部分乙醇。(5)理论产量为50 mL×0.79 g·mL-146 g·mol-1×109 g·mol-1≈93.60 g,实际产量:52 mL×1.42 g·mL-1=73.84 g,产率为73.84 g93.60 g×100%≈78.89%。查看更多