- 2021-04-27 发布 |
- 37.5 KB |
- 13页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
【化学】河南省名校(南阳一中、信阳、漯河、平顶山一中四校)2020届高三3月线上联合考试
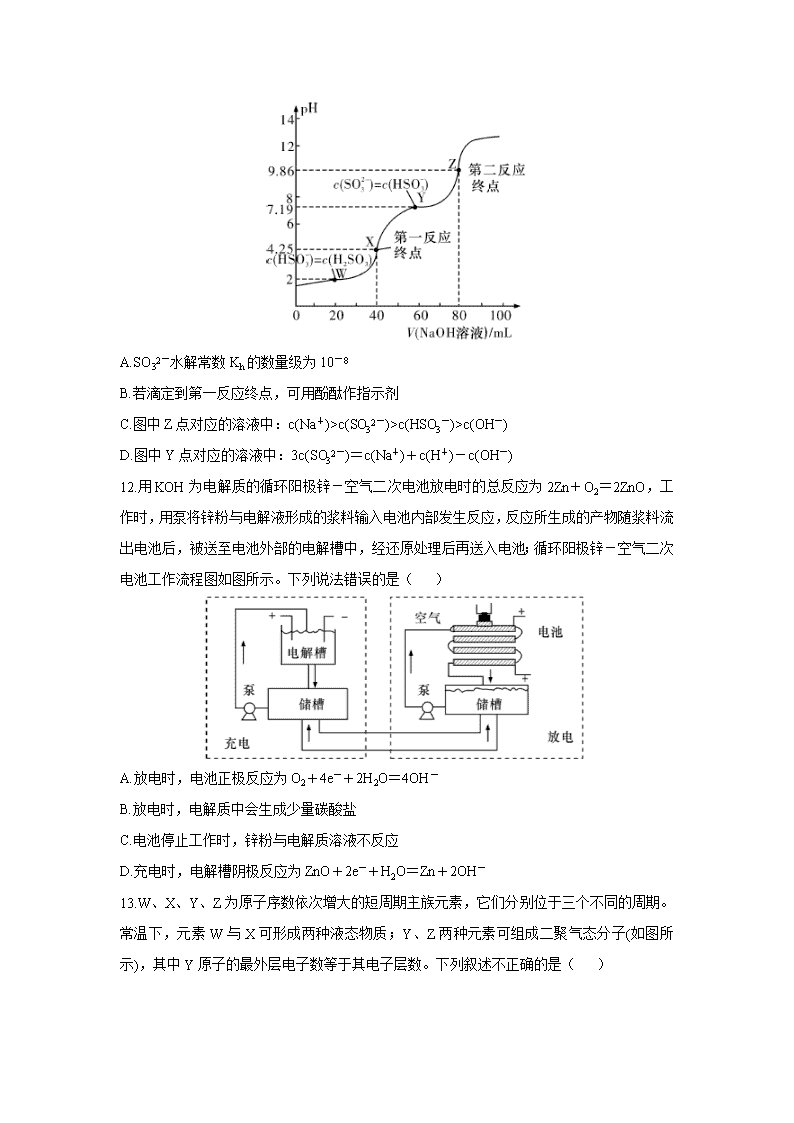
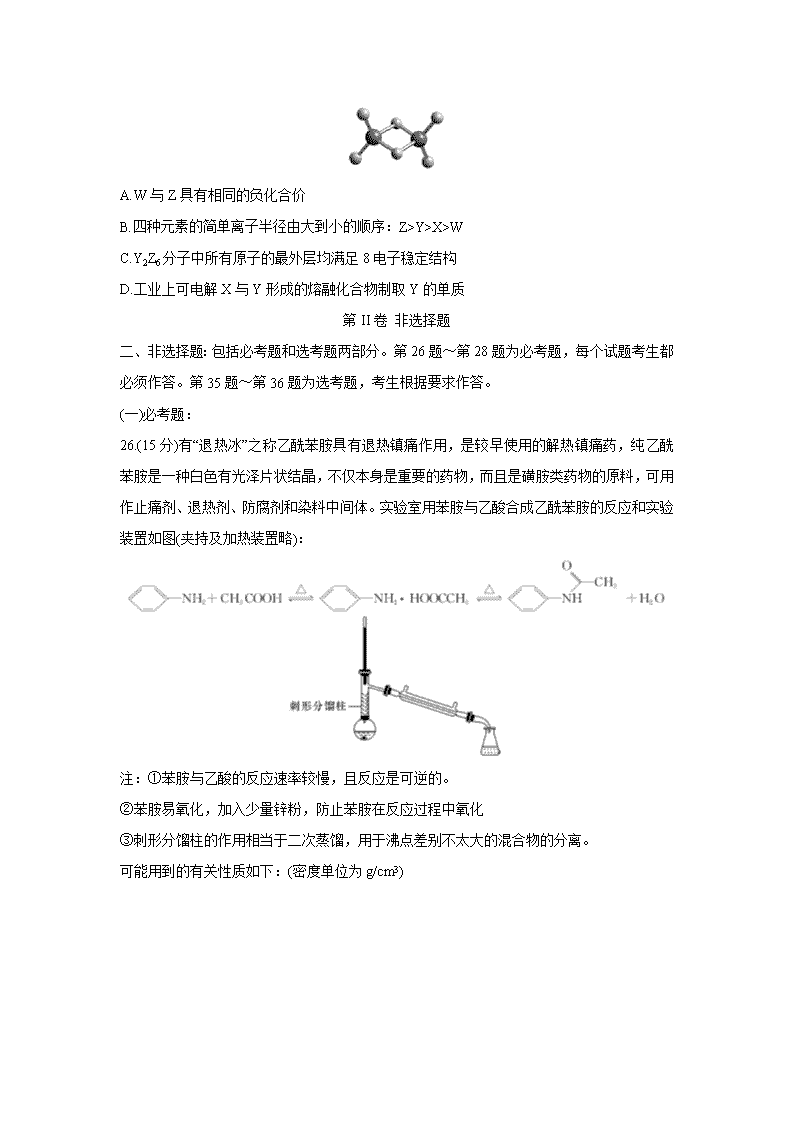
河南省名校(南阳一中、信阳、漯河、平顶山一中四校)2020届高三3月线上联合考试 可能用到的相对原子质量:H~1 C~12 O~16 A1~27 Si~28 Ca~40 Fe~56 第I卷 选择题 一、选择题:本大题共7小题,每小题6分。在每小题给出的四个选项中,只有一项是符合题目要求的。 7.化学与生活密切相关。下列有关玻璃的叙述正确的是( ) A.含溴化银的变色玻璃,变色原因与太阳光的强度和生成银的多少有关 B.玻璃化学性质稳定,具有耐酸碱侵蚀、抗氧化等优点 C.钢化玻璃、石英玻璃及有机玻璃都属于无机非金属材料 D.普通玻璃的主要成分可表示为Na2O·CaO·6SiO2,说明玻璃为纯净物 8.关于化合物2-苯基丙烯酸乙酯(),下列说法正确的是( ) A.不能使稀酸性高锰酸钾溶液褪色 B.可以与稀硫酸或NaOH溶液反应 C.分子中所有原子共平面 D.易溶于饱和碳酸钠溶液 9.下列实验不能达到目的的是( ) 10.NA代表阿伏加德罗常数的值。下列说法正确的是( ) A.含1 mol/L Cl-的NH4Cl与氨水的中性混合溶液中,NH4+数为NA B.60 g SiO2和28 g Si中各含有4NA个Si-O键和4NA个Si-Si键 C.标准状况下,浓盐酸分别与MnO2、KClO3反应制备22.4 L Cl2,转移的电子数均为2NA D.10 g 46%甲酸(HCOOH)水溶液所含的氧原子数为0.5NA 11.常温下,用0.1 mol·L-1 NaOH溶液滴定40 mL 0.1 mol·L-1 H2SO3溶液,所得滴定曲线如图所示(忽略混合时溶液体积的变化)。下列叙述正确的是( ) A.SO32-水解常数Kh的数量级为10-8 B.若滴定到第一反应终点,可用酚酞作指示剂 C.图中Z点对应的溶液中:c(Na+)>c(SO32-)>c(HSO3-)>c(OH-) D.图中Y点对应的溶液中:3c(SO32-)=c(Na+)+c(H+)-c(OH-) 12.用KOH为电解质的循环阳极锌-空气二次电池放电时的总反应为2Zn+O2=2ZnO,工作时,用泵将锌粉与电解液形成的浆料输入电池内部发生反应,反应所生成的产物随浆料流出电池后,被送至电池外部的电解槽中,经还原处理后再送入电池;循环阳极锌-空气二次电池工作流程图如图所示。下列说法错误的是( ) A.放电时,电池正极反应为O2+4e-+2H2O=4OH- B.放电时,电解质中会生成少量碳酸盐 C.电池停止工作时,锌粉与电解质溶液不反应 D.充电时,电解槽阴极反应为ZnO+2e-+H2O=Zn+2OH- 13.W、X、Y、Z为原子序数依次增大的短周期主族元素,它们分别位于三个不同的周期。常温下,元素W与X可形成两种液态物质;Y、Z两种元素可组成二聚气态分子(如图所示),其中Y原子的最外层电子数等于其电子层数。下列叙述不正确的是( ) A.W与Z具有相同的负化合价 B.四种元素的简单离子半径由大到小的顺序:Z>Y>X>W C.Y2Z6分子中所有原子的最外层均满足8电子稳定结构 D.工业上可电解X与Y形成的熔融化合物制取Y的单质 第II卷 非选择题 二、非选择题:包括必考题和选考题两部分。第26题~第28题为必考题,每个试题考生都必须作答。第35题~第36题为选考题,考生根据要求作答。 (一)必考题: 26.(15分)有“退热冰”之称乙酰苯胺具有退热镇痛作用,是较早使用的解热镇痛药,纯乙酰苯胺是一种白色有光泽片状结晶,不仅本身是重要的药物,而且是磺胺类药物的原料,可用作止痛剂、退热剂、防腐剂和染料中间体。实验室用苯胺与乙酸合成乙酰苯胺的反应和实验装置如图(夹持及加热装置略): 注:①苯胺与乙酸的反应速率较慢,且反应是可逆的。 ②苯胺易氧化,加入少量锌粉,防止苯胺在反应过程中氧化 ③刺形分馏柱的作用相当于二次蒸馏,用于沸点差别不太大的混合物的分离。 可能用到的有关性质如下:(密度单位为g/cm3) 合成步骤: 在50 mL圆底烧瓶中加入10 mL新蒸馏过的苯胺和15 mL冰乙酸(过量)及少许锌粉(约0.1g)。用刺形分馏柱组装好分馏装置,小火加热10 min后再升高加热温度,使蒸气温度在一定范围内浮动1小时。在搅拌下趁热快速将反应物以细流倒入100 mL冷水中冷却。待乙酰苯胺晶体完全析出时,用布氏漏斗抽气过滤,洗涤,以除去残留酸液,抽干,即得粗乙酰苯胺。 分离提纯: 将粗乙酰苯胺溶于300 mL热水中,加热至沸腾。放置数分钟后,加入约0.5g粉未状活性炭,用玻璃棒搅拌并煮沸10min,然后进行热过滤,结晶,抽滤,晾干,称量并计算产率。 (1)由于冰醋酸具有强烈刺激性,实验中要在 内取用,加入过量冰乙酸的目的是 。 (2)反应开始时要小火加热10min是为了 。 (3)实验中使用刺形分馏柱能较好地提高乙酰苯胺产率,试从化学平衡的角度分析其原因: 。 (4)反应中加热方式可采用 (填“水浴”“油浴”或“直接加热”),蒸气温度的最佳范围是 (填字母代号)。 a.100~105℃ b.117.9~184℃ c.280~290℃ (5)判断反应基本完全的现象是 ,洗涤乙酰苯胺粗品最合适的试剂是 (填字母代号)。 a.用少量热水洗 b.用少量冷水洗 c.先用冷水洗,再用热水洗 d.用酒精洗 (6)分离提纯乙酰苯胺时,在加入活性炭脱色前需放置数分钟,使热溶液稍冷却,其目的是 ,若加入过多的活性炭,使乙酰苯胺的产率 (填“偏大”“偏小”或“无影响”)。 (7)该实验最终得到纯品7.36g,则乙酰苯胺的产率是 %(结果保留一位小数)。 27.(14分)铝酸钙(mCaO·nAl2O3)是一系列由氧化钙和氧化铝在高温下烧结而成的无机化合物,被应用于水泥和灭火材料中,工业上用石灰石(主要成分为CaCO3和MgCO3)和铝土矿(主要成分是Al2O3、Fe2O3、SiO2等)制备铝酸钙的流程如下: 回答下列问题: (1)固体B的主要成分是 (填化学式);一系列操作包括过滤、洗涤、干燥,洗涤过程应如何操作? 。 (2)向滤液中通入CO2和NH3的顺序为 ,其理由是 。 (3)溶液D转化为Al(OH)3的离子方程式是 。 (4)常温下,用适量的NH4Cl溶液浸取煅粉后,若要保持滤液中c(Mg2+)小于5×10-6 mol·L-1,则溶液的pH应大于 [已知:Mg(OH)2的Ksp=5×10-12]。 (5)假设上述过程每一步均完全反应,最终得到的铝酸钙(3CaO·7Al2O3)的质量刚好等于原铝土矿的质量,该铝土矿中Al的质量分数为 (计算结果保留三位有效数字)。 28.(14分)利用太阳能、风能、生物质能等可再生能源,转化利用二氧化碳设计出适合高效清洁的合成燃料分子结构,实现CO2+H2O→CxHy的分子转化,生产合成甲烷、醇醚燃料、烷烃柴油、航空燃油等可再生合成燃料。因此二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。 (1)一定条件下,在CO2与足量碳反应所得平衡体系中加入H2和适当催化剂,有下列反应发生: CO(g)+3H2(g)CH4(g)+H2O(g) △H1=-206.2 kJ·mol-1 CO(g)+H2O(g)CO2(g)+H2(g) △H2 若CO2氧化H2生成0.1 mol CH4(g)和一定量的H2O(g),整个过程中放出的热量为16.5kJ,则△H2= 。 (2)合成二甲醚的总反应为2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g) △H=-122.4 kJ·mol -1。某温度下,将2.0 mol CO2(g)和6.0 mol H2(g)充入容积为2L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如图所示,则p1 (填“>”“<”或“一”,下同)p2。若T3、p3,T4、p4时平衡常数分别为K3、K4,则K3 K4,T1、p1时H2的平衡转化率为 (结果保留三位有效数字)。 (3)向2L密闭容器中加入2 mol CO2和6 mol H2,在适当的催化剂作用下,下列反应能自发进行:CO2(g)+3H2(g)CH3OH(g)+H2O(g)。 ①该反应△H (填“>”“<”或“=”)0。 ②下列叙述能说明此反应达到平衡状态的是 (填字母代号)。 a.混合气体的平均相对分子质量保持不变 b.1 mol CO2生成的同时有3 mol H-H键断裂 c.CO2的转化率和H2的转化率相等 d.混合气体的密度保持不变 ③上述反应常用CuO和ZnO的混合物作催化剂。相同的温度和时间段内,催化剂中CuO的质量分数对CO2的转化率和CH3OH的产率影响的实验数据如下表所示: 由表可知,CuO的质量分数为 催化效果最佳。 (4)CO2可用于工业制备草酸锌,其原理如图所示(电解液不参加反应),Zn电极是 极。已知在Pb电极区得到ZnC2O4,则Pb电极上的电极反应式为 。 (二)选考题: 35.【化学——选修3:物质结构与性质】(15分) 2019年10月9日消息,诺贝尔化学奖颁给约翰·B·古迪纳夫、M·斯坦利·威廷汉和吉野彰,以表彰他们“开发锂离子电池”的贡献。磷酸亚铁锂(化学式:LiFePO4)是锂离子电池电极材料,主要用于动力锂离子电池,作为正极活性物质使用,人们习惯也称其为磷酸铁锂。 (1)基态锂原子核外能量最高的电子电子云轮廓图形状为 ;基态磷原子第一电离能比基态硫的 (填“大”或“小”),原因是 。 (2)实验室中可用KSCN或K4[Fe(CN)6]来检验Fe3+。FeCl3与KSCN溶液混合,可得到配位数为5的配合物的化学式是 ,其中硫、碳的杂化类型分别是 、 。 (3)磷酸和亚磷酸(H3PO3)是磷元素的两种含氧酸。PO43-的空间构型为 ;亚磷酸与NaOH反应只生成Na2HPO3和NaH2PO3两种盐,则H3PO3的结构式为 。 (4)磷酸分子间脱水可生成多磷酸,其某一钙盐的结构如下图所示: 由图推知该多磷酸钙盐的通式为 。 (5)氧化亚铁晶体的晶胞如图所示。已知:氧化亚铁晶体的密度为ρ g·cm-3,NA代表阿伏加德罗常数的值。在该晶胞中,与O2-紧邻且等距离的Fe2+数目为 ,Fe2+与O2-最短核间距为 pm。 36.【化学——选修5:有机化学基础】(15分) 一种药物中间体(G)的一种合成路线如下: 请回答下列问题: (1)R的名称是 ;R中官能团名称是 。 (2)M-→N的反应类型是 。P的结构简式为 。 (3)H分子式是 。 (4)写出Q→H的化学方程式: 。 (5)T是一种与R具有相同官能团的芳香化合物(且组成元素种类相同),T的相对分子质量比R多14。T有 种结构。其中,在核磁共振氢谱上有5组峰且峰的面积比为1:1:2:2:2的结构简式可能有 。 (6)以1,5-戊二醇()和硝基苯为原料(其他无机试剂自选)合成,设计合成路线: 。 【参考答案】查看更多