- 2021-04-26 发布 |
- 37.5 KB |
- 109页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2021版高考化学一轮复习专题2化学变化1氧化还原反应课件苏教版
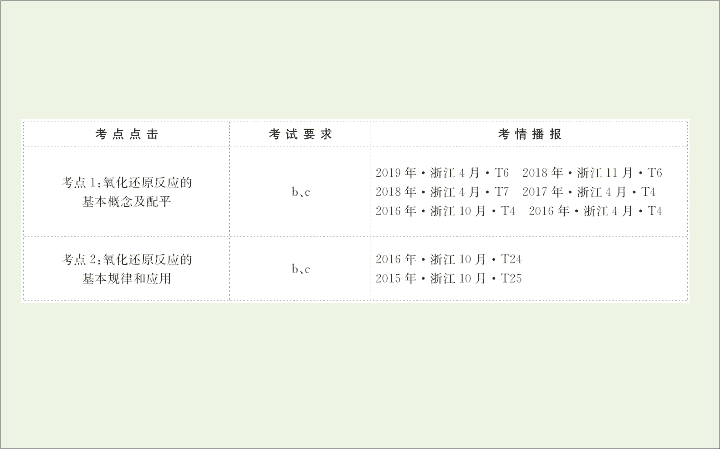
专题 2 化 学 变 化 第一单元 氧化还原反应 考点 1: 氧化还原反应的基本概念及配平 1. 氧化还原反应的本质和特征 (b) 2. 氧化还原反应关系图 (b) 例如 , 反应 MnO 2 +4HCl( 浓 ) MnCl 2 +Cl 2 ↑+2H 2 O 中 , 氧化 剂是 ____, 还原剂是 ____, 氧化产物是 ___ 。 MnO 2 HCl Cl 2 3. 氧化还原反应中电子转移的表示方法 (c) (1) 双线桥法。 小结 : 双线桥 ,“ 谁”变“谁” ( 还原剂变成氧化产物 , 氧化剂变成还原产物 ) 例如 , 用双线桥表示铜与浓硝酸反应的电子转移情况 : ______________________________ (2) 单线桥法。 小结 : 单线桥 ,“ 谁”给“谁” ( 还原剂将电子转移给氧化剂 ) 例如 , 用单线桥表示铜与浓硝酸反应的电子转移情况 : ____________________________________________ 4. 氧化还原反应与四种基本反应类型间的关系 (b) 5. 常见的氧化剂与还原剂 (1) 常见氧化剂 :① 活泼的非金属单质 , 如 X 2 (X 指卤素单 质 Cl 、 Br) 、 O 2 、 O 3 等 ;② 高价态的离子 , 如 H + 、 Cu 2+ 、 Fe 3+ 、 Hg 2+ 、 Ag + 等 ;③ 高价态的物质 , 如 H 2 SO 4 ( 浓 ) 、 HClO 4 、 HNO 3 、 PbO 2 、 MnO 2 、 KClO 3 、 KMnO 4 等 ;④ 含 的 物质 , 如 H 2 O 2 、 Na 2 O 2 等。 (2) 常见还原剂 :① 金属单质 , 如 Na 、 Mg 、 Al 、 Fe 、 Cu 等 ;② 非金属单质 , 如 H 2 、 C 、 S 等 ;③ 低价态离子 , 如 S 2- 、 I - 、 Fe 2+ 、 Br - 等 ;④ 含较低价态元素的物质 , 如 CO 、 NH 3 、 H 2 S 、 HI 、 SO 2 、 H 2 SO 3 、 Na 2 SO 3 、 NO 等。 (3) 化合价与氧化性、还原性的关系 : 规律 : 高价氧化 , 低价还原 , 中间价态两边转 6. 氧化还原反应方程式配平的一般步骤 (c) 标价态、找变化、求总数、配系数、查守恒。即 : (1) 标出变价元素化合价的始态和终态 ; (2) 求升高总数与降低总数的最小公倍数 ; (3) 调整化合价变化的原子的化学计量数 ; (4) 用观察法配平其他物质的化学计量数 ; (5) 检查配平后的方程式是否符合质量守恒定律 , 离子方程式还要看是否符合电荷守恒。 【 典例精析 】 【 典例 1】 (2019· 浙江 4 月选考 ) 反应 8NH 3 +3Cl 2 ==== N 2 +6NH 4 Cl, 被氧化的 NH 3 与被还原的 Cl 2 的物质的量之比为 ( ) A.2∶3 B.8∶3 C.6∶3 D.3∶2 【 解题思路 】 本题的解题关键有 : (1) 会根据定义判断氧化还原反应中的相关物质及其变化。 (2) 能用双线桥表示出氧化还原反应中电子的得失。 【 解析 】 选 A 。该氧化还原反应用双线桥表示为 , 可知实际升价的氮原子 为 2 mol, 所以 2 mol NH 3 被氧化 , 同时 Cl 2 全部被还原 , 观 察化学计量数 ,Cl 2 为 3 mol, 因而被氧化的 NH 3 与被还原 的 Cl 2 的物质的量之比为 2∶3 。 【 典例 2】 (1) 请将下列五种物质 :KBr 、 Br 2 、 I 2 、 KI 、 K 2 SO 4 分别填入下列横线上 , 组成一个未配平的化学方程 式 : KBrO 3 +____+H 2 SO 4 ____+____+____+____+H 2 O 。 (2) 如果该化学方程式中 I 2 和 KBr 的化学计量数分别是 8 和 1, 则 : ①Br 2 的化学计量数是 ________; ② 请将反应物的化学式及配平后的化学计量数填入下列相应的位置中 : ③ 若转移 10 mol 电子 , 则反应后生成 I 2 的物质的量为 ________ 。 【 解题思路 】 本题的解题关键 : 熟练掌握氧化还原反应的化合价升降守恒规律。 首先 , 氧化还原反应里存在着电子的转移 , 因此元素的化合价必然有升有降 , 我们将发生化合价变化的元素 , 标出其准确化合价 ; 其次 , 依据还原剂失电子总数 = 氧化剂得电子总数 , 即还原剂 ( 元素 ) 化合价升高的总价数 = 氧化剂 ( 元素 ) 化合价降低的总价数。化合价变化的元素先配平 ; 再次 , 观察反应过程中化合价未变化的部分 , 配上系数。 【 解析 】 (1) 根据溴元素反应后化合价降低可知 , 还需填 入还原剂 KI 作反应物 , 其他物质 I 2 、 Br 2 、 K 2 SO 4 、 KBr 为生 成物 , 该反应为 KBrO 3 +KI+H 2 SO 4 I 2 +Br 2 +K 2 SO 4 +KBr+ H 2 O 。 (2)① 如果 I 2 的化学计量数是 8,KBr 的化学计量数 是 1, 则根据碘元素化合价变化知共失电子 16 mol,KBr 的 化学计量数是 1, 得电子为 6 mol, 则 KBrO 3 →Br 2 共得电子 10 mol, 即 Br 2 的化学计量数为 1;② 碘元素的化合价由 -1 价升高为 0, 溴元素的化合价由 +5 价降低为 0 、 -1 价 , 由电 子及原子守恒可知反应为 3KBrO 3 +16KI+9H 2 SO 4 ====8I 2 +Br 2 +9K 2 SO 4 +KBr+9H 2 O;③ 反应中 KI→I 2 , 碘元素化合价由 -1 价升高为 0 价 , 氧化产物只有 I 2 , 故转移 10 mol 电子生 成 I 2 的物质的量为 mol=5 mol 。 答案 : (1)KI I 2 Br 2 K 2 SO 4 KBr( 后四种产物顺序可变 ) (2)①1 ② 3 16 KI 9 ③ 5 mol 【 强化训练 】 1. 判断下列叙述的正误 ( 正确的打“√” , 错误的打“ ×”) (1) 有单质参加或有单质生成的化学反应一定是氧化还原反应。 ( ) 提示 : × 。同素异形体之间的转化不是氧化还原反应 , 如 3O 2 ====2O 3 。 (2) 金属阳离子一定只具有氧化性。 ( ) 提示 : × 。 Fe 2+ 既具有氧化性又具有还原性。 (3) 氧化还原反应中有一种元素被氧化时 , 一定有另一种元素被还原。 ( ) 提示 : × 。发生氧化反应和还原反应的可能是同一种元素 , 如 Cl 2 +H 2 O====HClO+HCl 。 (4) 氧化还原反应中的反应物 , 不是氧化剂就是还原剂。 ( ) 提示 : × 。有些反应物既不是氧化剂也不是还原剂 , 如 Cl 2 +H 2 O====HClO+HCl 中的 H 2 O 。 (5) 某元素从游离态变为化合态 , 该元素可能被氧化也可能被还原。 ( ) 提示 : √ 。元素从游离态变为化合态 , 化合价可能升高 , 也可能降低 , 如 Fe+Cu 2+ ====Fe 2+ +Cu 、 Cl 2 +2Br - ====2Cl - +Br 2 。 (6) 由水参与反应制取 1 mol H 2 , 转移电子数必定是 2 N A 。 ( ) 提示 : × 。如 NaH+H 2 O====NaOH+ H 2 ↑, 该反应制取 1 mol H 2 转移 1 mol e - 。 2. 下列实验现象与氧化还原反应有关的是 ( ) A. 碳酸钠中加入 CaCl 2 溶液产生白色沉淀物 B. 硫酸铜溶液中插入铁片 , 铁片上出现红色沉淀物 C. 石灰石溶于盐酸并产生气泡 D. 滴加酚酞试剂的氢氧化钾溶液 , 向其中滴加稀硫酸 , 红色褪去 【 解析 】 选 B 。 A 、 B 、 C 、 D 四项发生反应分别为 A 项 :Na 2 CO 3 +CaCl 2 ====CaCO 3 ↓+2NaCl B 项 :CuSO 4 +Fe====FeSO 4 +Cu C 项 :CaCO 3 +2HCl====CaCl 2 +CO 2 ↑+H 2 O D 项 :2KOH+H 2 SO 4 ==== 2 SO 4 +2H 2 O 通过分析元素化合价升降结果可知 A 、 C 、 D 项中均无元素化合价发生变化 ,B 项中有元素化合价发生变化 , 属于氧化还原反应。 3. 已知在下列反应中 , 产物 K 2 SO 4 和 S 的物质的量之比为 3∶2 。 ____KMnO 4 +____K 2 S+______ ====____K 2 MnO 4 +____K 2 SO 4 +________S↓+____ 下列说法不正确的是 ( ) A. 高锰酸根离子的还原产物受溶液酸碱性的影响 B. 化学方程式中反应物缺项为 H 2 SO 4 , 配平后系数为 12 C. 化学方程式中产物缺项为 H 2 O, 配平后系数为 12 D. 用石墨电极电解中性高锰酸钾溶液 , 在阴极可以得到 MnO 2 【 解析 】 选 B 。审题时要注意高锰酸钾在不同条件下被 还原的产物不同。在酸性溶液中生成 Mn 2+ , 在中性溶液 中生成 MnO 2 , 在碱性溶液中生成 ,A 正确。根据产物 K 2 MnO 4 知 , 反应在碱性条件下进行 , 故反应物缺项不可能 是 H 2 SO 4 ,B 不正确。反应物缺项为 KOH, 产物缺项为 H 2 O, 方 程式配平得 :28KMnO 4 +5K 2 S+24KOH====28K 2 MnO 4 +3K 2 SO 4 +2S↓+12H 2 O,C 、 D 正确。 4. 某反应中反应物与生成物有 AsH 3 、 H 2 SO 4 、 KBrO 3 、 K 2 SO 4 、 H 3 AsO 4 和一种未知物 X 。已知 0.2 mol KBrO 3 在反应中得到 1 mol e - 生成 X, 则 X 的化学式为 ___________, 试写出该反应的化学方程式 _________________ 。 【 解析 】 根据电子守恒得 0.2×(5- x )=1, x =0, 所以 KBrO 3 被还原成 Br 2 。在该氧化还原反应中 ,KBrO 3 是氧化剂 , 其还原产物为 Br 2 ,AsH 3 为还原剂 , 其氧化产物为 H 3 AsO 4 , H 2 SO 4 作为反应物提供酸性环境 , 根据化合价升降相等即可配平。 答案 : Br 2 4H 2 SO 4 +5AsH 3 +8KBrO 3 ====5H 3 AsO 4 +4Br 2 +4K 2 SO 4 +4H 2 O 5.(1) 用浓盐酸来制取氯气的化学方程式如下 :2KMnO 4 + 16HCl====2KCl+2MnCl 2 +5Cl 2 ↑+8H 2 O, 其中被还原的元素是 ________, 被氧化的元素是 ________, 氧化剂是 __________, 还原剂是 ________, 氧化产物是 ________, 还原产物是 ________, 氧化剂与还原剂的物质的量之比为 ________, 假如有 2.5 mol Cl 2 生成 , 则该反应中电子转移的物质的量为 ________ 。 (2) 在反应 3Cu+8HNO 3 ====3Cu(NO 3 ) 2 +2NO↑+4H 2 O 中 , 氧化剂是 ________, 氧化产物是 ________, 氧化剂和还原剂的物质的量之比是 ________, 每生成 2 mol NO 转移的电子数为 ________ 。 (3) 氧化还原反应 3S+6KOH====2K 2 S+K 2 SO 3 +3H 2 O 中 , 氧化剂与还原剂的物质的量之比为 ________, 若反应中消耗了 0.6 mol S, 则反应中转移的电子为 ______mol 。 【 解析 】 (1) 反应中锰元素化合价降低 ,KMnO 4 是氧化剂 , 锰元素被还原 ,MnCl 2 是还原产物 ; 氯元素化合价升高 ,HCl 是还原剂 ,Cl 2 是氧化产物 ,HCl 作还原剂和酸性作用 , 氧化剂与还原剂的物质的量之比为 1∶5 。每生成 1 mol 氯气转移电子为 2 mol, 所以有 2.5 mol Cl 2 生成 , 则该反应中电子转移的物质的量为 5 mol 。 (2) 反应中 , 铜元素的化合价升高作还原剂 ,Cu(NO 3 ) 2 是氧化产物 , 氮元素的化合价降低 ,HNO 3 一部分作氧化剂 , 则氧化剂与还原剂的物质的量之比为 2 ∶ 3, 反应中每生成 2 mol NO 转移 6 mol 电子 , 即转移的电子数为 6 N A 。 (3) 反应中 , 硫元素的化合价既升高又降低 , 可通过双线 桥分析此反应 : , 根据还 原产物与氧化产物的化学计量数可知 , 氧化剂和还原剂 的物质的量之比为 2 ∶ 1, 若反应中消耗了 0.6 mol S, 则 有 0.4 mol S 被还原生成 K 2 S, 转移 0.8 mol 电子。 答案 : (1)Mn Cl KMnO 4 HCl Cl 2 MnCl 2 1 ∶ 5 5 mol (2)HNO 3 Cu(NO 3 ) 2 2 ∶ 3 6 N A (3)2 ∶ 1 0.8 【 加固训练 】 1. 氯酸是一种强酸 , 浓度超过 40% 时会发生分解 , 反应可表示为 a HClO 3 ==== b O 2 ↑+ c Cl 2 ↑+ d HClO 4 + e H 2 O, 下列有关说法错误的是 ( ) A. 由反应可确定 : 氧化性 HClO 3 >O 2 B. 由非金属性 Cl>S, 可推知酸性 HClO 3 >H 2 SO 4 C. 若 1 mol 氯酸分解所得混合气体的质量为 45 g, 则反应方程式可表示为 3HClO 3 ====2O 2 ↑+Cl 2 ↑+HClO 4 +H 2 O D. 若化学计量数 a =8, b =3, 则该反应转移电子数为 20e - 【 解析 】 选 B 。 HClO 3 能将 -2 价的 O 氧化成 O 2 , 说明 HClO 3 的 氧化性大于 O 2 ,A 项正确 ; HClO 3 不是最高价含氧酸 , 不能 与硫酸比较酸性的强弱 ,B 项错误 ; 混合气体的平均相对 分子质量为 45, 据十字交叉法可计算 n (O 2 )∶ n (Cl 2 )= =2∶1,C 项正确 ; 由已知计量数可知 , d +2 e =8,4 d + e =24-6=18,2 c + d =8, 解得 d =4, e =2, c =2, 由此得出反应的 方程式为 8HClO 3 ====3O 2 ↑+2Cl 2 ↑+4HClO 4 +2H 2 O, 只有生成 Cl 2 得电子 , 故转移电子数为 2×2×5e - =20e - ,D 项正确。 2. 铬及其化合物常被应用于冶金、化工、电镀、制药等行业 , 但使用后的废水因其中含高价铬的化合物而毒性很强 , 必须进行处理。工业上往往采取下列循环工艺防止铬的污染 : (1) 上述各步反应中属于氧化还原反应的是 ________ ( 填序号 ) 。 (2) 第①步 , 含 的废水在酸性条件下用绿矾 (FeSO 4 ·7H 2 O) 处理 , 写出并配平反应的离子方程式 : __________________ 。 【 解析 】 (1) ① 中铬元素由 +6 价降至 +3 价 , ④ 中铬元素由 +3 价升至 +6 价。 (2) 亚铁离子具有还原性 , 与重铬酸根离子反应生成铬离 子和铁离子。 答案 : (1) ①④ (2) +6Fe 2+ +14H + ====2Cr 3+ +6Fe 3+ +7H 2 O 【 归纳总结 】 氧化还原反应配平的特殊技巧 (1) 从右向左配平法 适用范围 : 此法最适用于某些物质 ( 如硝酸、浓硫酸的反应 ) 部分参加氧化还原反应的类型。 例如 :Cu+HNO 3 ( 浓 )→Cu(NO 3 ) 2 +NO 2 +H 2 O (2) 整体总价法 ( 零价法 ) 适用范围 : 在氧化还原反应中 , 一种反应物中有两种或两种以上的元素化合价发生变化 , 或几种不同物质中的元素化合价经变化后同存在于一种产物中 , 把该物质当成一个“整体”来考虑 , 可令该物质中各元素的化合价均为零 , 然后计算出各元素化合价的升降值 , 利用化合价升降相等进行配平。 例如 :FeS 2 + O 2 →Fe 2 O 3 + SO 2 (3) 歧化归一法 适用范围 : 同种元素之间的歧化反应或归一反应。第三 种价态元素之前的系数等于另两种元素价态的差值与该 价态原子数目的比值。 例如 :Cl 2 +KOH→KCl+KClO 3 +H 2 O 该反应中 , 电子转移只发生在氯元素之间 , 属于歧化反 应。 Cl 的化合价由 0 变为 -1 和 +5, 因此 Cl 2 的系数为 =3,KCl 的系数为 5,KClO 3 的系数为 1 。 (4) 缺项配平法 缺项化学方程式是指某些反应物或生成物的分子式没有写出来 , 一般为水、酸或碱。 ①方法。 先用“化合价升降法”配平含有变价元素的物质的化学计量数 , 然后由原子守恒确定未知物 , 再根据原子守恒进行配平。 ② 补项原则。 条 件 补 项 原 则 酸性条件下 缺 H( 氢 ) 或多 O( 氧 ) 补 H + , 少 O ( 氧 ) 补 H 2 O( 水 ) 碱性条件下 缺 H( 氢 ) 或多 O( 氧 ) 补 H 2 O( 水 ), 少 O ( 氧 ) 补 OH - 考点 2: 氧化还原反应的基本规律和应用 1. 电子守恒规律 (b) 氧化剂得电子总数 = 还原剂失电子总数 电子守恒规律常用于氧化还原反应方程式的配平及计算。 如湿法制备高铁酸钾 (K 2 FeO 4 ) 的反应体系中有六种微粒 :Fe(OH) 3 、 ClO - 、 OH - 、 、 Cl - 、 H 2 O, 根据元素的 化合价变化可知 ,___ 元素的化合价升高 , 失去 ____ 电子 , 而 ___ 元素的化合价降低 , 得到 ____ 电子 , 所以根据电子 的得失守恒 , 并结合电荷守恒和质量守恒 , 反应的方程式 是 ______________________________________ 。 铁 3 个 氯 2 个 2Fe(OH) 3 +3ClO - +4OH - ==== +3Cl - +5H 2 O 2. 价态规律 (b) 元素处于最高价 , 只有 _______, 如 Fe 3+ 、 Ag + 等 ; 元素处于 最低价 , 只有 _______, 如 S 2- 、 I - 等 ; 元素处于中间价态 , 既有氧化性又有还原性 , 如 Fe 2+ 、 Cl 2 等。物质含有多种 元素时 , 性质是这些元素性质的综合体现 , 如 HCl,H + 可体 现 _______,Cl - 可体现 _______ 。 氧化性 还原性 氧化性 还原性 (1) 归中规律 : 同种元素的高价态和低价态向中间价态靠拢 , 只靠近不 交叉。如反应 H 2 S+H 2 SO 4 ( 浓 )====S↓+SO 2 ↑+2H 2 O,1 mol H 2 S 反应时转移电子数为 ___ 。 2 N A (2) 歧化规律 : 某些元素中间价态在适宜条件下 , 可同时生成较高价态和 较低价态。如 Cl 2 +2NaOH====NaCl+NaClO+H 2 O,1 mol Cl 2 反应时转移电子数为 __ 。 (3) 同种元素相邻价态不反应 , 如 SO 2 和浓硫酸 _______, 可 用浓硫酸干燥 SO 2 气体。 N A 不反应 3. 强弱规律 (c) (1) 同一氧化还原反应中 , 氧化性 : 氧化剂 > 氧化产物 , 还 原性 : 还原剂 > 还原产物。如 Cl 2 +S 2- ====S↓+2Cl - , 氧化 性 ___>__, 还原性 ___>___ 。 Cl 2 S S 2- Cl - (2) 金属还原性越强 , 相应离子氧化能力越弱 : 非金属氧化性越强 , 相应离子还原性越弱 : 氧化性 Cl 2 >Br 2 >I 2 , 离子还原性 __________ 。 Cl -> Cl 2 与 H 2 光照剧烈反应并爆炸 ,Br 2 与 H 2 加热到 500 ℃ 才能 发生反应 ,I 2 与 H 2 在不断加热的条件下才缓慢发生反应 , 且为可逆反应 , 故氧化性 :F 2 __Cl 2 __Br 2 __I 2 。 > > > ② 当不同的氧化剂作用于同一还原剂时 , 如果氧化产物 价态相同 , 可根据反应条件的高低进行判断 : 一般条件 越低 , 氧化剂的氧化性 _____, 如 MnO 2 +4HCl( 浓 ) MnCl 2 +Cl 2 ↑+2H 2 O,2KMnO 4 +16HCl( 浓 )====2KCl+2MnCl 2 + 5Cl 2 ↑+8H 2 O, 由上述反应条件的不同 , 可判断氧化性 :KMnO 4 __MnO 2 。 越强 > 当不同氧化剂作用于同一还原剂时 , 如果氧化产物价态 不相同 , 可根据氧化产物的价态高低进行判断 : 氧化产物 的价态越高 , 则氧化剂的氧化性 _____, 如 2Fe+3Cl 2 2FeCl 3 ,Fe+S FeS, 则氧化性 :Cl 2 __S 。 越强 > 4. 先后规律 (b) 一种氧化剂总是优先氧化还原性更强的粒子 , 一种还原 剂总是优先还原氧化性更强的粒子。如还原性 :Cl -
I - 。向含 a mol KI 和 a mol K 2 SO 3 的混合液中通入 b mol Cl 2 充分反应 ( 不考虑 Cl 2 与 I 2 之间的反应 ) 。下 列说法不正确的是 世纪金榜导学号 ( ) A. 当 a ≥ b 时 , 发生的离子反应为 +Cl 2 +H 2 O==== +2H + +2Cl - B. 当 5 a =4 b 时 , 发生的离子反应为 4 +2I - +5Cl 2 +4H 2 O ====4 +I 2 +8H + +10Cl - C. 当 a ≤ b ≤ a 时 , 反应中转移电子的物质的量 n (e - ) 为 a mol≤ n (e - )≤3 a mol D. 当 a < b < a 时 , 溶液中 、 I - 与 Cl - 的物质的量之比 为 a ∶(3 a -2 b )∶2 b 【 解题思路 】 本题的解题关键 : 熟练掌握氧化还原反应 的规律。 本题出现两种还原剂与同一氧化剂反应 , 强还原剂先反 应 , 即氯气与 优先反应 , 完全转化为 后 , 氯 气与 I - 反应。 【 解析 】 选 C 。因为还原性 : >I - , 所以向含 KI 和 K 2 SO 3 的混合液中通入 Cl 2 时 , 先发生① +Cl 2 +H 2 O==== +2H + +2Cl - , 后发生② 2I - +Cl 2 ====I 2 +2Cl - , 因为 n ( )∶ n (I - )=1∶1, 所以① ×2+② 即得 KI 和 K 2 SO 3 恰好完全被氯 气氧化的总反应方程式③ :2 +2I - +3Cl 2 +2H 2 O==== 2 +I 2 +4H + +6Cl - 。当只发生反应①时 , n (Cl 2 )∶ n ( )= b ∶ a ≤1, 即 a ≥ b , 当 恰好完全反应时 , 转移 的电子的物质的量为 n (e - )= a ×(6-4) mol=2 a mol,A 项 正确。当 5 a =4 b 时 , 即 b = a , 处于 a < b < a 区间内 , 根据 n (Cl 2 )∶ n ( )=5∶4, 可以先写出如下离子方程式 : 4 +□I - +5Cl 2 +□H 2 O====4 +□I 2 +□H + +10Cl - , 根 据氧元素守恒 , 可以判断 H 2 O 的化学计量数为 4, 根据氢元 素守恒 , 可以判断 H + 的化学计量数为 8, 根据电荷守恒 , 可 以判断 I - 的化学计量数为 2, 根据碘元素守恒 , 可以判断 I 2 的化学计量数为 1, 所以该反应的离子方程式为 4 + 2I - +5Cl 2 +4H 2 O====4 +I 2 +8H + +10Cl - ,B 项正确。当恰 好发生反应③时 , n (Cl 2 )∶ n ( )= b ∶ a =3∶2, 即 b = a , 当 和 I - 恰好完全反应时 , 转移的电子的物质的量为 n (e - )= a ×(6-4) mol+ a ×[0-(-1)] mol=3 a mol, 所以当 a ≤ b ≤ a 时 , 反应中转移电子的物质的量 n (e - ) 为 2 a mol≤ n (e - )≤3 a mol,C 项错误 ; 当 a
查看更多