- 2021-04-26 发布 |
- 37.5 KB |
- 10页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
巴蜀中学高考适应性月考卷八理综化学附答案月号
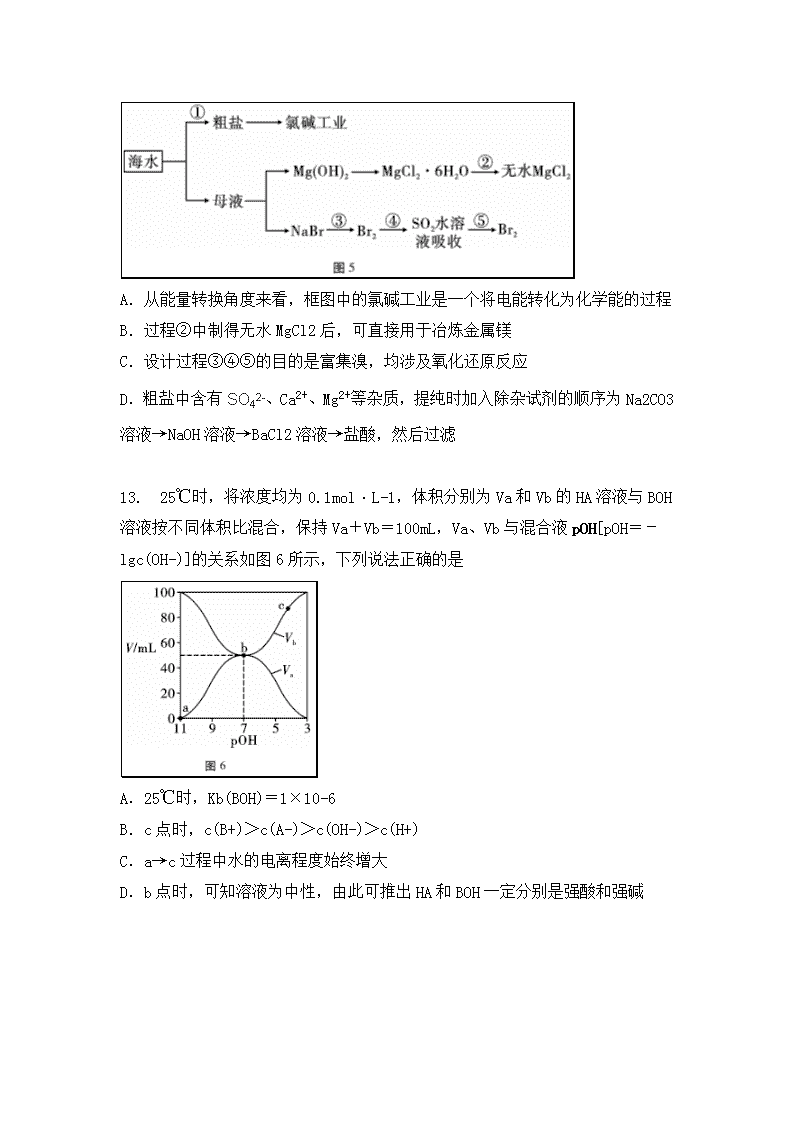
7.人类发展的不同阶段,中国人采用种类极多的材料来作为书写和记录的工具,下列工具的主要成分与其他选项不同的是( ) A.丝帛 B.竹片 C.兽皮 D.兔毛 8.设NA为阿伏加德罗常数。下列有关叙述正确的是 A.100g63%的浓硝酸中含氧原子的个数为3NA B.将1mol Cl2通入水中,HClO、Cl-、ClO-粒子数之和为2NA C.1mol金属Na与1L 0.2mol/L的稀盐酸反应,转移电子数为NA D.铝热反应制备单质铁,得到56gFe,转移电子数为3NA 9.寿山石{X4[Y4Z10](ZW)8}的组成元素均为短周期元素,X是自然界中含量最高的金属元素,X的简单离子与ZW- 含有相同的电子数,Y的单质是制造芯片的基础材料。下列说法正确的是 A.简单氢化物的热稳定性:Y>Z B.最高价氧化物对应水化物的酸性:X>Y C.W、X、Z三种元素可形成一种医用的胃酸中和剂 D.原子半径:Y>X>Z>W 10.如图3所示实验的相关叙述正确的是 A.实验①是对滴定管读数的正确操作和错误操作的总结 B.实验②是除去酸式滴定管中气泡的操作 C.实验③高锰酸钾溶液可以替换为硝酸溶液,替换后,根据后一支装品红溶液的试管褪色,Ca(OH)2中出现浑浊,可以证明有CO2气体 D. 实验④中光照时,可看到试管内壁出现油状液滴,该油状液滴是4种液态氯代产物的混合物 11.以纳米二氧化钛膜为工作电极,常温常压下电解CO2,可制得低密度聚乙烯(LDPE),该反应的机理如图4所示。下列说法正确的是 A.过程Ⅰ~Ⅳ中,Ti(Ⅳ)是酶,为催化剂作用 B.LDPE可以通过乙烯发生自身加成反应制得 C.过程Ⅲ可能未加其他试剂,产物除了∶CH2,还有H2O D.CO2最终转化为LDPE的电极反应式是 12.海洋中有丰富的食品、矿产,能源、药物和水产资源等(如图5所示),下列有关说法不正确的是 A.从能量转换角度来看,框图中的氯碱工业是一个将电能转化为化学能的过程 B.过程②中制得无水MgCl2后,可直接用于冶炼金属镁 C.设计过程③④⑤的目的是富集溴,均涉及氧化还原反应 D.粗盐中含有SO42-、Ca2+、Mg2+等杂质,提纯时加入除杂试剂的顺序为Na2CO3溶液→NaOH溶液→BaCl2溶液→盐酸,然后过滤 13. 25℃时,将浓度均为0.1mol·L-1,体积分别为Va和Vb的HA溶液与BOH溶液按不同体积比混合,保持Va+Vb=100mL,Va、Vb与混合液pOH[pOH=-lgc(OH-)]的关系如图6所示,下列说法正确的是 A.25℃时,Kb(BOH)=1×10-6 B.c点时,c(B+)>c(A-)>c(OH-)>c(H+) C.a→c过程中水的电离程度始终增大 D.b点时,可知溶液为中性,由此可推出HA和BOH一定分别是强酸和强碱 26.(14分)硫酸铅(PbSO4)广泛应用于制造铅蓄电池、白色颜料等。利用某方铅矿(主要成分为PbS)制备硫酸铅粉末的流程如图17: (1)步骤Ⅰ中加快浸取速率的措施有____________________。 (2)步骤Ⅰ中产生黄色沉淀,写出发生的主要反应的离子方程式为___________。 (3)滤液1的主要含铅微粒为__________,为提高其含量,需要在步骤I的产物中加入饱和食盐水,并控制在较高温度进行,试结合平衡移动的原理进行解释:____________________________。 (4)滤液2需经过处理后循环利用于步骤I中,处理的方法是______________。 (5)滤液3 =______________。 (6)铅蓄电池充电时阳极的电极反应式为______________________。某同学用该铅蓄电池作电源电解精炼铜,如果该铅蓄电池内硫酸的体积为2.5L,硫酸的初始浓度为2.5mol/L,当得到32g铜时,硫酸的浓度降至__________mol/L(假设硫酸溶液体积不变)。 27.(14分)二氯化二硫(S2Cl2)在工业上用作橡胶的硫化剂,可由熔融硫和限量氯气直接氯化而成,实验室用如图18所示的装置制备S2Cl2,并测定其纯度。已知S2Cl2是一种金黄色液体,熔点:-76℃,沸点:138℃,S2Cl2遇水剧烈反应。 (1) D中装有硫黄的仪器名称为________,B中所装试剂的名称为______。 (2)通入N2的目的是排尽装置中的空气,防止硫加热时与氧气反应,除去A、B装置中的空气可以在A中反应开始后通过控制K2、K3来去除,具体操作方法是____________________。 (3) D中生成的S2Cl2与过量氯气会反应生成二氯化硫(SCl2),SCl2是一种樱桃红色液体,熔点-122℃,沸点59℃,二者性质很相似,可通过_________方法分离得到S2Cl2。 (4) S2Cl2与水反应只有一种元素的化合价发生了变化,且被氧化和被还原的该元素的物质的量之比为1∶3,请写出该反应的化学方程式:________________________________________________。 (5) 实验后某同学发现,该套装置存在不足,使硫制备 S2Cl2 反应的产率偏低,应如何改进? _______________________________________________。 (6)现欲测定产物中S2Cl2的纯度,设计了如下实验:称取产物12.7g于图19的B中,加入适量稀硫酸,加热,使产生的SO2全部逸出并用C中过量H2O2充分吸收,然后除去过量的H2O2,取其体积的溶液于锥形瓶中,用酚酞作指示剂,用1.000mol·L-1NaOH标准溶液滴定至终点。重复滴定三次,平均消耗NaOH溶液10.00mL。该产物中S2Cl2的质量分数为__________。(已知SCl2与水反应的产物与S2Cl2的相同,保留3位有效数字) 28. (15分)汽车尾气经三元催化剂转化器可将NO和CO转化为无污染气体,请回答下列问题: (1)已知: 碳的燃烧热为ΔH=-393.5kJ·mol-1,一氧化碳的燃烧热为ΔH=-283kJ·mol-1。则NO和CO反应生成无污染性气体的热化学方程式为________________________。 (2)在密闭容器中充入5mol CO和4mol NO,发生反应,如图20所示为平衡时NO的体积分数与温度,压强的关系。 ①温度:T1_______T2(填“<”或“>”),平衡常数:K(A)______K(C) (填“<”“>”或“=”)。 ②某温度下,在体积为2L的密闭容器中,反应进行10分钟放出热量373.25kJ,计算用CO表示的平均反应速率v(CO)为___________________。 ③压强为10MPa、温度为T1下,若反应进行到10min达到平衡状态,容器的体积为8L,该温度下平衡常数Kp=__________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;保留两位有效数字)。 ④若在平衡态D点对反应容器降温,同时缩小容器体积,重新达到的平衡状态可能是图中A~G点中的__________点。 (3)①在一定温度下,向2L密闭容器中充入0.5mol NO、4mol CO,30s反应达平衡,c(CO)与反应时间t的变化曲线Ⅰ如图21甲。若其他条件不变,将0.5mol NO、8mol CO投入8L容器进行反应,请绘出c(CO)与反应时间t的变化曲线Ⅱ。 ②测试某汽车冷启动时的尾气催化处理CO、NO百分含量随时间的变化曲线如图乙。 请回答:前0~10s 阶段,CO、NO百分含量没明显变化的原因是_____________。 选做题(二选一) 35.【化学——选修3:物质结构与性质】(15分)近代硫化学广泛涉及国计民生,出现在我们生活中的方方面面。(1)硫原子电子填充的最高能级的电子排布式为______________,最高能层的符号是______。 (2)氧、硫同主族,氧的核电荷数小于硫,但氧的电负性却大于硫,原因是___________________________________________________________。 (3)生命体中的硫元素存在于蛋白质的二级结构以及一些氨基酸中,谷胱甘肽是几乎存在于身体的每一个细胞中的含硫寡肽,其结构简式为 分子中S的杂化轨道类型为__________,含有________个手性碳原子。 (4)近几十年来,含硫药物的研发呈持续增长之势,盘尼西林(青霉素)和阿莫西林是典型代表,其结构简式如图29。 从组成和结构上判断,盘尼西林的熔沸点比阿莫西林__________,阿莫西林的水溶性比盘尼西林好,可能原因是____________________________。 (5)自然界的主要含硫矿物之一的硫铁矿(主要成分是FeS2)是提取硫和制取硫酸的主要原料,FeS2的晶体结构类似于NaCl,Fe2+位于Na+位置,S22-位于Cl-位置。若FeS2的密度为d g/cm3,则阴阳离子间的最短距离为____________nm。 36.【化学——选修5:有机化学基础】(15分) 中医认为黄芩有清热燥湿、泻火解毒、安胎的功能,对暑温胸闷呕吐、肺热咳嗽、血热妄行、高热烦渴、湿热下痢等有良好功效。化合物G是中药黄芩中的主要活性成分之一,具有氧化和抗肿瘤作用。G的合成路线如图30所示: (1)芳香族化合物A的分子式为C7H6O,能与银氨溶液反应。A的结构简式为____________________________。 (2)C中非含氧官能团的名称是________________________________。 (3)B转化成C的过程中产生的无机小分子为____________________。 (4)已知D的化学式为C9H12O4,则反应③的反应类型为__________________。 (5)推测D的核磁共振氢谱中存在________组吸收峰及峰面积之比为_______。 (6)指出同时符合下列条件的B的同分异构体的数目为________________。 a.与FeCl3溶液发生显色反应 b.能发生银镜反应 c.能使溴的四氯化碳溶液褪色 (7)若反应①中两种反应物的物质的量相等,请写出反应的化学方程式:________________________________________________。 答案 7B 8C 9C 10A 11B 12D 13B 26.(1)加热搅拌 (2) (3) PbCl42-, ___用冰水浴使反应__ _逆向移动,使PbClz不断转化为PbCl2晶体而析出_____。 (4) __向滤液2中加入双氧水____。 (5) _1.48x103_____________。 (6) ___PbSO4 + 2H2O - 2e- === PbO2 + 4H+ + SO42-____。浓度降至__2.1_mol/L 27.(1)三颈烧瓶,浓硫酸 (2)关闭K2打开K3,当B装置上方充满黄绿色气休时,关闭K3打开K2。 (3) 蒸馏 (4) 2S2Cl2+2H2O = 3S↓ + SO2 ↑ + 4HCl (5) 在DE之间加一个装有无水硫酸图的U型装置 (6) 79.7% 28. (1)2NO(g)+2CO(g)=2CO2(g)+N2(g) ΔH= -746kJ/mol (2)① < ,K(A)__= __K(C) ② 0.05 mol/(L•min) ③Kp=0.089 ④G点 (3)① 纵坐标1到0.8的一条曲线 ②冷启动时三元催化剂尚未达到催化剂的工作温度 35.(1) 3P4 M (2)O的原子半径小宇S (3)sp3 2个 (4) 低,阿莫西林与水形成更多的氢键 36.(1) (2) 氯原子,碳碳双建 (3)SO2 HCl (4)取代反应 (5)4, 1:2:3:6 (6)16种 (7) 查看更多