2021高考化学一轮复习课练22化学反应的方向与限度含解析
课练22 化学反应的方向与限度
————————[狂刷小题 夯基础]——————————
[练基础]
1.下列有关化学反应的描述正确的是( )
A.常温下能自发进行的反应,其ΔH<0
B.一定条件下能自发进行的反应,其ΔS>0
C.自发反应一定能自动进行,而非自发反应一定不能发生
D.ΔH>0和ΔS<0的反应,在任何温度下都不能自发进行
2.下列判断不正确的是( )
A.4Fe(OH)2(s)+O2(g)+2H2O(l)===4Fe(OH)3(s)能自发进行,则它是焓增反应
B.2SO2(g)+O2(g)2SO3(g)是焓减反应,它在较低温度下能自发进行
C.Na与H2O的反应是熵增的放热反应,该反应能自发进行
D.Br2(l)+H2(g)===2HBr(g)是焓减、熵增反应,该反应能自发进行
3.反应N2(g)+3H2(g)2NH3(g) ΔH<0,若在恒温恒容的密闭容器中发生,下列选项表明反应一定达到平衡状态的是( )
A.容器内的温度不再变化
B.容器内的压强不再变化
C.相同时间内,断开H—H键的数目和断开N—H键的数目相等
D.容器内气体的浓度c(N2):c(H2):c(NH3)=1:3:2
4.汽车排气管上安装的催化转换器使NO与CO反应生成可参与大气生态循环的无毒气体,其反应原理是2NO(g)+2CO(g)N2(g)+2CO2(g),在298 K、100 kPa下,ΔH=-113 kJ·mol-1,ΔS=-145 J·mol-1·K-1,下列说法错误的是( )
A.该反应中反应物的总能量高于生成物的总能量
B.该反应常温下不能自发进行,因此需要高温和催化剂条件
C.该反应常温下能自发进行,高温和催化剂条件只是加快反应速率
D.汽车尾气中的这两种气体会与血红蛋白结合而使人中毒
5.在恒容密闭容器中进行如下反应X(g)+Y(g)2Z(g)+W(?)。下列情况能表明该可逆反应一定达到平衡状态的是( )
A.混合气体平均相对分子质量不变
- 19 -
B.混合气体密度不变
C.混合气体压强不变
D.Z的消耗速率等于X的生成速率的2倍
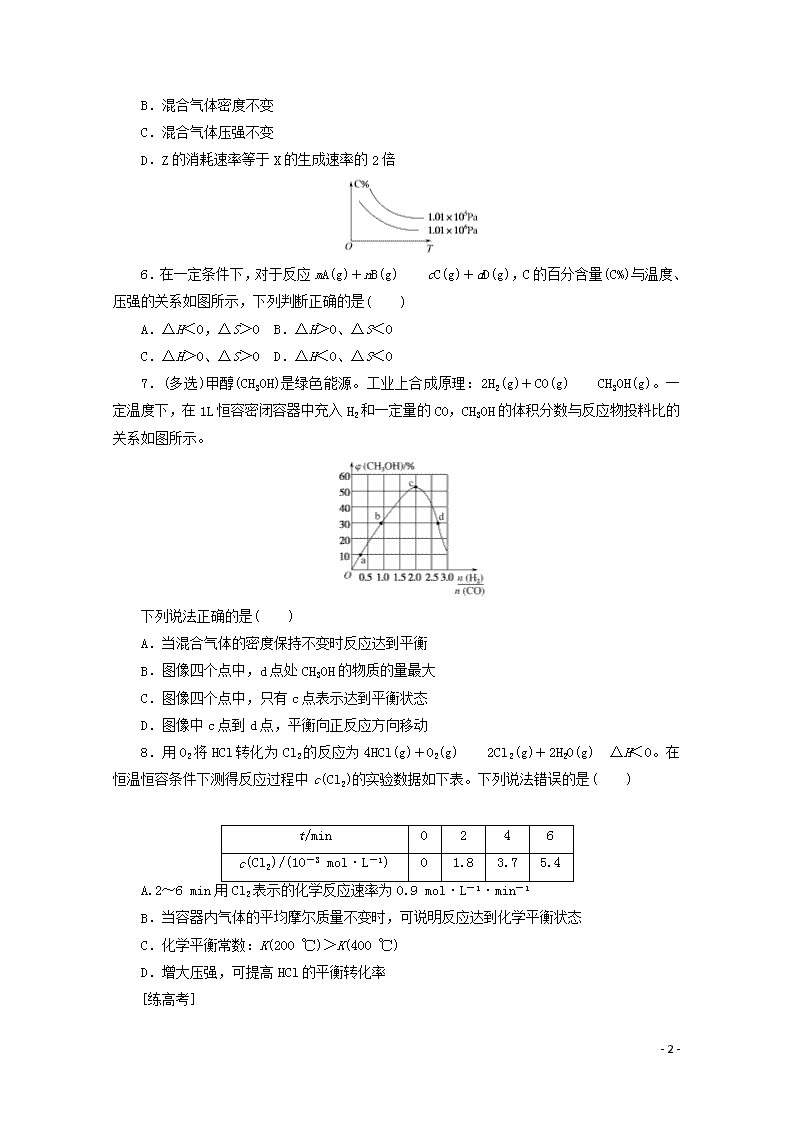
6.在一定条件下,对于反应mA(g)+nB(g)cC(g)+dD(g),C的百分含量(C%)与温度、压强的关系如图所示,下列判断正确的是( )
A.ΔH<0,ΔS>0 B.ΔH>0、ΔS<0
C.ΔH>0、ΔS>0 D.ΔH<0、ΔS<0
7.(多选)甲醇(CH3OH)是绿色能源。工业上合成原理:2H2(g)+CO(g)CH3OH(g)。一定温度下,在1 L恒容密闭容器中充入H2和一定量的CO,CH3OH的体积分数与反应物投料比的关系如图所示。
下列说法正确的是( )
A.当混合气体的密度保持不变时反应达到平衡
B.图像四个点中,d点处CH3OH的物质的量最大
C.图像四个点中,只有c点表示达到平衡状态
D.图像中c点到d点,平衡向正反应方向移动
8.用O2将HCl转化为Cl2的反应为4HCl(g)+O2(g)2Cl2(g)+2H2O(g) ΔH<0。在恒温恒容条件下测得反应过程中c(Cl2)的实验数据如下表。下列说法错误的是( )
t/min
0
2
4
6
c(Cl2)/(10-3 mol·L-1)
0
1.8
3.7
5.4
A.2~6 min用Cl2表示的化学反应速率为0.9 mol·L-1·min-1
B.当容器内气体的平均摩尔质量不变时,可说明反应达到化学平衡状态
C.化学平衡常数:K(200 ℃)>K(400 ℃)
D.增大压强,可提高HCl的平衡转化率
[练高考]
- 19 -
1.[2012·山东卷(节选)](多选)一定温度下,现将1 mol N2O4充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是( )
2.[2015·天津,3]下列说法不正确的是( )
A.Na与H2O的反应是熵增的放热反应,该反应能自发进行
B.饱和Na2SO4溶液或浓硝酸均可使蛋白质溶液产生沉淀,但原理不同
C.FeCl3和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变相同
D.Mg(OH)2固体在溶液中存在平衡:Mg(OH)2(s)Mg2+(aq)+2OH-(aq),该固体可溶于NH4Cl溶液
3.[2017·天津高考]常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)Ni(CO)4(g)。230 ℃时,该反应的平衡常数K=2×10-5。已知:Ni(CO)4的沸点为42.2 ℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230 ℃制得高纯镍。
下列判断正确的是( )
A.增加c(CO),平衡向正向移动,反应的平衡常数增大
B.第一阶段,在30 ℃和50 ℃两者之间选择反应温度,选50 ℃
C.第二阶段,Ni(CO)4分解率较低
D.该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)
4.[2015·江苏](多选)在体积均为1.0 L的两恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1 mol CO2和0.2 mol CO2,在不同温度下反应CO2(g)+C(s)2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如下图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是( )
- 19 -
A.反应CO2(g)+C(s)===2CO(g)的ΔS>0、ΔH<0
B.体系的总压强p总:p总(状态Ⅱ)>2p总(状态Ⅰ)
C.体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ)
D.逆反应速率v逆:v逆(状态Ⅰ)>v逆(状态Ⅲ)
[练模拟]
1.[2019·武汉联考]下列说法正确的是( )
A.由C(石墨,s)===C(金刚石,s) ΔH>0,可知金刚石比石墨稳定
B.自发反应就是能较快进行的反应
C.电离平衡时,由于分子和离子的浓度不断发生变化,所以说电离平衡是动态平衡
D.对于某可逆反应,反应进行的净速率是正、逆反应速率之差
2.[2019·湖南长郡中学调研]已知;2H2S(g)+O2(g)S2(s)+2H2O(g) ΔH=-Q kJ·mol-1(Q>0)。T ℃时,在容积为2 L的密闭容器中,起始加入2 mol H2S(g)和1 mol O2(g),达到平衡时生成0.6 mol S2。下列说法能说明反应达到平衡状态的是( )
A.硫化氢的浓度是氧气浓度的2倍
B.容器中混合气体的压强不变
C.反应放出的热量为0.3Q kJ
D.消耗2 mol H2S(g)的同时生成2 mol H2O(g)
3.[2019·陕西咸阳一检]下列关于化学反应方向及其判断的说法错误的是( )
A.1 mol H2O在不同状态时的熵值:S[H2O(s)]<S[H2O(g)]
B.放热反应都可以自发进行,而吸热反应不能自发进行
C.2KClO3(s)===2KCl(s)+3O2(g) ΔH>0能否自发进行与温度有关
D.常温下,反应C(s)+CO2(g)===2CO(g)不能自发进行,则该反应的ΔH>0
4.[2019·唐山质检]已知碳酸钡分解反应:(Ⅰ)BaCO3(s)===BaO(s)+CO2(g) ΔH1仅在高温下能自发进行;高锰酸钾分解:(Ⅱ)2KMnO4(s)===K2MnO4(s)+MnO2(s)+O2(g) ΔH2在任何温度下都能自发进行。下列焓变判断正确的是( )
A.ΔH1<0,ΔH2<0 B.ΔH1>0,ΔH2<0
C.ΔH1<0,ΔH2>0 D.ΔH1>0,ΔH2>0
5.[2019·河南郑州外国语学校联考]在1 L恒温恒容的密闭容器中投入一定量N2O5,发生反应:
- 19 -
反应1:N2O5(g)===N2O4(g)+O2(g) ΔH=+28.4 kJ·mol-1;
反应2:N2O4(g)2NO2(g) ΔH=-56.9 kJ·mol-1。
现有下列情况:①混合气体的密度保持不变;②气体压强保持不变;③气体的平均摩尔质量保持不变;④保持不变;⑤O2的物质的量保持不变;⑥v正(N2O4)v逆(NO2)=12。能表明反应2一定达到平衡状态的是( )
A.①②③⑤ B.②③④⑥
C.①③⑤⑥ D.②③④⑤
6.(多选)在容积为2 L的恒容密闭容器中,充入一定量的HX(g),发生反应:2HX(g)H2(g)+X2(g) ΔH>0,反应物的物质的量n(mol)随时间t(s)变化的数据如下:
物质的量/mol时间/s
0
20
40
60
80
100
实验1(500 ℃)
1.0
0.80
0.65
0.55
0.50
0.50
实验2(500 ℃)
a
0.70
0.52
0.50
0.50
0.50
实验3(600 ℃)
1.0
0.50
0.30
0.20
0.20
0.20
根据表中数据判断,下列说法不正确的是( )
A.实验1中,反映在前40 s内,v(HX)=4.375×10-3 mol·L-1·s-1
B.表中a=1.0,实验2可能使用了催化剂
C.600 ℃时,该反应的平衡常数K=8.0
D.实验2若保持温度不变,增大压强,HX的转化率增大
- 19 -
————————[综合测评 提能力]————————
一、选择题:本题共7小题,每小题2分,共14分。每小题只有一个选项符合题意。
1.[2019·山东胶州二中期中]下列关于自发反应的说法中错误的是( )
A.非自发反应在一定条件下可以实现
B.能够设计成原电池的反应是自发进行的氧化还原反应
C.电解质在水溶液中的电离是一个自发过程,该过程为熵增过程
D.2NO2(g)+4CO(g)===N2(g)+4CO2(g) ΔH<0,则该反应高温下利于自发进行
2.在恒温恒容密闭容器中发生反应:X(s)+2Y(g)M(g)+G(g) ΔH。下列情况表明反应达到平衡状态的是( )
A.容器内气体压强不再改变
B.容器内气体密度不再改变
C.反应热ΔH不再改变
D.X的浓度不再改变
3.在一个密闭容器中进行如下反应:2X2(g)+Y2(g)2Z(g),反应过程中某一时刻X2、Y2、Z的浓度分别为0.2 mol·L-1、0.1 mol·L-1、0.2 mol·L-1。当反应达到平衡时,下列数据可能合理的是( )
A.Z的浓度为0.4 mol·L-1
B.X2、Z的浓度均为0.15 mol·L-1
C.X2的浓度为0.4 mol·L-1
D.X2与Z的浓度之和为0.4 mol·L-1
4.在恒容密闭容器中充入2 mol SO2和2 mol NO2发生反应:SO2(g)+NO2(g)NO(g)+SO3(g) ΔH=-Q kJ·mol-1(Q>0),达到平衡状态时,下列说法不正确的是( )
A.气体密度保持不变
B.气体总压强始终不变
C.SO2和SO3共2 mol
D.放出Q kJ热量
5.[2019·河南信阳一高期末]随着汽车使用量增大,尾气污染已经受到人们的普遍关注。研究表明,常温常压下:2CO(g)+2NO(g)N2(g)+2CO2(g) ΔH=-746.8 kJ·mol-1,ΔS=-197.5 J·mol-1·K-1。下列说法与事实不相符合的是( )
- 19 -
A.常温下,ΔH-TΔS>0,此反应不能自发进行
B.常温下,ΔH-TΔS<0,但CO和NO通常难以转化为N2和CO2
C.汽车尾气中含有较多的CO和NO,是因为该反应的活化能较高
D.要有效降低汽车尾气中的CO和NO含量,应该寻找高效廉价的催化剂
6.
[2019·四川乐山调研]在T ℃时,将一定量A加入到体积为2 L的某密闭容器中,发生反应2A(g)B(g)+C(g) ΔH=-a kJ·mol-1(a>0)。反应在第15 min时达到平衡,反应过程中与时间t有如图所示关系,若测得第15 min时,c(B)=0.8 mol·L-1,下列结论正确的是( )
A.反应达到平衡时,A的转化率为80%
B.A的初始物质的量为2 mol
C.反应达到平衡时,放出的热量为2a kJ
D.15 min时,v正=v逆=0
7.[2019·安徽联盟阶段考]一定温度下,向容积为2 L的恒容密闭容器中加入2 mol A(g)和3 mol B(g)发生反应:A(g)+B(g)C(g) ΔH>0,达到平衡后容器内压强是开始时的84%。若加入某种催化剂后反应的能量变化如图所示。下列说法正确的是( )
A.由图可知,加入催化剂之后,原反应分成了两步,第一步反应较慢
B.若40 s后达到平衡,则用A表示该反应的速率为0.01 mol·L-1·min-1
C.当容器中不再改变时,不能说明该反应达到了平衡状态
D.达到平衡时,C的体积分数约为25%
二、选择题:本题共3小题,每小题4分,共12分。每小题有一个或两个选项符合题意,全部选对得4分,选对但不全的得1分,有选错的得0分。
8.一定温度下,在3个容积均为1.0 L的恒定密闭容器中发生反应PCl5(g)PCl3(g)+Cl2(g)。下列说法正确的是( )
- 19 -
容器
编号
物质的起始浓度/
(mol·L-1)
物质的平衡浓度/
(mol·L-1)
c(PCl5)
c(PCl3)
c(Cl2)
c(Cl2)
Ⅰ
0.4
0
0
0.2
Ⅱ
1.05
0.05
1.95
Ⅲ
0.8
0
0
A.达平衡时,容器Ⅰ中比容器Ⅱ中的大
B.达平衡时,容器Ⅰ与容器Ⅱ中的总压强之比为6:31
C.达平衡时,容器Ⅲ中Cl2的体积分数大于
D.达平衡时,容器Ⅲ中0.4 mol·L-1
v(逆)
D.若在c点将温度降低,其透光率将增大
10.一定温度下,在3个体积均为1.0 L的恒容密闭容器中反应2H2(g)+CO(g)CH3OH(g)分别达到平衡。下列说法正确的是( )
容器
温度
(K)
起始浓度(mol/L)
CH3OH的平衡
浓度(mol/L)
H2
CO
CH3OH
①
400
0.20
0.10
0
0.08
②
400
0.40
0.20
0
x
③
500
0
0
0.10
0.025
- 19 -
A.该反应的正反应是吸热反应
B.x=0.16
C.平衡时,容器②中H2的体积分数比容器①的大
D.400 K时若再向容器①中充入0.10 mol H2、0.10 mol CO和0.10 mol CH3OH,则平衡将向正反应方向移动
三、非选择题:本题共3小题。
11.(10分)[2019·山东菏泽一中第二次月考]将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
温度/℃
15.0
20.0
25.0
30.0
35.0
平衡总压强/kPa
5.7
8.3
12.0
17.1
24.0
平衡气体总浓度/
(×10-3 mol·L-1)
2.4
3.4
4.8
6.8
9.4
(1)该反应的焓变ΔH________0,熵变ΔS________0(填“>”“<”或“=”)。
(2)可以判断该分解反应已经达到化学平衡的是____(填序号)。
A.2v正(NH3)=v逆(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
(3)根据表中数据计算,在25.0 ℃时,反应2NH3(g)+CO2(g)NH2COONH4(s)的平衡常数K=________。
(4)取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25 ℃下达到平衡状态。若在恒温下压缩容器体积,氨基甲酸铵固体的质量________(填“增大”“减小”或“不变”)。
12.(14分)[2019·安徽黄山八校联考](1)一定条件下,将2 mol SO2与1 mol O2置于恒容密闭容器中发生反应2SO2(g)+O2(g)2SO3(g),下列状态能说明该反应达到化学平衡的是________。
A.混合气体的密度保持不变
B.SO2的转化率保持不变
C.SO2和O2的物质的量之比保持不变
D.O2的消耗速率和SO3的消耗速率相等
- 19 -
(2)已知反应2NO(g)N2(g)+O2(g) ΔH<0,在不同条件时N2的体积分数随时间(t)的变化如图所示。根据图像可以判断曲线R1、R2对应的下列反应条件中不同的是________。
A.压强 B.温度 C.催化剂
(3)CO和H2在一定条件下可以合成甲醇:CO(g)+2H2(g)CH3OH(g) ΔH<0。现在体积为1 L的恒容密闭容器(如图甲所示)中通入1 mol CO和2 mol H2,测定不同时间、不同温度(T/℃)下容器中CO的物质的量,如下表:
0 min
10 min
20 min
30 min
40 min
T1
1 mol
0.8 mol
0.62 mol
0.4 mol
0.4 mol
T2
1 mol
0.7 mol
0.5 mol
a
a
请回答:
①T1__________(填“>”或“<”或“=”)T2,理由是______________________________________。已知T2 ℃时,第20 min时容器内压强不再改变,此时H2的转化率为________,该温度下的化学平衡常数为________。
②若将1 mol CO和2 mol H2通入原体积为1 L的恒压密闭容器(如图乙所示)中,在T2 ℃下达到平衡,此时反应的平衡常数为________;若再向容器中通入1 mol CH3OH(g),重新达到平衡后,CH3OH(g)在体系中的百分含量________(填“变大”或“变小”或“不变”)。
13.(12分)CO是一种重要化工原料,镍是有机化学的重要催化剂。
Ⅰ.镍能与CO反应,化学方程式如下:
Ni(s)+4CO(g)Ni(CO)4(g) ΔH
(1)ΔH________0(填“>”“<”或“=”)。
(2)工业上,利用密闭石英管提纯粗镍。在密闭石英管内充满CO,在________放置粗镍(填“高温区”或“低温区”),在另一区域收集纯镍粉。
(3)吸烟时,烟草燃烧生成的CO会与烟草中微量的Ni在肺部发生该反应,生成容易进入血液的Ni(CO)4,随着CO与血红蛋白的结合,在血液中不断积累重金属镍单质,使人体中毒。用化学平衡原理解释“镍积累”:______________________。
(4)镍与CO反应会造成镍催化剂中毒。为了防止镍催化剂中毒,工业上常用SO2
- 19 -
除去CO。已知有关能量变化关系如图所示。
写出用SO2除去CO的热化学方程式:__________________________________________。
Ⅱ.工业上用一氧化碳制取氢气的反应为CO(g)+H2O(g)CO2(g)+H2(g),420 ℃时,该反应的平衡常数K为9.0。在2 L的密闭容器中充入CO和H2O的物质的量都是0.6 mol,5 min未达到平衡,则此时CO的转化率为________,生成H2的平均速率为________。
- 19 -
课练22 化学反应的方向与限度
[狂刷小题 夯基础]
[练基础]
1.D 常温下能自发进行的反应不一定是放热反应,如Ba(OH)2和NH4Cl的反应为吸热反应,但该反应在常温下可以自发进行,A项错误;有些熵减的反应也能自发进行,B项错误;某些自发反应需在一定条件下才能发生,而非自发反应具备了一定条件也能发生,C项错误;ΔH-T·ΔS<0时反应能自发进行,因此ΔH>0、ΔS<0的反应,ΔH-T·ΔS>0恒成立,该反应在任何温度下都不能自发进行,D项正确。
2.A A项,该反应是熵减反应,能自发进行,说明ΔH-TΔS<0,即该反应是焓减反应,错误;B项,该反应是气体分子数减小的反应,熵变小于0,所以,该反应在较低温度下能自发进行,正确;C项,由ΔH-TΔS <0可知,该反应能自发进行,正确;D项,该反应能自发进行,正确。
3.B 本题考查化学平衡状态的判断。合成氨反应在恒温恒容的密闭容器中进行,体系的温度始终不变,故不能根据温度恒定判断是否达到平衡状态,A错误;反应中,气体的总物质的量和压强不断变化,当容器内的压强不再变化,该反应达到平衡状态,B正确;达到平衡时,断裂3 mol H—H键的同时断裂6 mol N—H键,故相同时间内,断开H—H键的数目和断开N—H键的数目相等时,该反应未达到平衡状态,C错误;达到平衡时,c(N2)、c(H2)、c(NH3)均保持不变,当容器内气体的浓度c(N2):c(H2):c(NH3)=1:3:2,该反应不一定达到平衡状态,D错误。
4.B 该反应放热,说明反应物的总能量高于生成物的总能量,A正确;298 K时,该反应的ΔH-TΔS=-113 kJ·mol-1-298 K×(-0.145 kJ·mol-1·K-1)=-69.8 kJ·mol-1<0,在常温下能自发进行,B错误,C正确;NO、CO会与血红蛋白结合而使人中毒,D正确。
5.A 可逆反应中W的状态不确定,W可能是气态、非气态。A项,若W为固态或液态,则混合气体质量发生变化,气体分子数不变;若W为气态,则气体质量不变,气体分子数发生变化,则气体平均相对分子质量不变时达到平衡状态,正确;B项,若W为气体时,总质量不变,气体密度不变,错误;C项,若W为液态或固态时,气体总物质的量不变,气体压强不变,错误;D项,Z的消耗速率始终等于X的生成速率的2倍,错误。
- 19 -
6.A 本题考查化学反应进行的方向与ΔH、ΔS的关系。由图可知,当压强一定时,升高温度,C的百分含量减小,说明升高温度,平衡逆向移动,则有ΔH<0;当温度一定时,增大压强,C的百分含量减小,说明增大压强,平衡逆向移动,则有m+n<c+d,故该反应的正反应是气体分子总数增加的反应,即熵增的反应,则有ΔS>0,A正确。
7.BD A项,反应前后的物质均是气体,且混合气体的总质量不变,又因为是恒容容器,故气体密度始终不变,错误;B项,达到平衡,d点相当于c点平衡后,再增加氢气的浓度,平衡向正反应方向移动,CO的平衡转化率增大,故d点处CH3OH的物质的量最大,正确;C项,曲线上的每个点都是不同反应物投料比下的平衡点,错误;D项,相当于c点达到平衡后,继续增大H2的物质的量,平衡向右移动,正确。
8.A 本题考查化学反应速率、平衡状态及平衡常数等。2~6 min c(Cl2)由1.8×10-3 mol·L-1增大到5.4×10-3 mol·L-1,则有v(Cl2)==9×10-4 mol·L-1·min-1,A错误;恒温恒容时,平衡建立过程中,混合气体的总质量不变,气体的总物质的量不断变化,则气体的平均摩尔质量不断变化,当容器内气体的平均摩尔质量不变时,该反应达到化学平衡状态,B正确;该反应的ΔH<0,升高温度,平衡逆向移动,平衡常数K减小,则平衡常数:K(200 ℃)>K(400 ℃),C正确;该反应的正反应为气体分子数减小的反应,增大压强,平衡正向移动,则HCl的平衡转化率增大,D正确。
[练高考]
1.AD A项,因N2O4可部分转化为NO2:N2O42NO2,且容器为恒温恒压,密度是逐渐减小的变量,当密度不再改变时,反应到达平衡,A正确;B项,ΔH为反应热,若反应方程式确定,ΔH为定值,不是变量,不能说明反应到达平衡状态,B不对;C项,正反应速率v(N2O4)逐渐减小,v(NO2)逐渐增大,C不对;D项,N2O4的转化率达平衡时不再改变,D正确。
2.C 钠与水反应有气体生成,是熵增的放热反应,所以反应能自发进行,A项正确。饱和硫酸钠溶液使蛋白质溶液产生沉淀发生的是蛋白质的盐析,而浓硝酸使蛋白质溶液产生沉淀发生的是蛋白质的变性,二者原理不同,B项正确。FeCl3和MnO2都能催化H2O2分解,但催化剂具有选择性,二者的催化效率肯定不相同,C项错误。Mg(OH)2固体能溶于NH4Cl溶液中,是由于NH4Cl水解溶液显酸性,且发生了反应:NH+OH-===NH3·H2O,使沉淀溶解平衡正向移动,D项正确。
3.B 增加c(CO),平衡正向移动,温度不变,反应的平衡常数不变,A错误;第一阶段,生成的Ni(CO)4是气态,应选择高于其沸点的反应温度,故选50 ℃,B正确;230 ℃时,化学平衡常数K=2×10-5,有利于反应逆向进行,Ni(CO)4分解率较高,C错误;反应达到平衡时,4v生成[Ni(CO)4]=v生成(CO),D错误。
4.BC A项,从图中看,升高温度,c(CO2)减少,即平衡正向移动,所以正反应为吸热反应,错误;B项,图中存在Ⅱ点的曲线的c(CO2)高,所以对应为通入0.2 mol CO2
- 19 -
,在反应前容器压强由CO2引起,为两倍关系,随着反应进行,在不同温度下达到平衡时,Ⅰ和Ⅱ的c(CO2)相等,则Ⅱ对应的CO2反应量为Ⅰ中参加反应的CO2的2倍多,且该反应为气体增多的反应,所以当c(CO2)相等时,状态Ⅱ对应的压强比状态Ⅰ的2倍大,正确;C项,状态Ⅱ中CO2的投入量为状态Ⅲ的2倍,状态Ⅱ可以理解成两个状态Ⅲ叠加,若平衡不移动,则c(CO)也为2倍,现压强增大,平衡逆向移动,则状态Ⅱ中的c(CO)小于状态Ⅲ中c(CO)的2倍,正确;D项,Ⅲ比Ⅰ的温度高,所以状态Ⅲ的反应速率快,错误。
[练模拟]
1.D 石墨转化为金刚石,反应吸热,说明金刚石的能量比石墨高,根据能量越低越稳定可知,石墨比金刚石稳定,A项错误;自发进行与反应快慢无关,B项错误;电离平衡时,溶液中分子和离子的浓度不再改变,C项错误;可逆反应中正、逆反应同时进行,净速率是正、逆反应速率之差,D项正确。
2.B 本题考查化学平衡状态的判断。起始加入2 mol H2S(g)和1 mol O2(g),投料比等于其化学计量数之比,无论是否达到平衡状态,c(H2S)始终是c(O2)的2倍,A错误。该反应中S2是固体,正反应是气体总分子数减小的放热反应,平衡建立过程中,气体总物质的量不断变化,则气体的压强不断变化,当压强不变时,该反应达到平衡状态,B正确。达到平衡时生成0.6 mol S2,当反应放出的热量为0.3Q kJ时,生成0.3 mol S2,故未达到平衡状态,C错误。消耗2 mol H2S(g)的同时必定生成2 mol H2O(g),都代表正反应速率,故不能判断反应是否达到平衡状态,D错误。
3.B 同一种物质在不同状态,熵值不同,大小关系为S[H2O(g)]>S[H2O(l)]>S[H2O(s)],A正确;反应能否自发进行,要根据ΔH-TΔS的大小来判断,B错误;该反应的ΔS>0,ΔH>0,在高温下能自发进行,C正确;常温下,该反应不能自发进行,说明ΔH-TΔS>0,又ΔS>0,则ΔH>0,D正确。
4.B 反应(Ⅰ)是熵增反应(ΔS>0),仅在高温下自发进行,由ΔH1-TΔS<0,知ΔH1>0。反应(Ⅱ)是熵增反应,在任何温度下都自发进行,该反应是焓减反应,即ΔH2<0。
5.B 本题考查化学平衡状态的判断。①反应中各物质均为气体,混合气体的总质量不变,且反应在恒容条件下进行,则混合气体的密度始终不变,故不能判断是否达到平衡,错误;②反应2的平衡建立过程中,气体总物质的量不断变化,则气体压强不断变化,当气体压强保持不变时,反应2达到平衡状态,正确;③平衡建立过程中,混合气体的总质量不变,但其总物质的量不断变化,故当气体的平均摩尔质量保持不变时,反应2达到平衡状态,正确;④保持不变,则c(NO2)、c(N2O4)均保持不变,反应2达到平衡状态,正确;⑤反应1是不可逆反应,O2的物质的量始终保持不变,不能据此判断反应2是否达到平衡,错误;⑥v正(N2O4):v逆(NO2)=1:2,正、逆反应速率相等,反应2达到平衡状态,正确。
6.CD 实验1中前40 s内,HX的物质的量减小0.35 mol,则有v(HX)=
- 19 -
=4.375×10-3 mol·L-1·s-1,A正确;实验1和2的温度相同,达到平衡时n(HX)均为0.50 mol,则起始时n(HX)应相等,即a=1.0,但实验2达到平衡所用时间短,反应速率快,故实验2可能使用了催化剂,B正确;600 ℃时,达到平衡消耗0.80 mol HX,则达到平衡时HX(g)、H2(g)、X2(g)的浓度分别为0.10 mol·L-1、0.20 mol·L-1、0.20 mol·L-1,该反应的平衡常数K===4.0,C错误;该反应前后气体体积不变,若保持温度不变,增大压强,平衡不移动,则HX的转化率不变,D错误。
[综合测评 提能力]
1.D 本题考查自发反应及其判断。非自发反应在一定条件下能实现自发进行,如ΔH>0、ΔS>0的反应高温下可以自发进行,低温下不能自发进行,A正确;理论上,能够设计成原电池的反应是常温下能自发进行的氧化还原反应,B正确;电解质在水溶液中的电离是一个自发过程,该过程中电解质电离产生自由移动的离子,微粒数目增大,故该过程为熵增过程,C正确;反应2NO2(g)+4CO(g)===N2(g)+4CO2(g)的ΔH<0、ΔS<0,若自发进行,应满足ΔH-TΔS<0,故该反应低温下有利于自发进行,D错误。
2.B 观察反应知,X是固态。A项,该反应是等气体分子数反应,气体压强始终不变,故不能判断反应是否达到平衡状态;B项,正反应是气体质量增大体积不变的反应,故气体密度由小到大,当气体密度不变时可说明反应已达到平衡状态;C项,反应热只与化学计量数有关,与转化率无关,不能判断反应是否达到平衡状态;D项,X为固体,X的浓度始终不变,不能判断反应是否达到平衡状态。
3.D 反应若正向进行到底,Z的浓度才为0.4 mol·L-1,根据可逆反应特点,A错;B项不符合质量守恒定律;反应若逆向进行到底,X2的浓度才为0.4 mol·L-1,根据可逆反应特点,C错。
4.D 该反应是可逆反应,生成NO的物质的量不一定是1 mol,放出热量不一定是Q kJ。
5.A 本题考查化学反应进行的方向判断。常温下,反应2CO(g)+2NO(g)N2(g)+2CO2(g)的ΔH<0、ΔS<0,则ΔH-TΔS=(-746.8 kJ·mol-1)-298 K×(-0.197 5 kJ·mol-1·K-1)=-687.945 kJ·mol-1<0,则该反应常温下能自发进行,A错误;常温下,ΔH-TΔS<0,但CO和NO通常难以转化为N2和CO2,必须寻找高效催化剂,B正确;该反应的活化能较高,反应速率较慢,故汽车尾气中含有较多的CO和NO,C正确;要有效降低汽车尾气中的CO和NO含量,应该寻找高效廉价的催化剂,降低反应的活化能,提高反应速率,D正确。
6.A 第15 min时c(B)=0.8 mol·L-1,则有n(B)=0.8 mol·L-1×2 L=1.6 mol;由图可知,此时=2,则有n(A)=n(B)=0.8 mol;生成1.6 mol B时,消耗3.2 mol
- 19 -
A,则A的平衡转化率为×100%=80%,A正确。A的初始物质的量为3.2 mol+0.8 mol=4 mol,B错误。生成1 mol B时放出a kJ热量,则达到平衡时放出的热量为1.6a kJ,C错误。第15 min时,该反应达到平衡状态,此时正、逆反应速率相等,但不等于0,D错误。
7.A 本题考查催化剂对化学反应的影响,涉及反应速率、平衡状态的判断及体积分数的计算。图中存在两座“山峰”,反应中存在中间态物质,说明加入催化剂后,原反应被分成两步,第一步的“峰值”较高,说明该步反应的活化能较大,则第一步反应较慢,A正确。设A的转化浓度为x mol·L-1,根据“三段式法”计算,则有:
A(g)+B(g)C(g)
起始浓度/(mol·L-1) 1 1.5 0
转化浓度/(mol·L-1) x x x
平衡浓度/(mol·L-1) 1-x 1.5-x x
根据阿伏加德罗定律,恒温恒容时,气体的压强之比等于其物质的量之比,则有=84%,解得x=0.4,则有v(A)==0.01 mol·L-1·s-1=0.6 moL·L-1·min-1,B错误。开始时=1.5,平衡时≈1.8,说明达到平衡前不断变化,故当容器中不再改变时,该反应达到平衡状态,C错误。根据阿伏加德罗定律,达到平衡时,C的体积分数等于其物质的量分数,则有φ(C)=×100%≈19%,D错误。
8.BD 根据容器Ⅰ中数据,达平衡时容器Ⅰ中c(PCl5)=0.2 mol·L-1,c(PCl3)=0.2 mol·L-1,c(Cl2)=0.2 mol·L-1,可得K=0.2。容器Ⅱ起始时Qc=≈0.093≈1.86,而容器Ⅰ中反应达平衡时=1,A项错误;设容器Ⅱ达平衡时c(Cl2)=x mol·L-1,则c(PCl3)=(x-1.9) mol·L-1,c(PCl5)=(3-x) mol·L-1,根据K==0.2,解得x=2,故平衡时总浓度为(x+x-1.9+3-x) mol·L-1=(1.1+x) mol·L-1=3.1 mol·L-1,故平衡时容器Ⅰ与容器Ⅱ中的总压强之比为0.6:3.1=6:31,B项正确;容器Ⅲ相当于将两个容器Ⅰ合并后体积压缩一半,加压时平衡逆向移动,Cl2的体积分数减小,容器Ⅰ达平衡时Cl2的体积分数为,则容器Ⅲ达平衡时Cl2的体积分数小于,C项错误;容器Ⅰ达平衡时c(PCl5)=0.2 mol·L-1,容器Ⅲ相当于将两个容器Ⅰ合并后体积压缩一半,若平衡不移动,则c(PCl5)=0.4
- 19 -
mol·L-1,但加压时平衡逆向移动,故0.4 mol·L-10.16,故B错误;Ⅱ相当于在Ⅰ的基础上增大压强,平衡正向移动,则容器②中H2的体积分数比容器①的小,故C错误;400 K时若容器①中:
K==2 500,再向容器①中充入0.10 mol H2、0.10 mol CO和0.10 mol CH3OH,此时c(H2)=0.14 mol/L、c(CO)=0.12 mol/L,c(CH3OH)=0.18 mol/L,则Qc==76.5
查看更多