- 2021-04-25 发布 |
- 37.5 KB |
- 17页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2011年全国中考化学真题分类汇编——金属和金属材料
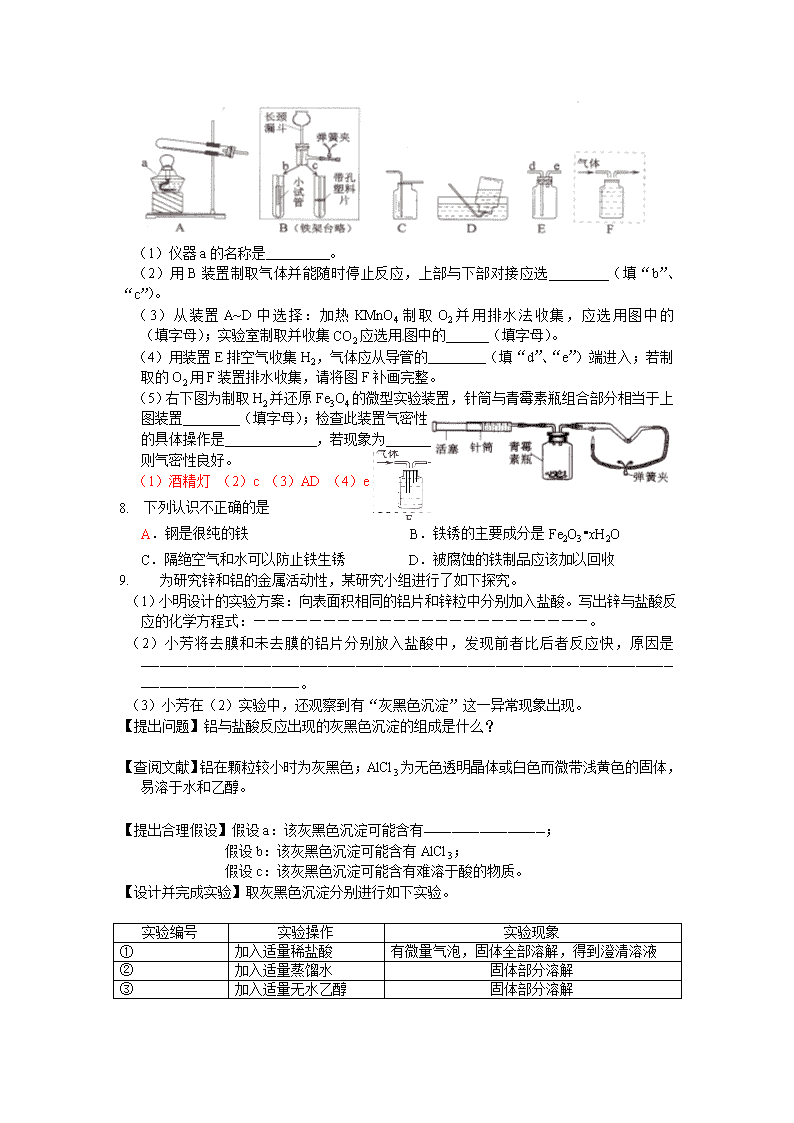
2011年全国中考化学单元汇编之金属和金属材料 1. 芜湖铁画是中国工艺美术百花园中的一朵奇葩。它以钢材为主料,经锻打、焊接、酸洗、上漆等多道工艺制成。下列关于铁画的叙述不正确的是【 】 A.铁画应悬挂在干燥的环境中 B.所用材料上的铁锈可用稀盐酸清洗掉 C.给打制成型的铁画喷漆既美观又可以防锈蚀 D.所用的主要材料──低碳钢,有较好的锻轧性能,它不属于铁的合金 2. 右图所示是液态二氧化碳灭火器,请回答下列问题。 (1)图中所标物质中属于金属材料的是 (只写一种), 属于有机材料的是________________(只写一种)。 (2)加压在小钢瓶中液态二氧化碳喷出后能灭火。其原理是 _____ ______和______ ________。 (3)在钢瓶表而涂油漆的作用是____________ _______。 (4)比较铁和铜的金属活动性强弱可采用 的方法。 ⑴铜(或铁或钢) 塑料(或油漆)⑵降温 隔绝空气 ⑶防锈(其他合理答案均给分) ⑷把铁片插入到硫酸铜溶液中(其他合理答案均给分) 3. 锰(Mn)和镍(Ni)都是金属,将镍丝插入硫酸锰溶液中,无变化;将镍丝插入硫酸铜溶液中,镍丝上有铜析出。则Mn 、Ni 、Cu的金属活动性由弱到强排列正确的是 A、 Mn Cu Ni B、Ni Mn Cu C、Cu Ni Mn D、Mn Ni Cu 4. 将洁净光亮的铁钉在潮湿的棉花中比放在空气中更易生锈,主要原因是 A.铁钉附近湿度增大,溶氧量增多 B.隔绝了氧气 C.温度更低 D.更易与二氧化碳反应 5. 下列反应属于置换反应的是 A、S+O2SO2 B、2H2O2H2↑+O2↑ C、C+2CuOCO2↑+2Cu D、Al(OH)3+3HCl=AlCl3+3H2O 6. 请完成下面填空: (1)性质决定用途。以下连线正确的是 (填字母) 性质 用途 金属的导电性 a b 铜可用作电极材料 金属的延展性 铁锅、铝锅是常用的烹饪用具 金属的导热性 c 28g纯金可拉成65km长金线 (2)用Fe粉制成的食品保鲜剂使用一段时间后,会逐渐变为 色的氧化铁。 (3)铁制品易发生锈蚀,请写出一种防止铁生锈的方法 。 (4)用氯化物 (填化学式)溶液可以一次性验证Fe、Cu、Ag三种金属的活动性顺序。 (1)C (2)红(红棕)(3)保持铁表面干燥和清洁 (或涂上保护膜)(4)CuCl2 7. 下面是实验室制取和收集气体的装置,请按要求作答: (1)仪器a的名称是 。 (2)用B装置制取气体并能随时停止反应,上部与下部对接应选 (填“b”、“c”)。 (3)从装置A~D中选择:加热KMnO4制取O2并用排水法收集,应选用图中的 (填字母);实验室制取并收集CO2应选用图中的 (填字母)。 (4)用装置E排空气收集H2,气体应从导管的 (填“d”、“e”)端进入;若制取的O2用F装置排水收集,请将图F补画完整。 (5)右下图为制取H2并还原Fe3O4的微型实验装置,针筒与青霉素瓶组合部分相当于上图装置 (填字母);检查此装置气密性的具体操作是 ,若现象为 ,则气密性良好。 (1)酒精灯 (2)c (3)AD (4)e 1. 下列认识不正确的是 A.钢是很纯的铁 B.铁锈的主要成分是Fe2O3•xH2O C.隔绝空气和水可以防止铁生锈 D.被腐蚀的铁制品应该加以回收 2. 为研究锌和铝的金属活动性,某研究小组进行了如下探究。 (1)小明设计的实验方案:向表面积相同的铝片和锌粒中分别加入盐酸。写出锌与盐酸反应的化学方程式:————————————————————————。 (2)小芳将去膜和未去膜的铝片分别放入盐酸中,发现前者比后者反应快,原因是——————————————————————————————————————————————————————————————————————————。 (3)小芳在(2)实验中,还观察到有“灰黑色沉淀”这一异常现象出现。 【提出问题】铝与盐酸反应出现的灰黑色沉淀的组成是什么? 【查阅文献】铝在颗粒较小时为灰黑色;AlCl3为无色透明晶体或白色而微带浅黄色的固体,易溶于水和乙醇。 【提出合理假设】假设a:该灰黑色沉淀可能含有—————————————; 假设b:该灰黑色沉淀可能含有AlCl3; 假设c:该灰黑色沉淀可能含有难溶于酸的物质。 【设计并完成实验】取灰黑色沉淀分别进行如下实验。 实验编号 实验操作 实验现象 ① 加入适量稀盐酸 有微量气泡,固体全部溶解,得到澄清溶液 ② 加入适量蒸馏水 固体部分溶解 ③ 加入适量无水乙醇 固体部分溶解 【得出结论】由实验①可判断假设c————(填“成立”或“不成立”),再集合②和③可得出该灰黑色沉淀的成分是————————————————。 注意:若答对(4)小题奖励4分,但化学总分不超过60分。 (4)你认为①中小明的实验能否比较锌和铝的金属活动性强弱? ——————(填“能”或“不能”),分别从设计方法和操作可行性的角度,具体说明理由:——————————————— ———————————————————————————————————————————————————————————————————————。 (1)Zn+2HCl==ZnCl2+H2↑(2分) (2)未去膜的铝片表面有氧化铝(氧化膜),氧化铝先与盐酸反应(1分) (3)铝 (或铝和氯化铝1分),不成立(1分) ,铝和氯化铝(2分) (4)(本小题共奖励4分,化学总分不超过60分) 不能(1分),小明的实验方案中未控制金属的纯度,盐酸的浓度等相关变量相同(1分) 操作中难以做到铝片和锌粒的表面积相同(2分) 1. 在Cu(NO3) 2、A1(NO3) 3和AgNO3伍的混合溶液中加入一定量的铁粉,充分反应后过滤,向滤出的固体上滴加稀硫酸时有气泡产生。则反应后所得溶液中含有的金属离子有 ;反应后溶液的质量比原混合溶液的质量 (填“大”或“小”);有关反应的化学方程式为 (写出一个即可)。 Al3+ 和Fe2+ 小 Fe十2AgNO3=Fe(NO3) 2+2Ag 2. 金属是一类重要的材料,其应用十分厂—泛。 (1)铝的利用比铜和铁晚。金属大规模开发和利用的先后顺序与下列 有关。 甲.金属的活动性 乙.金属的导电性 丙.金屑在地壳中的含量 (2)相同的铁栏杆,为什么安装在南方沿诲地区比安装在北方更容易生锈? (3)写出用盐酸清洗铁锈(主要成分是Fe2O3)的化学方程式。 (1)甲 (2)铁在潮湿的空气中容易生锈,南方沿海地区的空气湿度较大且温度要高一些。 (3)Fe2O3+6HCl=2FeCl3十3H2O 3. 学习金属单元后,我们知道Zn、Fe、Cu三种金属的活动性顺序为:Zn>Fe>Cu。为验证这一结论,下面实验设计合理的是 A.将Zn、Cu两金属片分别放入稀盐酸中 B.将Fe、Cu两金属片分别放人稀盐酸中 C.将Zn、Fe两金属片分别放人CuCl2溶液中 D.将Zn、Cu两金属片分别放人FeCl2溶液中 4. 铁是生产和生活中使用最多的金属材料,下列关于铁的叙述不正确的是 A.铁生锈时生成四氧化三铁 B.表面涂漆以防止铁生锈 C.铁制品应放置于干燥的环境中 D.经常清扫铁器表面灰尘可以防止铁生锈 5. 某金属R与硝酸银溶液反应的化学方程式为:R + 2AgNO3 R(NO3)2 + 2Ag R与硝酸铜溶液不发生反应,关于R的推断正确的是 A. R的活泼性介于铜、银之间 B. R能置换出酸中的氢 C. R的活泼性比铜强 D. R的活泼性比铜强、银都弱 1. 把金属X放入Cu(NO3)2溶液中,X表面有红色固体析出;若放入Mg(NO3)2溶液中, 无明显现象。则X、Cu、Mg三种金属活动性由强到弱的顺序正确的是 ( ) A.Mg、X、Cu B.X、Mg、Cu C.Mg、Cu、X D.Cu、X、Mg 2. 乐乐同学是一个热爱劳动、善于观察的学生,在星期天帮助妈妈擦洗玻璃时,发现厨房 的钢窗比卧室的钢窗锈蚀严重。请回答: (1)产生这一现象的原因。 (2)在不拆掉此钢窗的前提下,如何防止钢窗进一步锈蚀? (3)金属资源储量有限且不能再生,为了保护金属资源,除防止金属的腐蚀外,你还有什 么合理的建议(答一点即可)? (1)厨房中水蒸气的含量比卧室中水蒸气含量高; 评分说明:厨房钢窗表面不洁净等答案合理即可。 (2)将铁锈除掉,在清洁和干燥的钢窗上刷上一层油漆; 评分说明:答出除锈和刷油漆等符合实际操作即可(但必须先除锈)。 (3)回收再利用。 评分说明: 答有计划、合理地开采矿物;废旧金属的回收和利用;寻找金属的替代品等答案合理即可。 3. 下列与金属有关的说法正确的是 A.生铁和钢都是铁的合金 B.废旧电池可以随意丢弃,不会对环境造成污染 C.银的导电性比铜强,所以一般用银作电线 D.铁矿石在地壳中含量最丰富,可以随意开采 4. 对A、B、C三种金属活动性的实验研究过程如下:(1)取大小相等的三种金属片,分别放入CuSO4溶液中,一段时间后,A、C表面出现红色物质,B表面没有现象。(2)取大小相等的A、C两种金属片,分别放入相同的稀盐酸中,A、C表面都产生气泡,但A产生气泡的速度明显比C的快。则A、B、C三种金属的活动性顺序是 A.A>C>B B.C>A>B C.C>B>A D.A>B>C 5. 某合金6g与足量的稀硫酸充分反应后,如果生成0.2g氢气,该合金中的元素可能是 A. Zn和Fe B. Cu和Au C. Zn和Cu D. Mg和Al 6. 南京市国民经济和社会发展第“十二五”规划纲要指出,要做强做优电子信息等工业支柱产业。硅(Si)是信息技术的关键材料,常用以下方法制得纯硅,如下图所示: ③ ② ① H2、高温 Cl2、加热 焦炭、高温 石英砂 粗硅 SiCl4 纯硅 (1)图中①、③发生了置换反应,②发生了化合反应。写出②和③的化学反应方程式: ② ; ③ 。 (2)完成一种表示置换反应的通式:单质(I)+化合物(I)=单质(Ⅱ)+ 。 根据已学知识填表: 单质(I) 单质(Ⅱ) 相应的置换反应的化学方程式(各举一例) A 金属 非金属 B 金属(I) 金属(Ⅱ) C 非金属 金属 D (1)② ③ (2)化合物 A. B. C. (A、B、C的其它合理答案均可给分) D. 非金属 非金属 1. 钢铁是使用最多的金属材料。 (1)钢是含碳量为0.03%~2%的铁 。如碳素钢(主要成分为铁和碳)等。 (2)【查阅资料】一般情况下,两种活动性不同的金属在潮湿的环境中接触时,活动性强的金属首先被腐蚀。 造船工业为了避免轮船的钢铁外壳被腐蚀,通常在轮船外壳镶嵌的金属是 (填编号)A.银块 B.铜块 C.锡块 D.锌块 (1)合金 (2)D 2. 根据金属活动性顺序分析,下列描述或判断正确的是 A.金属钾能与硫酸锌溶液发生化学反应得到金属锌 B.金属铁与硫酸溶液反应后所得溶液的质量比原溶液的质量增大 C.在常温下,铝比镁更容易与氧气发生化学反应 D.金属铜与氯化银反应得到金属银 3. 为了分析某生铁中铁的含量,学习小组的同学们进行了实验探究,即取6g 生铁与10%的盐酸反应,加入盐酸质量与放出气体质量的关系如下表。(说明:生铁中杂质不溶于水,也不与盐酸反应) 盐酸质量/g 36.5 73 109.5 146 气体质量/g 0.1 0.2 0.2 m (1)上述表格中m的值为 ; (2)该生铁中铁的质量分数为多少?(写出计算过程,最终结果保留到0.1%) (1)0.2 ················································1分 (2)解:设反应的铁的质量为X Fe + 2HCl = FeCl2 + H2↑ 56 2 X 0.2g ····························1分 56 X 2 0.2g X = 5.6g ·········································1分 (也可使用盐酸的质量关系,计算参加反应的铁) 生铁中铁的质量分数= 5.6g/6g×100% = 93.3%···············1分 (3)6克生铁中含有不溶性杂质,不能计算在溶液的质量之内。(说法合理均可)···1分 答:略 1. 废旧手机的某些部件中含有Mg、Al、Cu、Ag等金属,为了回收重金属,将旧手机的部件粉碎并浸入足量稀硫酸中充分反应过滤,所得固体中含有的金属是 A. Mg和Al B.Cu和Ag C. Al和Cu D.Mg和Ag 2. 小强同学分别取溶质质量分数相同的稀盐酸,大小、形状都相同的某种金属X、Al、Cu 进行实验,实验现象记录如下 Al X Cu 现象 开始时 几乎无气泡产生 产生气泡速度慢 无气泡产生 一段时间后 产生气泡速度快 产生气泡速度慢 无气泡产生 回答下列问题: (1)实验开始时,铝表面几乎无气泡产生的原因是_____________ _____ ____。 (2)Cu表面始终无气泡产生的原因是___________ _______。 (3)三种金属的活动性由强到弱的顺序是______ ____________。 (4)如果金属X的活动性比铁弱,且金属X与稀盐酸反应后生成易溶于水的XCl2。向只含有XCl2、CuCl2两种溶质的溶液中加入一定量的铁粉,充分反应后过滤,向滤出的固体中加入稀盐酸,没有气泡产生。则滤液中一定含有的金属阳离子是 (用离子符号表示)。 (1)铝表面有一层氧化铝薄膜 (2)铜不能与稀盐酸发生反应 (3)Al>X>Cu (4) Fe2+ 、X2+ 1. 我国钢铁产量多年居世界第一位,每年要进口大量的铁矿石,赤铁矿(主要成分是氧化铁)是其中的一种。 (1)氧化铁中铁元素的质量分数为 。 (2)1000t含氧化铁80%的赤铁矿石中,氧化铁的质量是____________t,用这些赤铁矿石理论上可以炼出含杂质4%的生铁 t(计算结果保留整数)。 (1)70% (1分) (2)800 (1分) 583 (2分) 2. 下列有关铁及其化合物的说法中错误的是 A.生铁和钢都是铁的合金 B.铁在潮湿的空气中容易生锈 C.地壳中含量最多的金属元素是铁元素 D.一氧化碳与氧化铁在高温下反应生成铁 3. 为了达到收旧利废节能减排的目的,从含有金属镁、铁、铜的粉末中,分离和提取出重要化工原料MgSO4和有关金属,实验过程如下: 请回答: (1)操作①中被磁铁吸引的金属A是 ;金属B是 。 (2)操作a的名称是 ;在蒸发过程中需要使用玻璃棒,其作用是 。 (3)写出步骤②所涉及的化学反应方程式: ,该反应发生的基本类型是: (4)实验步骤②中除了加入稀硫酸外,还可选用下列试剂 (填标号)。 a.硫酸铜溶液 b.氯化钠溶液 c.硝酸银溶液 (1)铁 铜(2)过滤 搅拌,使液体受热均匀防止液体溅出(3)H2SO4+Mg=MgSO4+H2 置换反应 (4)a 1. 下图是探究铁制品锈蚀的条件时做的五个实验(铁钉在不同环境中),实验一段时间后,得出的结论错误的是 A.甲、乙、戊中铁钉生锈快慢的顺序为:乙>甲>戊 B.丙中的铁钉不生锈 C.铁生锈的主要条件是与空气、水直接接触 D.丁中铁钉生锈最严重 2. 铁、铝、铜是常见的三种金属。同学们发现生活中的铝和铜制品表面一般不用防锈,而铁制品一般需要做防锈处理。 【提出问题】这是不是因为铁、铝、铜三种金属中铁的活动性最强呢? 【实验探究】同学们对这三种金属的活动性顺序展开了探究,请你参与探究并填写空格。 将粗细相同的铁丝、铝丝、铜丝分别插人体积相同、溶质质量分数也相同的稀盐酸中: 【讨论交流】为什么同一个实验得出了两种结论呢?同学们带着这个疑问查阅了相关资料,明白了铝丝在稀盐酸中短时间内无气泡,是因为铝表面致密的氧化膜会先与盐酸反应。 【反思评价】做金属性质实验时需将金属进行打磨,打磨的目的是 除去金属表面的氧化物 (或污物) 。 【实验验证】为了进一步确认铁、铝、铜这三种金属的活动性顺序,同学们又将两根粗细相同的、打磨过的铁丝分别插入硫酸铝溶液、硫酸铜溶液中: 写出铁与硫酸铜溶液反应的化学方程式 Fe+CuSO4==FeSO4+Cu (化学式错误扣2分) 。 【拓展迁移】(1)若只有一支盛有少量稀盐酸的试管,只需合理安排金属丝的插人顺序( 能与盐酸反应的要一次将盐酸消耗完),也能证明铁、铝、铜这三种金属的活动性顺序。金属丝的插入顺序为 Cu Fe Al(或铜 铁 铝)或Fe Cu Al(或铁 铜 铝) 。 (2)金属被人类大规模开发利用的大致年限也与金属活动性顺序有关,请写出铁、铝、铜三种金属材料被人类利用的先后顺序 Cu Fe Al(或铜 铁 铝) 。 1. 把相同质量、相同溶质质量分数的稀盐酸分别加入盛有X、Y、Z三种金属的试管中,只有Z始终无明显变化们X、Y表面都有气泡产生,但是Y产生气泡的速度明显比X的快。这三种金属的活动性顺序是 A. X>Y>Z B. X>Z>Y C. Z>Y>X D. Y>X>Z 2. 全世界每年被腐蚀损耗的钢铁材料约占全年钢铁产量的十分之一。铁生锈是铁和 、 等物质相互作用的结果。在生产生活中常用的防止铁制品生锈的方法有 (答一条即可)。若铁制品已腐蚀,应及时除去,写出用稀盐酸除去铁锈的化学方程式 。 O2(或氧气) H2O(或水) 刷漆(涂油、电镀金属等,合理答案均可) Fe2O3+6HCl===2FeCl3+3H2O 3. 下列关于合金的说法正确的是 A.合金不属于金届材料 B.合金的硬度一般比各成分金属大 C.合金属于金属单质 D.多数合金的熔点高于组成它的成分金属 4. 把金属X放入Cu(NO3)2溶液中,X表面有红色固体析出;若放入Mg(NO3)2溶液中, 无明显现象。则X、Cu、Mg三种金属活动性由强到弱的顺序正确的是 ( ) A.Mg、X、Cu B.X、Mg、Cu C.Mg、Cu、X D.Cu、X、Mg 5. 乐乐同学是一个热爱劳动、善于观察的学生,在星期天帮助妈妈擦洗玻璃时,发现厨房 的钢窗比卧室的钢窗锈蚀严重。请回答: (1)产生这一现象的原因。 (2)在不拆掉此钢窗的前提下,如何防止钢窗进一步锈蚀? (3)金属资源储量有限且不能再生,为了保护金属资源,除防止金属的腐蚀外,你还有什 么合理的建议(答一点即可)? (1)厨房中的水蒸气比卧室中的水蒸气含量高。 (2)将铁锈除掉,在清洁和干燥的钢窗上刷上一层油漆。 (3)回收利用。 6. 往AgNO3和Cu(NO3)2的混合液中加入一定量的铁粉,充分反应后过滤,向滤渣中加入稀盐酸,无气泡产生。根据上述现象,你得出的结论是( ) A.滤渣中一定有Fe粉 B. 滤渣中一定有Cu粉 C.滤液中一定有Fe2+ D. 滤液中一定有Ag+、Cu2+ 7. 钢铁是使用最多的金属材料。在今年的化学活动周中,某校兴趣小组的同学在老师指导下做了二个有关铁的实验。 实验一:用干燥纯净的一氧化碳还原氧化铁 实验装置如下图: A B C D E F 浓硫酸 加热 其中A是实验室用草酸(H2C2O4)和浓硫酸加热制取一氧化碳的气体发生装置,反应的化学方程式是:H2C2O4 H2O+CO2↑+CO↑。请回答下列问题: (1)B装置中发生反应的化学方程式是 . (2)C装置无明显现象,C装置的作用是 。 D装置中浓硫酸的作用是 。 (3)E装置中的实验现象是 。 (4)F装置的作用是 、 。 实验二:铝粉和氧化铁粉末反应(铝热反应) 实验装置如下图: 图中纸漏斗由两张滤纸折叠成漏斗状套在一起,使四周都有四层,点燃镁条后观察到的现象:镁条剧烈燃烧,发出耀眼的白光,放出大量的热,纸漏斗的下部被烧穿,有熔融物落入细沙中。 实验后老师作了如下提示:实验中镁条和氯酸钾的作用是提供反应所需的高温条件,铝粉和氧化铁粉末在高温条件下的反应叫铝热反应,属于置换反应,该反应常用于焊接钢轨。请写出该反应的化学方程式 。该反应中单质铝与一氧化碳有相似的 (填“氧化”或“还原”)性。 实验后同学们对金属与金属氧化物间的反应产生兴趣,激发了探究热情。 【提出问题】任何金属与金属氧化物在高温条件下都能反应吗? 同学们在请教老师后设计了如下实验方案并进行了探究。 【实验方案】 实验组别 实验操作 实验现象 结论 实验1 取Zn、CuO粉末的均匀混合物于密闭容器中,高温加热。 向冷却后的固体中加入足量的稀盐酸。 黑色粉末变成 色 固体部分溶解,有气泡产生,水溶液呈无色。 Zn和CuO能发生置换反应。 实验2 取Mg、CuO粉末的均匀混合物于密闭容器中,高温加热。 向冷却后的固体中加入足量的稀盐酸。 发生爆炸,黑色粉末变成红色。 固体部分溶解,有气泡产生,水溶液呈 色。 实验3 取Cu、Fe2O3粉末的均匀混合物于密闭容器中,高温加热。 粉末无变化 Cu、Fe2O3不能反应。 【实验总结】金属与金属氧化物在高温条件下有些能反应,有些不能反应。 【反思拓展】金属与金属氧化物在高温条件下反应的规律和金属与 的反应相似。 实验一 (1)2NaOH+CO2=Na2CO3+H2O (2)证明二氧化碳已被完全吸收 干燥一氧化碳气体 (3)红色粉末变成黑色 (4) 证明反应生成了二氧化碳 尾气处理 高温 实验二 2Al+Fe2O3 2Fe+Al2O3 还原 红 无 镁与氧化铜能发生置换反应 盐溶液 1. 实验室里,用如右图所示装置还原氧化铁的过程中,可能生成四氧化三铁、氧化亚铁或铁等固体物质。关于该实验,下列说法错误的是( ) A. 实验时,试管中澄清的石灰水变浑浊,证明该反应有二氧化碳生成 B.实验结束时,玻璃管中红色的氧化铁粉末变成黑色,该产物不一定是铁 C反应后,玻璃管中的固体物质的质量比反应前减少了,证明一定有铁生成 D.为了减少空气污染,应增加尾气处理装置 2. 探究活动一:在室温条件下进行如图所示实验。已知:试管内的镁条和铁片表面均被打磨洁净,且形状、大小均相同;同时加入两支试管中的稀盐酸的质量和质量分数均相等。 (1) 该实验的目的是________、________。两支长颈漏斗中产生的现象的不同之处是________。 (2) 若实验所用的金属均过量,则甲装置中产生的H2比乙装置中产生的H2质量________(填“多”、“少”或“相等”)。 (可能用到的相对原子质量:H-1O-16Mg-24Cl-35.5Fe-56) 探究活动二:为除去铜屑中混有的少量铁屑,并测定该混合物中铁的质量分数,现有如下A、B两组实验方案。 A:称取一定质量的样品 加入足量的稀盐酸 过滤、洗涤、干燥、称量所得固体质量 搅拌 B:称取一定质量的样品 加入足量的硫酸铜溶液 过滤、洗涤、干燥、称量所得固体质量 搅拌 (3)两种方案,你认为不能达到目的的是________(填“A”或“B”),理由是________。 (4)在你所选取的方案中,若采用加热烘干的方式干燥滤渣,会导致测定的铁的质量分数________(填“偏大”、“偏小”、“不变”或“无法判断”)。 (1)比较镁、铁与稀盐酸反应的剧烈程度 比较相同时间内镁、铁与稀盐酸反应放出热量的多少 甲装置长颈漏斗中的液面比乙装置中的高(2)相等 (3)B铁未被完全除尽 (4)偏小 1. 某活动小组根据下图所示进行模拟炼铁的实验,并对产物的成分进行探究。 Fe2O3 CO CO2 黑色 粉末A FeSO4溶液 CuSO4溶液 黑色粉末B 和红色固体 加入足量CuSO4溶液 过滤 高温 【提出问题】黑色粉末A可能是什么呢? 【进行猜想】(1)小明认为黑色粉末A全部是铁粉。请写出铁粉与CuSO4溶液反应的化学方程式 ▲ 。实验过程中采取了过滤,该操作中用到的玻璃仪器有 ▲ , ▲ 和玻璃棒,其中玻璃棒的作用是 ▲ 。 (2)小华认为小明的猜想是错误的,理由是 ▲ 。 (3)小华提出了猜想①和猜想②,请结合所学知识补充余下的一个猜想。 猜想①;黑色粉末A由铁粉和四氧化三铁(Fe3O4)组成 猜想②;黑色粉末A由铁粉和氧化亚铁(FeO)组成; 猜想③; ▲ 。 【查阅资料】铁的氧化物都能与稀盐酸,稀硫酸反应,其中氧化铁为红棕色,其余都为黑色,并且只有四氧化三铁能被磁铁吸引。 【实验探究】 方案 实验操作 可能的现象 结论 ① 取适量黑色粉末A 用磁铁吸引 黑色粉末全部被吸引 猜想①正确 ② 取适量黑色粉末A 用磁铁吸引 黑色粉末部分被吸引 猜想②正确 ③ 取适量黑色粉末B加入足量稀盐酸 黑色粉末全部溶解 猜想②正确 ④ ▲ ▲ 猜想③正确 【反思评价】小娟认为方案②和方案③中得出的结论都不正确,其理由是 ▲ 。 【得出结论】在高温下,一氧化碳和二氧化碳可生成铁,氧化亚铁,四氧化三铁。请写出只生成氧化亚铁的方程式 ▲ 。 【进行猜想】 (1)Fe + CuSO4 == FeSO4 + Cu;烧杯、漏斗;引流 (2)加入足量硫酸铜溶液反应后过滤,还有黑色粉末存在 (3)黑色粉末A由铁粉、氧化亚铁和四氧化三铁组成 【实验探究】取适量黑色粉末B用磁铁吸引;黑色粉末部分被吸引。 【反思评价】含有四氧化三铁时,也发生同样的现象 高温 【得出结论】CO + Fe2O3 ==== 2FeO + CO2 2. 下列金属中,活动性最弱的是 A.铝 B.铜 C.镁 D.铁 3. 铁及其合金在生产、生活中应用广泛。下列关于铁及其合金的说法中正确的是 (A)铁是地壳中含量最丰富的金属元素 (B)不锈钢的抗腐蚀性好,可用于制造医疗器械 (C)铁丝能在氧气中剧烈燃烧、火星四射,生成氧化铁 (D)铁生锈是铁与空气中的氧气、水发生缓慢氧化的过程 1. 下列比较金属活动性强弱的实验设计、现象和结论均正确的是 选项 实验设计 现象 结论(金属的活动性) A 将铝丝放人硫酸铜溶液中 无现象 Cu>Al B 分别将相同形状的镁条和铝条点燃放入盛氧气的集气瓶中 镁条燃烧得更剧烈 Mg>Al C 分别将锌粉与铁丝放入相同浓度的稀盐酸中 锌粉产生气泡的速率比铁丝快 Zn>Fe D 分别将铁丝与铜丝放入相同浓度的稀盐酸中 铁丝表面产生气泡,铜丝无现象 Fe>Cu 2. 下列有关说法不合理的是( ) A.“缺铁性贫血”里所说的铁不是单质铁 B.家用铝锅可以用来盛放酸性食物 C.防毒面具里的滤毒罐是利用活性炭来吸附毒气 D.可用盐酸除去铁锈 3. 已知:①常温常压下,A为无色液体,A在二氧化锰催化作用下分解为水和B,B是空气的组成成分之一。②C单质在足量的B中燃烧生成气体D,D能使澄清石灰水变浑浊。③C单质在不足量的B中燃烧生成有毒气体E,E与红色物质F的反应是工业炼铁的原理。请按要求填空: (1)A的化学式 。 (2)简述如何检验B 。 (3)B与C生成D基本类型是 反应。 (4)完成E与F反应的化学方程式 。 (1)H2O2。 高温 (2)用带火星的木条伸入盛B气体的集气瓶中,如果带火星的木条复燃,说明瓶中是氧气,如果带火星的木条不复燃,说明瓶中的气体不是氧气。 (3)化合反应。(4)3CO+Fe2O3========3CO2+2Fe。 4. 将a、b、c三种金属分别投入稀盐酸中,只有b溶解并产生气泡;把a和c分别放入硫酸铜溶液中,在a表面有铜析出,c没有变化。则a、b、c的金属活动性顺序是 A.c>b>a B.b>a>c C.a>c>b D. b>c>a 5. 铝、铁、铜是人类广泛使用的三种金属,与我们生活息息相关。 (1)按人类开始使用这三种金属的先后排序为 (用元素符号表示)。 (2)在空气中 制品(填“铝”或“铁”)更耐腐蚀。 (3)用下列试剂验证这三种金属的活动性顺序,能达到目的的是 (填序号)。A.硫酸铝溶液 B.硫酸亚铁溶液 C.硫酸铜溶液 (4)人们大量使用的是合金而不是纯金属,这是因为合金具有更多优良性能,例如钢比纯铁硬度 (填“大”或“小”)。 (1)Cu Fe Al(1分)(2)铝(1分)(3)B(1分)(4)大(1分) 1. 2011年是国际化学年(IYC2011),其宗旨是“增进公众对化学重要性的认识,鼓励青年人热爱化学,学习和研究化学”。某校化学兴趣小组的同学,对课本中一氧化碳还原氧化铁实验作了绿色化改进后制取单质铁(K1,K2是活塞): (1)关闭K1、开启K2,可以验证CO还原Fe2O3的产物。 ①这是关于气体的实验,实验前必须对装置进行 ② CO还原Fe2O3的化学方程式为 ③在e处点燃气体的目的是 (2)关闭K2,开启K1,可以将d口出来的气体再从a通人装置而循环使用。 ① c瓶中应装 (填序号)。 A.澄清石灰水 B.水C.石蕊溶液 D.浓硫酸 ②反应完后(假设b瓶中NaOH全部转化为纯碱),要从b瓶中溶液得到纯碱固体,必要的实验操作为转移、 结晶。 ③该实验这样改进的主要优点是 (1)①气密性检查(1分)②3CO+Fe2O3 2Fe+3CO2(1分)③防止污染空气(1分)(2)① D(1分)②蒸发(1分)③减少碳的排放,提高原料利用率(2分,合理给分) 2. 为建设“两型社会”,株洲市政府实施“动力之都、绿色出行”工程,倡导市民骑自行车出行,下列说法不正确的是 A.此工程的目的是为了方便出行、节能减排,减少对环境的污染 B.自行车轮胎属于有机高分子材料 C.制造自行车支架使用的材料是纯金属而不是合金 D.自行车的构件采取了涂油、喷油漆、电镀等防锈措施 3. 下列有关实验现象描述错误的是 A.氢气在空气中燃烧产生淡蓝色火焰 B.将带火星的木条伸入集满二氧化碳的集气瓶中,木条复燃 C.镁条在空气中燃烧,发出耀眼的白光 D.将铝丝浸入硫酸铜溶液中,铝丝表面产生紫红色物质 4. 金属单质家族四兄弟W、X、Y、Z,不小心掉入稀盐酸池,神情如图所示: W皮肤起泡 X咬牙在叫 Y偷偷在笑 Z又哭又跳 稀盐酸池 则W、X、Y、Z的金属活动性顺序为 A.X>W>Z>Y B.Z>X>W>Y C.W>X>Y>Z D.Y>Z>X>W 5. 金属材料被广泛的应用于我们的生活中,不仅是因为其物理性能优良,还与它们的化学性质密切相关。下面是小明同学设计测定金属铁、铜和镁的活动性的探究实验过程和实验记录,请你一起探究。 【实验目的】 测定金属铁、铜和镁的活动性强弱 【所用试剂】 稀硫酸、硝酸银溶液、光亮的薄铁片、薄铜片、薄镁片 【实验过程】 步骤Ⅰ 将铁片、铜片、镁片分别在空气中点燃片刻,观察燃烧现象; 步骤Ⅱ 将铁片、铜片、镁片分别放入三只盛有溶质质量分数相同、体积相同的稀硫酸的试管中; 实验现象记录表 金属 空气 稀硫酸 硝酸银溶液 铁 — √ √ 铜 — — √ 镁 √ √ √ 步骤Ⅲ 将铁片、铜片、镁片分别放入三只盛有溶质质量分数相同、体积相同的硝酸银溶液的试管中。 【实验记录】用“√”表示能观察到实验现象,用“—”表示观察不到实验现象(见右表)。 ⑴通过步骤Ⅰ可以得出三种金属中镁的金属活动性最强,判断依据是 ⑵运用“控制变量法”设计实验方案是化学研究的重要方法。步骤Ⅱ和步骤Ⅲ中,需要控制的实验条件除了金属的体积、溶液的体积、溶质质量分数以外,还需要控制的条件是 。写出镁和稀硫酸反应的化学方程式 ,此反应属于 。 【实验结论】金属铁、铜和镁的活动性由强到弱的顺序是 (用元素符号表示) 【反思交流】 若利用上述试剂制取氢气,小明认为应该选择金属铁和稀硫酸反应,而不选择金属镁和稀硫酸反应,他的理由是 。 ⑴在空气中,镁能和氧气反应的最剧烈 ⑵溶液的种类 Mg+H2SO4=MgSO4+H2↑ 置换反应 Mg Fe Cu Mg和H2SO4反应速度太快,不易控制 1. 为预防自行车生锈,下列做法中不合理的是 A.车架表面喷涂油漆 B.钢圈表面镀防护金属 C.链条表面涂机油 D.露天放置,日晒雨淋 2. 下列金属中,活动性最强的是 A.镁 B.铜 C.锌 D.铝 3. 人类的生产和生活都离不开金属。 (1)金属元素在自然界中分布很广,地壳中含量最多的金属元素是____________。金属以矿物形式存在,下列矿石的主要成分属于氧化物的是___________(填化学式)。 (2)铁是应用最广泛的金属。 ①工业常用赤铁矿和一氧化碳在高温条件下炼铁,该反应的化学方程式为__________________。 ②使用过的菜刀、铁锅等铁制品,清洗后需要及时擦干放置,可以减少___________对铁锈蚀的影响。 (3)将一定量的锌加入到稀硫酸、硫酸亚铁和硫酸铜的混合液中,充分反应后过滤,向滤渣中加入稀盐酸,有气泡产生。滤渣和滤液中一定含有的物质是____________。 (1)铝 Fe2O3 Al2O3(2)①3CO+Fe2O33CO2+2Fe②空气(3)铁和硫酸锌 1. 相同质量的M、N两种活泼金属,分别与足量的稀盐酸在室温下发生反应(M、N在生成物中的化合价为均为+2价),生成H2的质量m和反应时间t的关系如右下图所示。 ⑴金属活动顺序是M比N (填“强”或“弱”);相对原的相对原子质量是M比N的 (填“大”或“小”)。 ⑵M与稀盐酸反应结束后,消耗稀盐酸中溶质的质量为 g。 ⑴强;小。⑵36.5 2. 把某稀硫酸分为等体积的两份,放入两个烧杯中,分别加 入等质量的甲、乙两种金属,反应后金属都没有剩余。产生H2 的质量随时间变化的趋势如图。下列说法正确的是 A.甲的活动性比乙强 B.甲的相对原子质量一定比乙小 C.反应消耗等质量的硫酸 D.反应消耗等质量的金属 3. 已知:①金属钠是一种活泼的金属,与水反应生成氧氧化钠和氢气;②难溶于水的碱受热分解生成相应的氧化物和水。A、B、C、D、E、F、G、H是初中化学中常见的物质,甲、乙、丙是三种金属。其中甲最活泼,乙是红色金属,丙能被磁铁吸引。各物质间相互转化关系如下图: Na2SO4溶液 无色液体A 金属甲 无色液体A 无色溶液D 无色气体C 无色气体B 金属乙 △ 黑色粉末E 黑色粉末E H2SO4溶液 蓝色溶液F 黑色粉末E △ 无色液体A 金属乙 浅绿色液体G 蓝色溶液F 操作X 蓝色沉淀H △ 无色液体A 请回答下列问题: (1)写出A、E、G的化学式:A ▲ ,E ▲ ,G ▲ 。 (2)操作X的名称是 ▲ 。 (3)①无色溶液D与蓝色溶液F反应的化学方程式为 ▲ ; ②金属甲与无色液体A反应的化学方程式为 ▲ ,该反应的基本类型 ▲ ; ③蓝色沉淀H受热分解反应的化学方程式为 ▲ 。 (4)甲、乙、丙三种金属的活动性由强到弱的顺序是 ▲ ,无色气体C在点燃或加热前必须进行的操作是 ▲ 。 (1) A:H2O E:CuO G:FeSO4 (2) 过滤 (3) ①2NaOH+CuSO4=Na2SO4+Cu(OH)2↓ ②2Na+2H2O=2NaOH+H2↑ 置换反应 △ ③Cu(OH)2====CuO+H2O (4) 甲丙乙 检验气体的纯度或验纯查看更多