- 2021-04-25 发布 |
- 37.5 KB |
- 3页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
物质的分类及转化(第课时)教学设计(1)
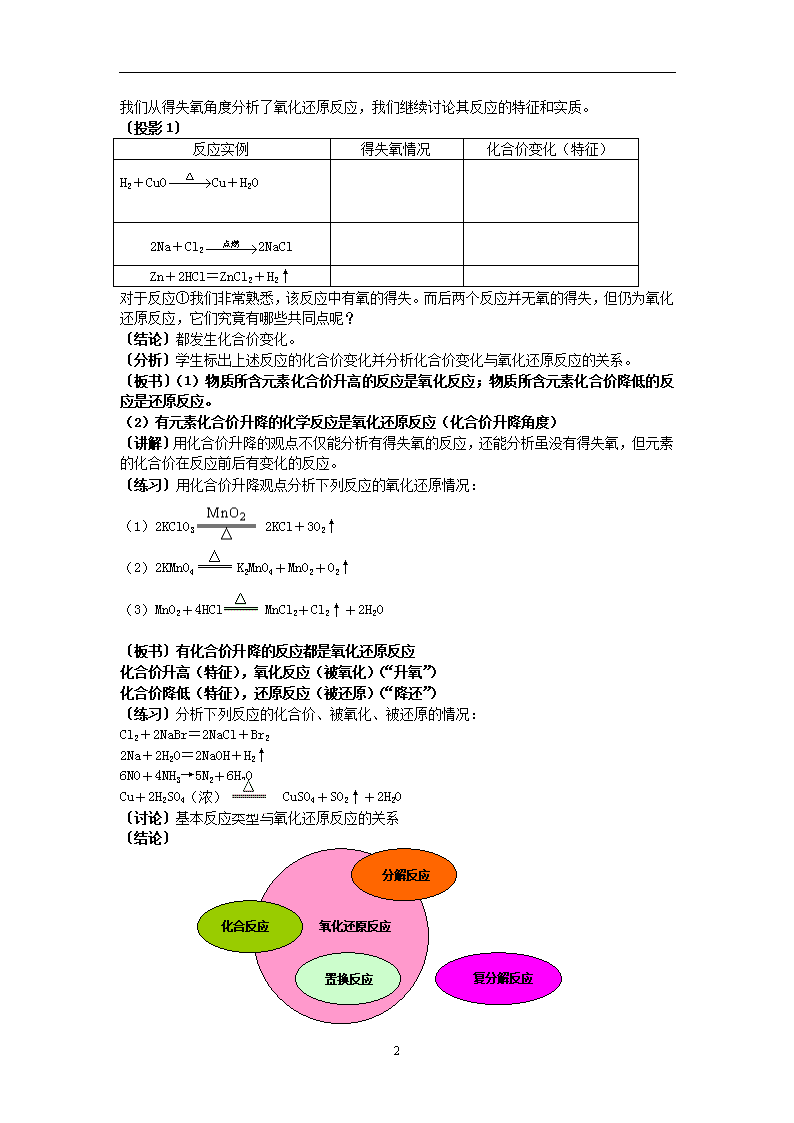
物质的分类及转化 教学设计 第二课时 氧化还原反应 教学目的: 1. 在复习四种基本反应类型以及从得氧、失氧角度划分氧化反应和还原反应的基础上,使学生进一步了解化学反应的分类方法。 2. 使学生学会用化合价升降的观点来理解氧化还原反应,并学会利用“双线桥”分析氧化还原反应。 3. 培养学生使用已经掌握的知识,通过分析、理解,形成解决问题的思路和方法 4. 对学生进行对立统一等辩证唯物主义观点的教育。用发展的观点,以科学的态度来学习化学。 教学重点:用化合价升降的观点来理解氧化还原反应。 教学难点:用化合价升降的观点来分析氧化还原反应 教学方法:质疑、讨论法 〔引入〕上节课我们以反应物和生成物的类型及反应前后物质种类的多少,将化学反应分为四种基本反应类型。 〔问〕Fe2O3+3CO2Fe+3CO2属于什么基本反应类型?(都不是) 上述分类方法有局限性,不能包括所有的化学反应。这类反应的实质是什么?下面我们来进一步研究。 〔板书〕 氧化还原反应 〔问题〕各写出一个符合要求条件的化学方程式 ①两种单质化合;两种化合物化合;单质与化合物化合。 ②一种物质分解成两种物质;一种物质分解成三种物质。 ③非金属置换非金属单质;金属单质置换金属单质。 ④复分解反应:氧化物与酸;氧化物与碱;酸与碱;酸与盐;盐与盐。 (练习,讲评) 〔问〕反应:C+O2CO2 ,C+2CuO2Cu+CO2↑除属于基本反应类型中的化合反应和置换反应之外,还属于什么反应类型?(氧化和还原反应) 从得失氧角度分析:(学生回答) 〔讨论〕从得失氧角度分析下列三个反应: 反应 氧化反应 还原反应 基本反应类型 H2+CuOCu+H2O C+2CuO2Cu+CO2↑ CO+CuOCu+CO2↑ 否 ①氧化反应与还原反应是孤立存在还是同时存在? ②若2Na+Cl22NaCl也属于氧化还原反应,是否符合上述定义?(不符合) 〔结论〕化学反应有多种分类方法。 氧化反应与还原反应必定同时发生,称为氧化还原反应,在初中所学的定义有局限性。 3 我们从得失氧角度分析了氧化还原反应,我们继续讨论其反应的特征和实质。 〔投影1〕 反应实例 得失氧情况 化合价变化(特征) H2+CuOCu+H2O 2Na+Cl22NaCl Zn+2HCl=ZnCl2+H2↑ 对于反应①我们非常熟悉,该反应中有氧的得失。而后两个反应并无氧的得失,但仍为氧化还原反应,它们究竟有哪些共同点呢? 〔结论〕都发生化合价变化。 〔分析〕学生标出上述反应的化合价变化并分析化合价变化与氧化还原反应的关系。 〔板书〕(1)物质所含元素化合价升高的反应是氧化反应;物质所含元素化合价降低的反应是还原反应。 (2)有元素化合价升降的化学反应是氧化还原反应(化合价升降角度) 〔讲解〕用化合价升降的观点不仅能分析有得失氧的反应,还能分析虽没有得失氧,但元素的化合价在反应前后有变化的反应。 〔练习〕用化合价升降观点分析下列反应的氧化还原情况: (1)2KClO3 2KCl+3O2↑ (2)2KMnO4 K2MnO4+MnO2+O2↑ (3)MnO2+4HCl MnCl2+Cl2↑+2H2O 〔板书〕有化合价升降的反应都是氧化还原反应 化合价升高(特征),氧化反应(被氧化)(“升氧”) 化合价降低(特征),还原反应(被还原)(“降还”) 〔练习〕分析下列反应的化合价、被氧化、被还原的情况: Cl2+2NaBr=2NaCl+Br2 2Na+2H2O=2NaOH+H2↑ 6NO+4NH3→5N2+6H2O Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O 〔讨论〕基本反应类型与氧化还原反应的关系 〔结论〕 置换反应 氧化还原反应 化合反应 分解反应 复分解反应 3 〔小结〕本节内容 依据化合价是否变化将化学反应分为氧化还原反应和非氧化还原反应 〔布置作业〕用化合价升降观点分析下列氧化还原反应 1.C+2H2SO4(浓) CO2↑+2SO2↑+2H2O 2.2SO2+O2→2SO3 3. 2KClO3 2KCl+3O2↑ 4.Fe+Cu2+=Fe2++Cu 5.2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O 6.2HClO→2HCl+O2↑ 7.Cl2+H2O=HCl+HClO 8.Cl2+2NaOH=NaCl+NaClO+H2O 课后记 3查看更多