- 2021-04-25 发布 |
- 37.5 KB |
- 20页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
北京市2021高考化学一轮复习专题二元素及其化合物第8讲金属材料及金属矿物的开发利用课件
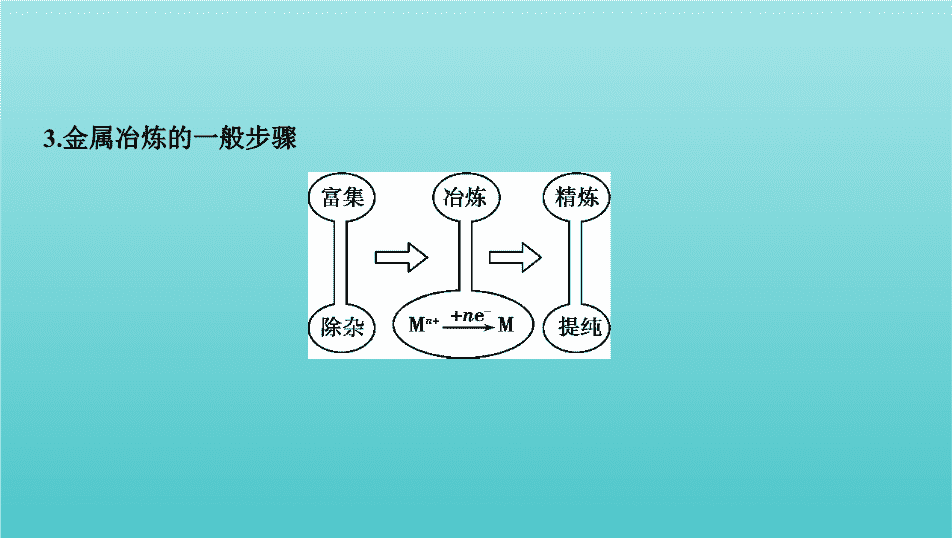
第8讲 金属材料及金属矿物的开发利用 一、金属矿物的开发和利用 教材研读 1.金属在自然界中存在的形态 除了金、铂等极少数金属外,绝大多数金属以化合物的形式存在于自然界 中。在这些金属化合物中,金属元素都显正化合价。 2.金属冶炼的实质 使金属化合物中的金属离子得到电子被还原为金属单质的过程:M n + + n e - M。 3.金属冶炼的一般步骤 4.金属冶炼的方法 (1)热分解法 例如:2HgO 2Hg+O 2 ↑,2Ag 2 O 4Ag+O 2 ↑。 用热分解法冶炼金属的特点:金属元素的金属性较弱,金属元素的原子不易失 去电子,对应的金属离子容易得到电子,该金属元素所形成的化合物稳定性较 差。 (2)热还原法 a.焦炭还原法。例如:C还原ZnO、CuO,化学方程式依次为C+2ZnO 2Zn+ CO 2 ↑、① C+2CuO 2Cu+CO 2 ↑ 。 b.一氧化碳还原法。例如:CO还原Fe 2 O 3 、CuO,化学方程式依次为 ② 3CO+Fe 2 O 3 2Fe+3CO 2 、CO+CuO Cu+CO 2 。 c.氢气还原法。例如:H 2 还原WO 3 、Fe 3 O 4 ,化学方程式依次为3H 2 +WO 3 W+3H 2 O、③ 4H 2 +Fe 3 O 4 3Fe+4H 2 O 。 d.活泼金属还原法。例如:Al还原Cr 2 O 3 、V 2 O 5 ,化学方程式依次为2Al+Cr 2 O 3 Al 2 O 3 +2Cr、10Al+3V 2 O 5 6V+5Al 2 O 3 。 (3)电解法 例如:电解熔融Al 2 O 3 、MgCl 2 、NaCl制Al、Mg、Na,化学方程式依次为 ④ 2Al 2 O 3 (熔融) 4Al+3O 2 ↑ 、MgCl 2 (熔融) Mg+Cl 2 ↑、2NaCl(熔 融) 2Na+Cl 2 ↑。 自测1 判断正误,正确的画“√”,错误的画“ ✕ ”。 (1)炼铁:用焦炭和空气反应产生的CO在高温下还原铁矿石中铁的氧化物 ( √ ) (2)炼铜:用黄铜矿经电解精炼得到纯度为99.9%的铜 ( ✕ ) (3)制镁:电解MgCl 2 溶液或MgO制取金属镁 ( ✕ ) (4)制铝:电解熔融AlCl 3 制取金属铝 ( ✕ ) 自测2 将金属与冶炼金属的方法搭配起来。 ①以C、CO或H 2 作还原剂冶炼 ②用活泼金属Na冶炼 ③利用铝热反应原理冶炼 ④电解法 ⑤热分解法 (1)Fe、Zn、Cu等金属 。 (2)Na、Mg、Al等活泼或较活泼金属 。 (3)Hg、Ag等不活泼金属 。 (4)V、Cr、Mn等高熔点金属 。 (5)K、Rb、Ti等金属 。 答案 (1)① (2)④ (3)⑤ (4)③ (5)② 二、合金及常见金属材料 1.合金 2.常见金属材料 (1)重要的黑色金属材料——钢 钢是用量最大、用途最广的合金。 (2)铜合金 常见的铜合金主要包括⑤ 青铜 、黄铜和白铜等。 自测3 判断正误,正确的画“√”,错误的画“ ✕ ”。 (1)铝合金的熔点比纯铝的高 ( ✕ ) (2)合金中不可能含有非金属元素 ( ✕ ) (3)纯铁比生铁抗腐蚀性强 ( √ ) (4)合金中各元素的含量一定,所以合金是纯净物 ( ✕ ) 自测4 下列关于金属的说法中,不正确的是 ( D ) A.合金比纯金属具有更好的性能,合金的熔点一般比其各成分金属的低 B.一般情况下,合金的硬度大于其各成分金属的硬度 C.常用电解法冶炼钠、镁、铝等活泼金属 D.由于铝在常温下不能与氧气反应,所以铝制品具有一定的抗腐蚀性,是一种 应用广泛的金属材料 答案 D A项,合金的熔点一般比其各成分金属的低;B项,一般情况下,合金 的硬度比其各成分金属的大;C项,活泼金属常用电解法冶炼,如钠、镁、铝 等;D项,铝在常温下易与氧气反应,并在其表面形成一层致密的氧化铝保护 膜,所以铝制品具有一定的抗腐蚀性。 自测5 某化学兴趣小组对奥运会金牌成分提出猜想:甲认为金牌是由纯金 制成的;乙认为金牌是由金银合金制成的;丙认为金牌是由黄铜(铜锌合金)制 成的。为了验证他们的猜想,请你选择一种试剂来证明甲、乙、丙猜想的正 误 ( B ) A.硫酸铜溶液 B.稀硝酸 C.盐酸 D.硝酸银溶液 答案 B 纯金遇到稀硝酸不溶解;金银合金遇到稀硝酸会部分溶解;黄铜遇 到稀硝酸会全部溶解。 考点 金属活动性顺序及其应用 考点突破 典例1 下列各选项中,不能利用置换反应通过Y得到W的一组化合物是 ( D ) 答案 D CO 2 与Mg发生置换反应,可生成MgO;Fe 2 O 3 与Al发生铝热反应可 生成Al 2 O 3 ,该反应为置换反应;SiO 2 与C发生置换反应,可生成CO;FeCl 3 和Cu反 应生成FeCl 2 和CuCl 2 ,不是置换反应。 1-1 镁铝合金质优体轻,又不易锈蚀,大量用于航空工业、造船工业、日用 化工等领域。下列关于镁铝合金性质的叙述中正确的是 ( B ) A.此合金的熔点比镁和铝的熔点都高 B.此合金能全部溶解于稀盐酸中 C.此合金能全部溶解于氢氧化钠溶液中 D.此合金不能全部溶于过量FeCl 3 溶液中 答案 B 合金的熔点一般低于组成它的成分金属,镁铝合金具有镁、铝的 化学性质,只有B正确。 1-2 氧化还原反应广泛应用于金属的冶炼。下列说法不正确的是 ( C ) A.冶炼铁的主要原料有铁矿石、焦炭、空气、石灰石等,其中石灰石的作用 是除去铁矿石中的脉石(二氧化硅) B.湿法炼铜与火法炼铜的反应中,铜元素都发生还原反应 C.工业上Mg可由电解熔融的MgO制取,Na可由电解熔融的NaCl制取 D.铝热法还原铁的反应中,放出的热量能使铁熔化 答案 C 工业上用电解熔融MgCl 2 的方法冶炼金属镁。 1-3 (2016课标Ⅲ,7,6分)化学在生活中有着广泛的应用,下列对应关系 错误 的是 ( B ) 化学性质 实际应用 A Al 2 (SO 4 ) 3 和小苏打反应 泡沫灭火器灭火 B 铁比铜金属性强 FeCl 3 腐蚀Cu刻制印刷电路板 C 次氯酸盐具有氧化性 漂白粉漂白织物 D HF与SiO 2 反应 氢氟酸在玻璃器皿上刻蚀标记 答案 B FeCl 3 与Cu的反应为2FeCl 3 +Cu 2FeCl 2 +CuCl 2 ,不能用来比较铁 与铜的金属性强弱,故错误。查看更多