- 2021-04-23 发布 |
- 37.5 KB |
- 14页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考江苏化学含答案
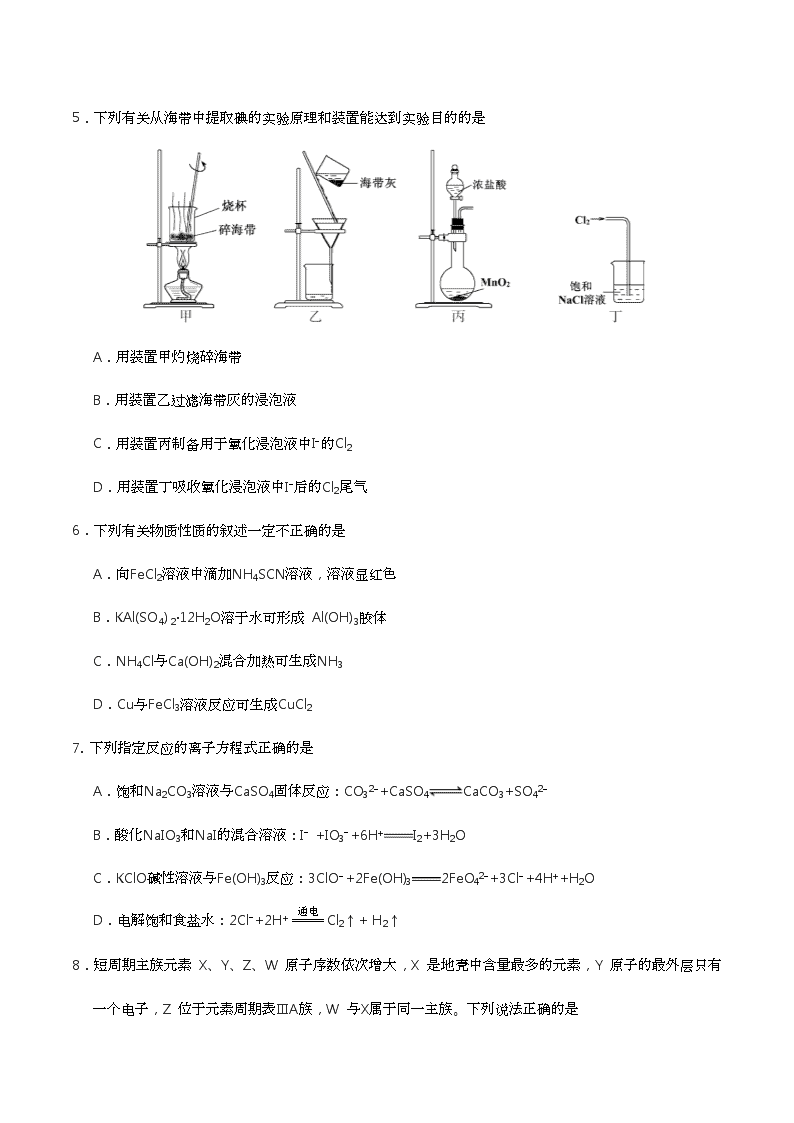
2018年普通高等学校招生全国统一考试(江苏卷)化学 可能用到的相对原子质量: H 1 C 12 N 14 O 16 Na 23 Mg 24 Al 27 S 32 Cl 35. 5 Ca 40 Fe 56 Cu 64 Ag 108 I 127 Ba 137 总分120 单项选择题:本题包括10 小题,每小题2 分,共计20 分。每小题只有一个选项符合题意。 1.CO2是自然界碳循环中的重要物质。下列过程会引起大气中CO2含量上升的是 A.光合作用 B.自然降雨 C.化石燃料的燃烧 D.碳酸盐的沉积 2.用化学用语表示 NH3+ HClNH4Cl中的相关微粒,其中正确的是 A.中子数为8 的氮原子: B.HCl 的电子式: C.NH3的结构式: D.Cl−的结构示意图: 3.下列有关物质性质与用途具有对应关系的是 A.NaHCO3受热易分解,可用于制胃酸中和剂 B.SiO2熔点高硬度大,可用于制光导纤维 C.Al2O3是两性氧化物,可用作耐高温材料 D.CaO能与水反应,可用作食品干燥剂 4.室温下,下列各组离子在指定溶液中能大量共存的是 A.0. 1 mol·L−1KI 溶液:Na+、K+、ClO− 、OH− B.0. 1 mol·L−1Fe2(SO4)3溶液:Cu2+、NH4+ 、NO3−、SO42− C.0. 1 mol·L−1HCl 溶液:Ba2+、K+、CH3COO−、NO3− D.0. 1 mol·L−1NaOH溶液:Mg2+、Na+、SO42− 、HCO3− 5.下列有关从海带中提取碘的实验原理和装置能达到实验目的的是 A.用装置甲灼烧碎海带 B.用装置乙过滤海带灰的浸泡液 C.用装置丙制备用于氧化浸泡液中I−的Cl2 D.用装置丁吸收氧化浸泡液中I−后的Cl2尾气 6.下列有关物质性质的叙述一定不正确的是 A.向FeCl2溶液中滴加NH4SCN溶液,溶液显红色 B.KAl(SO4) 2·12H2O溶于水可形成 Al(OH)3胶体 C.NH4Cl与Ca(OH)2混合加热可生成NH3 D.Cu与FeCl3溶液反应可生成CuCl2 7. 下列指定反应的离子方程式正确的是 A.饱和Na2CO3溶液与CaSO4固体反应:CO32−+CaSO4CaCO3+SO42− B.酸化NaIO3和NaI的混合溶液:I− +IO3−+6H+I2+3H2O C.KClO碱性溶液与Fe(OH)3反应:3ClO−+2Fe(OH)32FeO42−+3Cl−+4H++H2O D.电解饱和食盐水:2Cl−+2H+Cl2↑+ H2↑ 8.短周期主族元素 X、Y、Z、W 原子序数依次增大,X 是地壳中含量最多的元素,Y 原子的最外层只有一个电子,Z 位于元素周期表ⅢA族,W 与X属于同一主族。下列说法正确的是 A.原子半径:r(W) > r(Z) > r(Y) B.由X、Y 组成的化合物中均不含共价键 C.Y 的最高价氧化物的水化物的碱性比Z的弱 D.X 的简单气态氢化物的热稳定性比W的强 9.在给定条件下,下列选项所示的物质间转化均能实现的是 10.下列说法正确的是 A.氢氧燃料电池放电时化学能全部转化为电能 B.反应4Fe(s)+3O2(g)2Fe2O3(s)常温下可自发进行,该反应为吸热反应 C.3 mol H2与1 mol N2混合反应生成NH3,转移电子的数目小于6×6.02×1023 D.在酶催化淀粉水解反应中,温度越高淀粉水解速率越快 不定项选择题:本题包括5 小题,每小题4 分,共计20 分。每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题得0 分;若正确答案包括两个选项,只选一个且正确的得2 分,选两个且都正确的得满分,但只要选错一个,该小题就得0 分。 11.化合物Y 能用于高性能光学树脂的合成,可由化合物X与2 −甲基丙烯酰氯在一定条件下反应制得: 下列有关化合物X、Y 的说法正确的是 A.X 分子中所有原子一定在同一平面上 B.Y与Br2的加成产物分子中含有手性碳原子 C.X、Y均不能使酸性KMnO4溶液褪色 D.X→Y的反应为取代反应 12.根据下列实验操作和现象所得出的结论正确的是 选项 实验操作和现象 结论 A 向苯酚浊液中滴加Na2CO3溶液,浊液变清 苯酚的酸性强于H2CO3的酸性 B 向碘水中加入等体积CCl4,振荡后静置,上层接近无色,下层显紫红色 I2在CCl4中的溶解度大于在水中的溶解度 C 向CuSO4溶液中加入铁粉,有红色固体析出 Fe2+的氧化性强于Cu2+的氧化性 D 向NaCl、NaI的混合稀溶液中滴入少量稀AgNO3溶液,有黄色沉淀生成 Ksp(AgCl) >Ksp(AgI) 13.根据下列图示所得出的结论不正确的是 A.图甲是CO(g)+H2O(g)CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0 B.图乙是室温下H2O2催化分解放出氧气的反应中c(H2O2 )随反应时间变化的曲线,说明随着反应的进行H2O2分解速率逐渐减小 C.图丙是室温下用0.1000 mol·L−1NaOH溶液滴定20.00 mL 0.1000 mol·L−1某一元酸HX的滴定曲线,说明HX是一元强酸 D.图丁是室温下用Na2SO4除去溶液中Ba2+达到沉淀溶解平衡时,溶液中c(Ba2+ )与c(SO42−)的关系曲线,说明溶液中c(SO42− )越大c(Ba2+ )越小 14.H2C2O4为二元弱酸,Ka1 (H2C2O4 ) =5.4×10−2,Ka2 (H2C2O4 ) =5.4×10−5,设H2C2O4溶液中c(总)=c(H2C2O4) +c(HC2O4−) +c(C2O42−)。室温下用NaOH溶液滴定25.00 mL 0.1000 mol·L−1H2C2O4溶液至终点。滴定过程得到的下列溶液中微粒的物质的量浓度关系一定正确的是 A.0.1000 mol·L−1 H2C2O4溶液:c(H+ ) =0.1000 mol·L−1+c(C2O42− )+c(OH−)−c(H2C2O4 ) B.c(Na+ ) =c(总)的溶液:c(Na+ ) >c(H2C2O4 ) >c(C2O42− ) >c(H+ ) C.pH = 7的溶液:c(Na+ ) =0.1000 mol·L−1+ c(C2O42−) −c(H2C2O4) D.c(Na+ ) =2c(总)的溶液:c(OH−) −c(H+) = 2c(H2C2O4) +c(HC2O4−) 15.一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应2SO2(g)+ O2(g)2SO3(g)(正反应放热),测得反应的相关数据如下: 下列说法正确的是 A.v1< v2,c2< 2c1 B.K1> K3,p2> 2p3 C.v1< v3,α1(SO2 ) >α3(SO2 ) D.c2> 2c3,α2(SO3 )+α3(SO2 )<1 非 选 择 题 16.(12分)以高硫铝土矿(主要成分为Al2O3、Fe2O3、SiO2,少量FeS2和金属硫酸盐)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如下: (1)焙烧过程均会产生SO2,用NaOH溶液吸收过量SO2的离子方程式为______________________。 (2)添加1%CaO和不添加CaO的矿粉焙烧,其硫去除率随温度变化曲线如题16图所示。 已知:多数金属硫酸盐的分解温度都高于600 ℃ 硫去除率=(1—)×100% ①不添加CaO的矿粉在低于500 ℃焙烧时,去除的硫元素主要来源于__________________。 ②700℃焙烧时,添加1%CaO的矿粉硫去除率比不添加CaO的矿粉硫去除率低,其主要原因是______________________________________________________。 (3)向“过滤”得到的滤液中通入过量CO2,铝元素存在的形式由_______________(填化学式)转化为_______________(填化学式)。 (4)“过滤”得到的滤渣中含大量的Fe2O3。Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2,理论上完全反应消耗的n(FeS2)∶n(Fe2O3)=__________________。 17.(15分)丹参醇是存在于中药丹参中的一种天然产物。合成丹参醇的部分路线如下: 已知: (1)A中的官能团名称为__________________(写两种)。 (2)DE的反应类型为__________________。 (3)B的分子式为C9H14O,写出B的结构简式:__________________。 (4)的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:_________。 ①分子中含有苯环,能与FeCl3溶液发生显色反应,不能发生银镜反应; ②碱性条件水解生成两种产物,酸化后分子中均只有2种不同化学环境的氢。 (5)写出以和为原料制备的合成路线流程图(无机试剂和乙醇任用,合成路线流程图示例见本题题干)。 18.(12分)碱式硫酸铝溶液可用于烟气脱硫。室温下向一定浓度的硫酸铝溶液中加入一定量的碳酸钙粉末,反应后经过滤得到碱式硫酸铝溶液,反应方程式为 (2−x)Al2(SO4)3+3xCaCO3+3xH2O2[(1−x)Al2(SO4)3·xAl(OH)3]+3xCaSO4↓+3xCO2↑ 生成物(1−x)Al2(SO4)3·xAl(OH)3中x值的大小影响碱式硫酸铝溶液的脱硫效率。 (1)制备碱式硫酸铝溶液时,维持反应温度和反应时间不变,提高x值的方法有___________________。 (2)碱式硫酸铝溶液吸收SO2过程中,溶液的pH___________(填“增大”、“减小”、“不变”)。 (3)通过测定碱式硫酸铝溶液中相关离子的浓度确定x的值,测定方法如下: ①取碱式硫酸铝溶液25.00 mL,加入盐酸酸化的过量BaCl2溶液充分反应,静置后过滤、洗涤,干燥至恒重,得固体2.3300 g。 ②取碱式硫酸铝溶液2.50 mL,稀释至25 mL,加入0.1000 mol·L−1EDTA标准溶液25.00 mL,调节溶液pH约为4.2,煮沸,冷却后用0.08000 mol·L−1CuSO4标准溶液滴定过量的EDTA至终点,消耗CuSO4标准溶液20.00 mL(已知Al3+、Cu2+与EDTA反应的化学计量比均为1∶1)。 计算(1−x)Al2(SO4)3·xAl(OH)3中的x值(写出计算过程)。 19.(15分)以Cl2、NaOH、(NH2)2CO(尿素)和SO2为原料可制备N2H4·H2O(水合肼)和无水Na2SO3,其主要实验流程如下: 已知:①Cl2+2OH−ClO−+Cl−+H2O是放热反应。 ②N2H4·H2O沸点约118 ℃,具有强还原性,能与NaClO剧烈反应生成N2。 (1)步骤Ⅰ制备NaClO溶液时,若温度超过40 ℃,Cl2与NaOH溶液反应生成NaClO3和NaCl,其离子方程式为____________________________________;实验中控制温度除用冰水浴外,还需采取的措施是____________________________________。 (2)步骤Ⅱ合成N2H4·H2O的装置如题19图−1所示。NaClO碱性溶液与尿素水溶液在40 ℃以下反应一段时间后,再迅速升温至110 ℃继续反应。实验中通过滴液漏斗滴加的溶液是_____________;使用冷凝管的目的是_________________________________。 (3)步骤Ⅳ用步骤Ⅲ得到的副产品Na2CO3制备无水Na2SO3(水溶液中H2SO3、HSO3-、SO32-随pH的分布如题19图−2所示,Na2SO3的溶解度曲线如题19图−3所示)。 ①边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。实验中确定何时停止通SO2的实验操作为_________________。 ②请补充完整由NaHSO3溶液制备无水Na2SO3的实验方案: _______________________,用少量无水乙醇洗涤,干燥,密封包装。 20.(14分)NOx(主要指NO和NO2)是大气主要污染物之一。有效去除大气中的NOx是环境保护的重要课题。 (1)用水吸收NOx的相关热化学方程式如下: 2NO2(g)+H2O(l)HNO3(aq)+HNO2(aq) ΔH=−116.1 kJ·mol−1 3HNO2(aq)HNO3(aq)+2NO(g)+H2O(l) ΔH=75.9 kJ·mol−1 反应3NO2(g)+H2O(l)2HNO3(aq)+NO(g)的ΔH=___________kJ·mol−1。 (2)用稀硝酸吸收NOx,得到HNO3和HNO2 的混合溶液,电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应式:____________________________________。 (3)用酸性(NH2)2CO水溶液吸收NOx,吸收过程中存在HNO2与(NH2)2CO生成N2和CO2的反应。写出该反应的化学方程式:____________________________________。 (4)在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2。 ①NH3与NO2生成N2的反应中,当生成1 mol N2时,转移的电子数为__________mol。 ②将一定比例的O2、NH3和NOx的混合气体,匀速通入装有催化剂M的反应器中反应(装置见题20图−1)。 反应相同时间NOx的去除率随反应温度的变化曲线如题20图−2所示,在50~250 ℃范围内随着温度的升高,NOx的去除率先迅速上升后上升缓慢的主要原因是____________________________;当反应温度高于380 ℃时,NOx的去除率迅速下降的原因可能是___________________________。 21.(12 分)【选做题】本题包括A、B两小题,请选定其中一小题,并在相应的答题区域内作答。若多做,则按A小题评分。 A.[物质结构与性质] 臭氧(O3)在[Fe(H2O)6]2+催化下能将烟气中的SO2、NOx分别氧化为SO42-和NO3-,NOx 也可在其他条件下被还原为N2。 (1)SO42-中心原子轨道的杂化类型为___________;NO3-的空间构型为_____________(用文字描述)。 (2)Fe2+基态核外电子排布式为__________________。 (3)与O3分子互为等电子体的一种阴离子为_____________(填化学式)。 (4)N2分子中σ键与π键的数目比n(σ)∶n(π)=__________________。 (5)[Fe(H2O)6]2+与NO反应生成的[Fe(NO)(H2O)5]2+中,NO以N原子与Fe2+形成配位键。请在[Fe(NO)(H2O)5]2+结构示意图的相应位置补填缺少的配体。 B.[实验化学] 3,4−亚甲二氧基苯甲酸是一种用途广泛的有机合成中间体,微溶于水,实验室可用KMnO4氧化3,4−亚甲二氧基苯甲醛制备,其反应方程式为 实验步骤如下: 步骤1:向反应瓶中加入3,4−亚甲二氧基苯甲醛和水,快速搅拌,于70~80 ℃滴加KMnO4溶液。反应结束后,加入KOH溶液至碱性。 步骤2:趁热过滤,洗涤滤饼,合并滤液和洗涤液。 步骤3:对合并后的溶液进行处理。 步骤4:抽滤,洗涤,干燥,得3,4−亚甲二氧基苯甲酸固体。 (1)步骤1中,反应结束后,若观察到反应液呈紫红色,需向溶液中滴加NaHSO3溶液,HSO3-转化为_____________(填化学式);加入KOH溶液至碱性的目的是____________________________。 (2)步骤2中,趁热过滤除去的物质是__________________(填化学式)。 (3)步骤3中,处理合并后溶液的实验操作为__________________。 (4)步骤4中,抽滤所用的装置包括_______________、吸滤瓶、安全瓶和抽气泵。 化学试题参考答案 单项选择题:本题包括10小题,每小题2分,共计20分。 1.C 2.C 3.D 4.B 5.B 6.A 7.A 8.D 9.A 10.C 不定项选择题:本题包括5小题,每小题4分,共计20分。 11.BD 12.B 13.C 14.AD 15.CD 非选择题(共80分) 16.(12分) (1)SO2+OH−HSO3− (2)①FeS2 ②硫元素转化为CaSO4而留在矿粉中 (3)NaAlO2 Al(OH)3 (4)1∶16 17.(15分) (1)碳碳双键 羰基 (2)消去反应 (3) (4) (5) 18.(12分) (1)适当增加CaCO3的量或加快搅拌速率 (2)减小 (3)25mL溶液中:n(SO42−)= n(BaSO4) ==0.0100 mol 2.5 mL溶液中: n(Al3+) = n(EDTA)−n(Cu2+)=0.1000 mol·L−1×25.00 mL×10−3L·mL−1−0.08000 mol·L−1×20.00 mL ×10−3 L·mL−1=9.000×10−4 mol 25 mL溶液中:n(Al3+)=9.000×10−3 mol 1 mol (1−x)Al2(SO4)3·xAl(OH)3中 n(Al3+)=(2−x)mol;n(SO42−)=3(1−x)mol x=0.41 19.(15分) (1)3Cl2+6OH−5Cl−+ClO3−+3H2O 缓慢通入Cl2 (2)NaClO碱性溶液 减少水合肼的挥发 (3)①测量溶液的pH,若pH约为4,停止通SO2 ②边搅拌边向NaHSO3溶液中滴加NaOH溶液,测量溶液pH,pH约为10时,停止滴加NaOH溶液,加热浓缩溶液至有大量晶体析出,在高于34℃条件下趁热过滤 20.(14分) (1)−136.2 (2)HNO2−2e−+H2O3H++NO3− (3)2HNO2+(NH2)2CO2N2↑+CO2↑+3H2O (4)① ②迅速上升段是催化剂活性随温度升高增大与温度升高共同使NOx去除反应速率迅速增大;上升缓慢段主要是温度升高引起的NOx去除反应速率增大 催化剂活性下降;NH3与O2反应生成了NO 21.(12分)【选做题】 A.[物质结构与性质] (1)sp3 平面(正)三角形 (2)[Ar]3d6或1s22s22p63s23p63d6 (3)NO2− (4)1∶2 (5) B.[实验化学] (1)SO42− 将反应生成的酸转化为可溶性的盐 (2)MnO2 (3)向溶液中滴加盐酸至水层不再产生沉淀 (4)布氏漏斗欢迎您的光临,Word文档下载后可修改编辑.双击可删除页眉页脚.谢谢!让我们共同学习共同进步!学无止境.更上一层楼。查看更多