- 2021-04-23 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届一轮复习人教版第一章增分补课1溶解度曲线在高考中的拓展应用学案
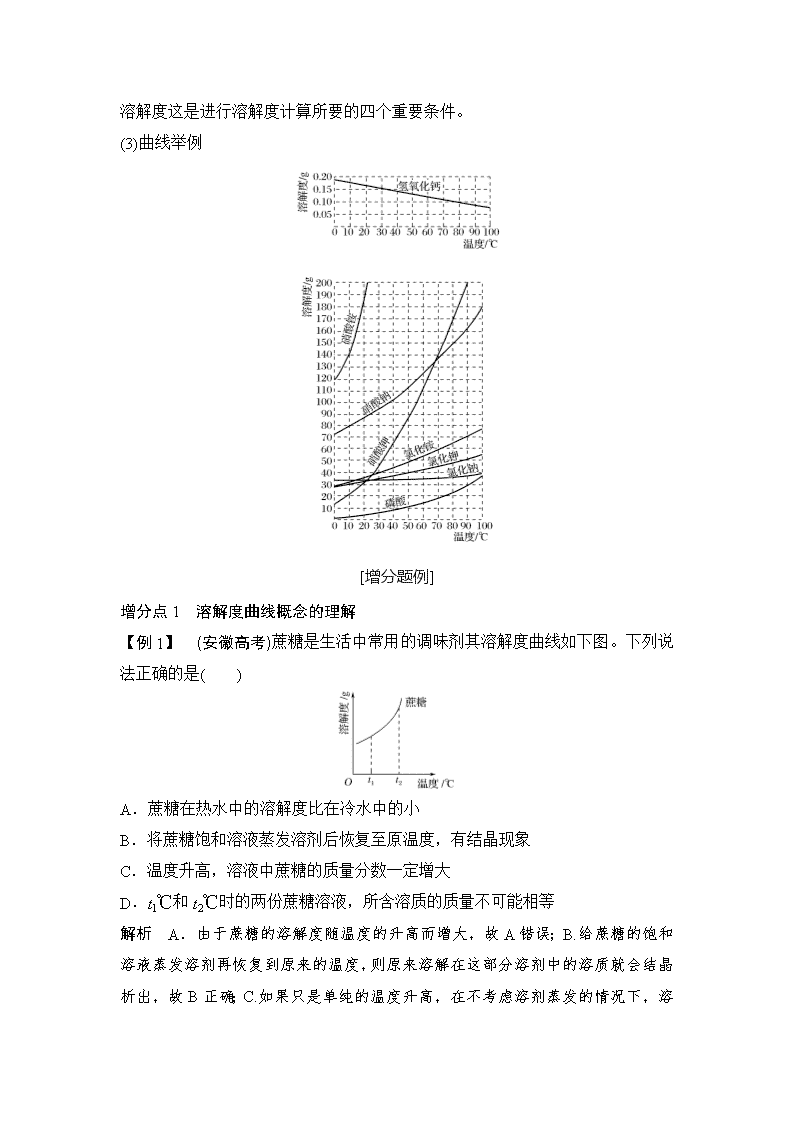
[知识查补] 1.溶解度 在一定温度下,某固体物质在100 g溶剂(通常是水)里达到饱和状态时所溶解的质量,叫做这种物质在该溶剂里的溶解度,其单位为“g”。 固体物质溶解度(饱和溶液)S=×100 g。 影响溶解度大小的因素 (1)内因:物质本身的性质(由结构决定)。 (2)外因: ①溶剂的影响(如NaCl易溶于水不易溶于汽油)。 ②温度的影响:升温,大多数固体物质的溶解度增大,少数物质却相反,如Ca(OH)2;温度对NaCl的溶解度影响不大。 2.溶解度曲线 (1)定义:溶解度曲线是同种物质在不同温度下的溶解度绘制出来的曲线,一般随着温度的升高而升高,但是少部分物质会随着温度的升高而降低。由于固体物质的溶解度随温度变化而变化,该变化可以用溶解度曲线来表示;用纵坐标表示溶解度,横坐标表示温度,绘出固体物质的溶解度随温度变化的曲线就叫做溶解度曲线。 (2)意义: ①表示同一种物质在不同温度时的溶解度或溶解度随温度变化的情况; ②表示不同物质在同一温度时的溶解度,可以比较同一温度时,不同物质的溶解度的大小。若两种物质的溶解度曲线相交,则在该温度下两种物质的溶解度相等; ③根据溶解度曲线可以确定从饱和溶液中析出晶体或进行混合物分离提纯的方法;可以用冷却热饱和溶液或蒸发溶剂; ④ 根据溶解度曲线能进行有关的计算。要在一定的温度下,溶液质量、溶剂质量,溶解度这是进行溶解度计算所要的四个重要条件。 (3)曲线举例 [增分题例] 增分点1 溶解度曲线概念的理解 【例1】 (安徽高考)蔗糖是生活中常用的调味剂其溶解度曲线如下图。下列说法正确的是( ) A.蔗糖在热水中的溶解度比在冷水中的小 B.将蔗糖饱和溶液蒸发溶剂后恢复至原温度,有结晶现象 C.温度升高,溶液中蔗糖的质量分数一定增大 D.t1℃和t2℃时的两份蔗糖溶液,所含溶质的质量不可能相等 解析 A.由于蔗糖的溶解度随温度的升高而增大,故 A错误;B.给蔗糖的饱和溶液蒸发溶剂再恢复到原来的温度,则原来溶解在这部分溶剂中的溶质就会结晶析出,故B正确;C.如果只是单纯的温度升高,在不考虑溶剂蒸发的情况下,溶液中若没有未溶解的溶质存在,则溶液中溶质的质量分数则不发生变化,故C错误;D.由于温度越高溶解度越大,只能说这两个温度下的饱和溶液中溶质的质量分数不可能相等,但溶液所含溶质的质量可能相等,故D错误。 答案 B 【例2】 工业上用重铬酸钠(Na2Cr2O7)结晶后的母液(含少量杂质Fe3+)生产重铬酸钾(K2Cr2O7)。工艺流程及相关物质溶解度曲线如图: (1)由Na2Cr2O7生产K2Cr2O7的化学方程式为_________________________ _______________________________________________________________。 通过冷却结晶析出大量K2Cr2O7的原因是____________________________ ________________________________________________________________。 (2)向Na2Cr2O7母液中加碱液调pH的目的是_________________________。 (3)固体A主要为________________(填化学式),固体B主要为______________(填化学式)。 (4)用热水洗涤固体A,回收的洗涤液转移到母液________(填“Ⅰ”、“Ⅱ”或“Ⅲ”)中,既能提高产率又可使能耗最低。 解析 (1)Na2Cr2O7与KCl发生复分解反应,化学方程式为Na2Cr2O7+2KCl===K2Cr2O7+2NaCl,根据图像可知,低温下K2Cr2O7溶解度远小于其他组分,随温度的降低,K2Cr2O7的溶解度明显减小。 (2)加碱使Fe3+生成沉淀而除去Fe3+。 (3)根据溶解度的大小,高温浓缩时,NaCl析出,所以固体A主要为NaCl;冷却结晶时,K2Cr2O7析出,所以固体B主要为K2Cr2O7。 (4)用热水洗涤固体NaCl,洗涤液中含有NaCl,所以洗涤液转移到母液Ⅱ中,既能提高产率又能使能耗最低。 答案 (1)Na2Cr2O7+2KCl===2NaCl+K2Cr2O7 低温下K2Cr2O7溶解度远小于其他组分,随温度的降低,K2Cr2O7溶解度明显减小(合理即可) (2)除去Fe3+ (3)NaCl K2Cr2O7 (4)Ⅱ 增分点2 分离、提纯 【例3】 (2017·课标全国Ⅲ,27)重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质。制备流程如图所示: 回答下列问题: (1)步骤①的主要反应为: FeO·Cr2O3+Na2CO3+NaNO3Na2CrO4+Fe2O3+CO2+NaNO2 上述反应配平后FeO·Cr2O3与NaNO3的系数比为________。该步骤不能使用陶瓷容器,原因是_________________________________________________ ______________________________________________________________。 (2)滤渣1中含量最多的金属元素是________,滤渣2的主要成分是________及含硅杂质。 (3)步骤④调滤液2的pH使之变________(填“大”或“小”),原因是____________________________________________________________ (用离子方程式表示)。 (4)有关物质的溶解度如图所示。向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。冷却到________(填标号)得到的K2Cr2O7固体产品最多。 a.80 ℃ b.60 ℃ c.40 ℃ d.10 ℃ 步骤⑤的反应类型是________。 解析 (1)首先标出变价元素的化合价,分析价态变化可知:1 mol FeO·Cr2O3失去7 mol电子,1 mol NaNO3得到2 mol电子,则由得失电子守恒可知二者系数比应为2∶7;该步骤中主要反应的反应物中有Na2CO3,而陶瓷中含有二氧化硅,二者在熔融时反应,故不能使用陶瓷容器;(2)步骤①的反应产生了不溶于水的Fe2O3,故熔块水浸后滤渣1的主要成分是Fe2O3,则含量最多的金属元素是铁元素;将滤液1调节pH=7后,Al3+会变为Al(OH)3沉淀而除去,故滤渣2的主要成分是Al(OH)3和含硅杂质;(3)滤液2中的主要成分是Na2CrO4,滤液3中的主要成分应为Na2Cr2O7,则第④步调节pH的作用是使Na2CrO4转化为Na2Cr2O7,离子方程式为2CrO+2H+Cr2O+H2O,酸性越强越利于Na2CrO4转化为Na2Cr2O7,故应调节pH使之变小;(4)由溶解度曲线图可知,10 ℃时K2Cr2O7溶解度最小,而Na2Cr2O7、KCl、NaCl此时溶解度均大于K2Cr2O7,三者均存在于溶液当中,故冷却到10 ℃时得到的K2Cr2O7固体最多,该步骤的化学反应方程式为2KCl+Na2Cr2O7===2NaCl+K2Cr2O7,显然该反应为复分解反应。 答案 (1)2∶7 陶瓷在高温下会与Na2CO3反应 (2)Fe Al(OH)3 (3)小 2CrO+2H+Cr2O+H2O (4)d 复分解反应 【例4】 (广东化学)以氯化钠和硫酸铵为原料制备氯化铵及副产品硫酸钠,工艺流程如下: 氯化铵和硫酸钠的溶解度随温度变化如下图所示。回答下列问题: (1)欲制备10.7 g NH4Cl,理论上需NaCl________ g。 (2)实验室进行蒸发浓缩用到的主要仪器有________、烧杯、玻璃棒、酒精灯等。 (3)“冷却结晶”过程中,析出NH4Cl晶体的合适温度为______。 (4)不用其他试剂,检查NH4Cl产品是否纯净的方法及操作是______________________________________________________________。 (5)若NH4Cl产品中含有硫酸钠杂质,进一步提纯产品的方法是________。 解析 根据氯守恒可列关系求m(NaCl)=10.7 g×58.5 g/mol÷53.5 g/mol=11.7 g,氯化铵的溶解度随温度变化较大,而硫酸钠在30~100 ℃变化不大,故可用冷却结晶法。但温度不能太低以防硫酸钠析出。所以应大约在33~40 ℃。 答案 (1)11.7 (2)蒸发皿 (3)35 ℃(33 ℃~40 ℃都可以) (4)加热法;取少量氯化铵产品于试管底部,加热,若试管底部无残留物,表明氯化铵产品纯净 (5)重结晶 增分点3 与溶度积的结合 【例5】 (2014·新课标Ⅰ卷,11)溴酸银(AgBrO3)溶解度随温度变化曲线如图所示。下列说法错误的是( ) A.溴酸银的溶解是放热过程 B.温度升高时溴酸银溶解速度加快 C.60 ℃时溴酸银的Ksp约等于6×10-4 D.若硝酸钾中含有少量溴酸银,可用重结晶方法提纯 解析 A项,由题图可知,随着温度升高,溴酸银的溶解度逐渐增大,因此AgBrO3的溶解是吸热过程,错误;B项,由图像曲线可知,温度升高斜率增大,因此AgBrO3的溶解速度加快,正确;C项,由溶解度曲线可知,60 ℃时AgBrO3的溶解度约为0.6 g,则其物质的量浓度为0.025 mol·L-1,AgBrO3的Ksp=c(Ag+)·c(BrO)=0.025×0.025≈6×10-4,正确;D项,由于温度对KNO3的溶解度的影响程度远大于AgBrO3,故可用重结晶的方法提纯含有少量AgBrO3的KNO3,正确。 答案 A 【归纳总结】 溶解度曲线上的点、线、面 1.点的意义 (1)溶解度曲线上的点表示物质在该点所示温度下的溶解度,溶液所处的状态是饱和溶液。 (2)溶解度曲线下面的点,表示溶液所处的状态是不饱和状态,依其数据配制的溶液为对应温度时的不饱和溶液。 (3)溶解度曲线上面的点,依其数据配制的溶液为对应温度时的饱和溶液,且该溶质有剩余。 (4)两条溶解度曲线的交点,表示在该点所示的温度下,两种物质的溶解度相等。 2.线的意义 溶解度曲线表示某物质在不同温度下的溶解度或溶解度随温度的变化情况。曲线的坡度越大,说明溶解度受温度影响越大;反之,说明受温度影响较小。 溶解度曲线也有三个方面的应用: (1)根据溶解度曲线,可以看出物质的溶解度随着温度的变化而变化的情况。 (2)根据溶解度曲线,比较在一定温度范围内的物质的溶解度大小。 (3)根据溶解度曲线,选择分离某些可溶性混合物的方法。 3.面的意义 对于曲线下部面上的任何点,依其数据配制的溶液为对应温度时的不饱和溶液;曲线上部面上的点,依其数据配制的溶液为对应温度时的饱和溶液,且溶质有剩余。如果要使不饱和溶液(曲线下部的一点)变成对应温度下的饱和溶液,方法有两种:第一种方法是向该溶液中添加溶质使之到达曲线上;第二种方法是蒸发一定量的溶剂。查看更多