- 2021-04-22 发布 |
- 37.5 KB |
- 21页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届一轮复习人教版原电池化学电源学案(4)
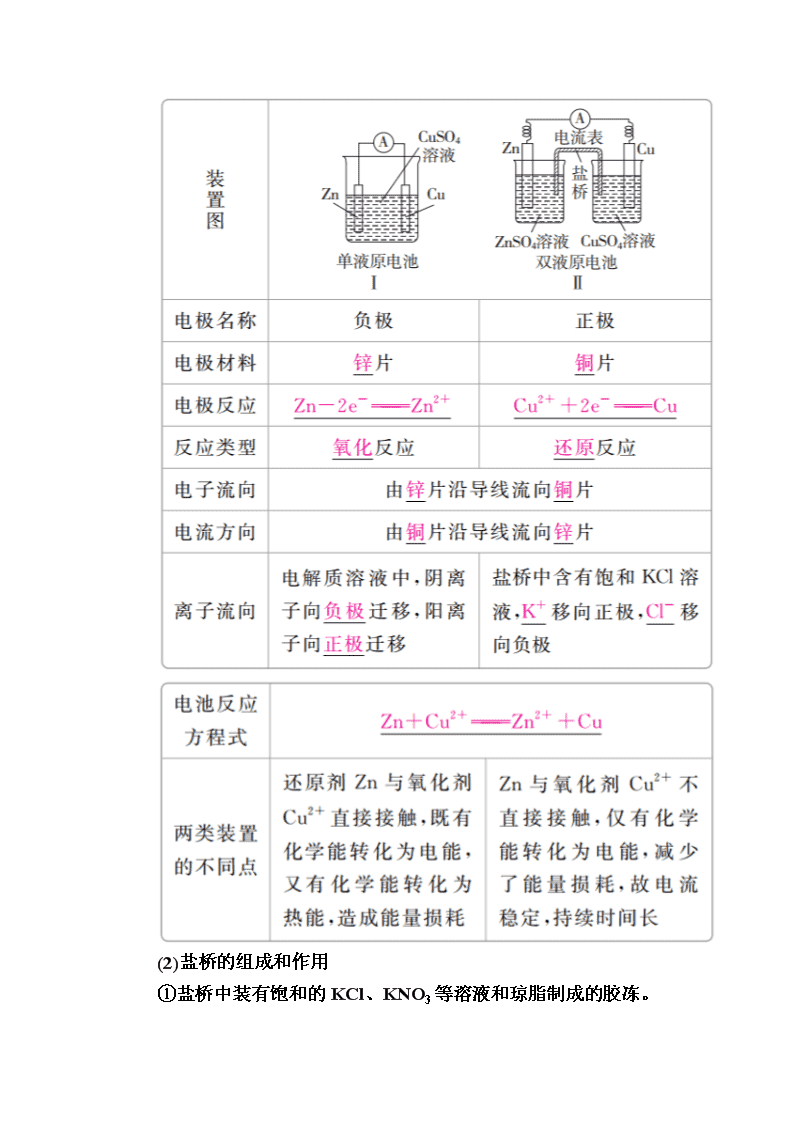
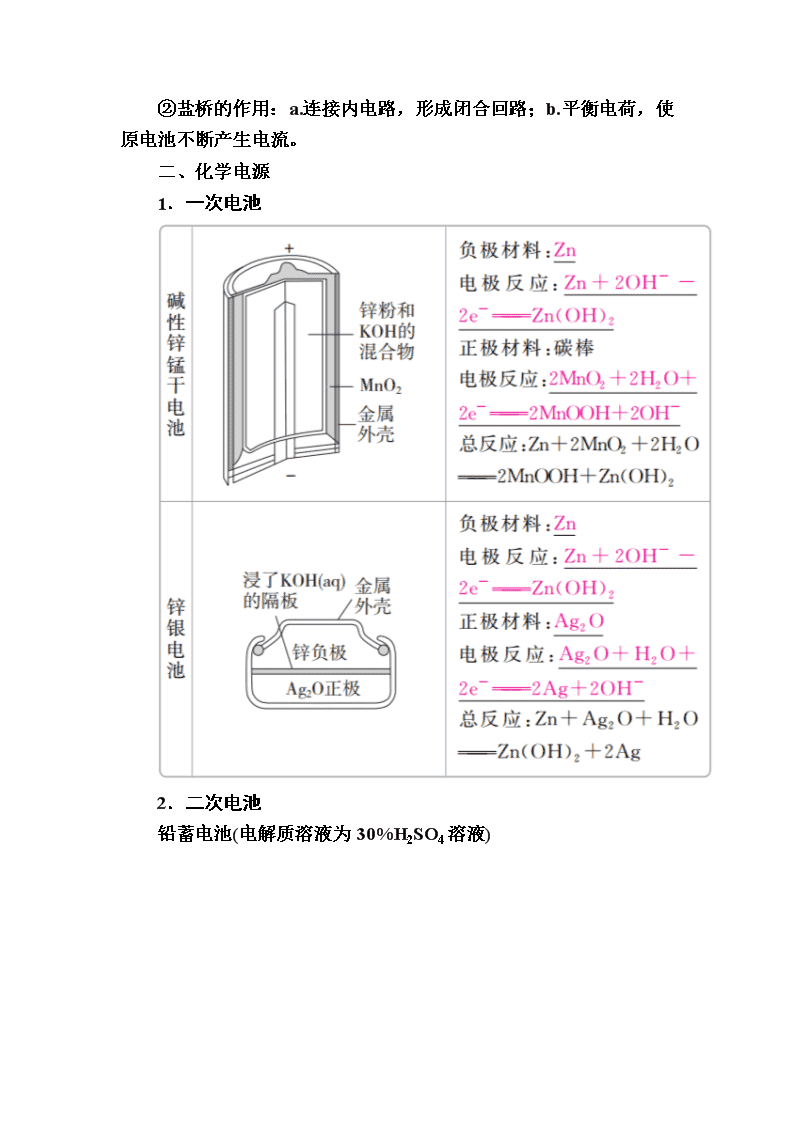
第九章 电化学基础 第31讲 原电池 化学电源 一、原电池原理 1.概念和反应本质 原电池是把化学能转化为电能的装置,其反应本质是氧化还原反应。 2.构成条件 (1)有能自发进行的氧化还原反应(一般是活泼性强的金属与电解质溶液反应)。 (2)活泼性不同的两电极。 (3)形成闭合回路,形成闭合回路需三个条件: ①电解质溶液;②两电极直接或间接接触;③两电极插入电解质溶液中。 3.工作原理(以铜—锌原电池为例) (1)反应原理 (2)盐桥的组成和作用 ①盐桥中装有饱和的KCl、KNO3等溶液和琼脂制成的胶冻。 ②盐桥的作用:a.连接内电路,形成闭合回路;b.平衡电荷,使原电池不断产生电流。 二、化学电源 1.一次电池 2.二次电池 铅蓄电池(电解质溶液为30%H2SO4溶液) (1)放电时的反应 负极反应:Pb-2e-+SO===PbSO4, 正极反应:PbO2+2e-+SO+4H+===PbSO4+2H2O, 总反应:Pb+PbO2+2H2SO4===2PbSO4+2H2O。 电解质溶液的pH增大(填“增大”“减小”或“不变”)。 (2)充电时的反应 阴极反应:PbSO4+2e-===Pb+SO, 阳极反应:PbSO4+2H2O-2e-===PbO2+4H++SO, 总反应:2PbSO4+2H2OPb+PbO2+2H2SO4。 3.燃料电池 (1)氢氧燃料电池 ①氢氧燃料电池是目前最成熟的燃料电池。 ②燃料电池的电极本身不参与反应,燃料和氧化剂连续地由外部 供给。 (2)甲烷燃料电池 ①碱性介质中: 负极:CH4-8e-+10OH-===CO+7H2O, 正极:2O2+8e-+4H2O===8OH-, 总反应:CH4+2O2+2KOH===K2CO3+3H2O。 ②酸性介质中: 负极:CH4-8e-+2H2O===CO2+8H+, 正极:2O2+8e-+8H+===4H2O, 总反应:CH4+2O2===CO2+2H2O。 1.正误判断,正确的画“√”,错误的画“×”。 (1)不是所有氧化还原反应都可以设计成原电池。( ) (2)在原电池中,负极材料的活泼性一定比正极材料强。( ) (3)带有“盐桥”的原电池比不带“盐桥”的原电池电流持续时间长。( ) (4)原电池工作时,溶液中的阳离子向负极移动,盐桥中的阳离子向正极移动。( ) (5)在锌铜原电池中,因为有电子通过电解质溶液形成闭合回路,所以有电流产生。( ) (6)在原电池中,正极本身一定不参与电极反应,负极本身一定要发生氧化反应。( ) 答案 (1)√ (2)× (3)√ (4)× (5)× (6)× 2.教材改编题 (据人教必修二P44 T1)原电池是利用______________反应、将________能转化为________能的装置。其中,负极是电子________的一极,发生________反应;正极是电子________的一极,发生________反应。 答案 能自发进行的氧化还原 化学 电 流出 氧化 流入 还原 考点1 原电池的原理 典例1 在如图所示的8个装置中,属于原电池的是( ) A.①④ B.③④⑤ C.④⑧ D.②④⑥⑦ 解析 根据原电池的构成条件可知:①中只有一个电极,③中两电极材料相同,⑤中酒精不是电解质,⑧中两电极材料相同且无闭合回路,故①③⑤⑧不能构成原电池。 答案 D 名师精讲 1.原电池的判断方法 (1)先分析有无外接电源,有外接电源的为电解池,无外接电源的可能为原电池。 (2)然后依据原电池的形成条件分析判断,主要是“四看”: (3)多池相连,但无外接电源时,两极活泼性差异最大的一池为原电池,其他各池可看做电解池。 2.判断原电池正、负极的五种方法 1.下列有关铜锌原电池的叙述正确的是( ) A.盐桥中的Cl-移向CuSO4溶液 B.电池总反应式为Zn+Cu2+===Zn2++Cu C.在外电路中,电子从正极流向负极 D.取下盐桥,原电池仍可工作 答案 B 解析 盐桥中的Cl-移向负极,即移向ZnSO4溶液,A错误;B正确;原电池工作时,电子从电池负极经外电路流向正极,C错误;取下盐桥,不能形成闭合回路,原电池不能工作,D错误。 2.下列有关对下图所示铜锌原电池装置的叙述正确的是( ) A.该电池通过阳离子的移动,保持溶液中电荷平衡 B.电池工作时,电流表指示出从Zn极到Cu极的电流方向 C.电池工作过程中,乙池的c(SO)逐渐减小 D.电池工作一段时间后,甲池中溶液质量明显增大 答案 A 解析 原电池中是阳离子交换膜,故该电池通过阳离子的移动保持溶液中电荷平衡,A正确;电池工作时,电子从Zn极流向Cu极,而电流方向相反,B错误;阳离子交换膜只允许阳离子通过,两池中c(SO)不变,C错误;甲池锌为负极,电极反应为Zn-2e-===Zn2+,因为中间为阳离子交换膜,所以生成的锌离子移向乙池,则甲池溶液的总质量基本不变,D错误。 考点2 化学电源 典例2 (2016·全国卷Ⅲ)锌-空气燃料电池可用作电动车动力电源,电池的电解质溶液为KOH溶液,反应为2Zn+O2+4OH-+2H2O===2Zn(OH)。下列说法正确的是( ) A.充电时,电解质溶液中K+向阳极移动 B.充电时,电解质溶液中c(OH-)逐渐减小 C.放电时,负极反应为:Zn+4OH--2e-===Zn(OH) D.放电时,电路中通过2 mol电子,消耗氧气22.4 L(标准状况) 解析 充电时装置为电解池,溶液中的阳离子向阴极移动,A错误;充电时的电池反应为2Zn(OH)===2Zn+O2+4OH-+2H2O,故c(OH-)增大,B错误;放电时,Zn失电子生成Zn(OH),C正确; 1 mol O2得4 mol 电子,故n(O2)= mol=0.5 mol,其标准状况下的体积为11.2 L,D错误。 答案 C 名师精讲 化学电源电极反应式的书写 书写电极反应式时,首先要根据原电池的工作原理准确判断正、负极,然后结合电解质溶液的环境确定电极产物,最后再根据质量守恒和电荷守恒写出反应式。电极反应式书写的一般方法有: (1)拆分法 ①写出原电池的总反应,如2Fe3++Cu===2Fe2++Cu2+。 ②把总反应按氧化反应和还原反应拆分为两个半反应,注明正、负极,并依据质量守恒、电荷守恒及电子得失守恒配平两个半反应: 正极:2Fe3++2e-===2Fe2+ 负极:Cu-2e-===Cu2+ (2)加减法 ①写出总反应,如Li+LiMn2O4===Li2Mn2O4。 ②写出其中容易写出的一个半反应(正极或负极),如Li-e-===Li+(负极)。 ③利用总反应与上述的一极反应相减,即得另一个电极的反应式,即LiMn2O4+Li++e-===Li2Mn2O4(正极)。 3.如图所示的水溶液锂离子电池体系。下列叙述错误的是( ) A.a为电池的正极 B.电池充电反应为LiMn2O4===Li1-xMn2O4+xLi C.放电时,a极锂的化合价发生变化 D.放电时,溶液中Li+从b向a迁移 答案 C 解析 根据原电池中金属性较强的材料作负极,可知b为电池的负极,则a为电池的正极,A正确;电池的充电反应为电解池原理,B正确;放电时,a作电池的正极,Mn元素化合价发生变化,Li元素化合价不变,C错误;放电时,阳离子移向电池的正极,D正确。 4.如图是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池(MHNi电池)。下列有关说法不正确的是( ) A.放电时正极反应为NiOOH+H2O+e-―→Ni(OH)2+OH- B.电池的电解液可为KOH溶液 C.充电时负极反应为MH+OH-―→H2O+M+e- D.MH是一类储氢材料,其氢密度越大,电池的能量密度越高 答案 C 解析 电池放电时,正极发生得电子的还原反应,A 正确;由电池示意图及放电时正极上的电极反应知,该电池的电解液呈碱性,可为KOH溶液,B正确;充电时的负极实质上为阴极,发生还原反应,C错误;MH的氢密度越大,表明单位体积的MH所能储存的电子越多,能量密度越大,D正确。 微专题 四种类型燃料电池的电极反应式归纳(以CH4为例) (建议用时:40分钟) 一、选择题(每题6分,共72分) 1.下列有关电池的说法不正确的是( ) A.太阳能电池的主要材料是高纯度的二氧化硅 B.铜锌原电池工作时,电子沿外电路从锌电极流向铜电极 C.氢氧燃料电池工作时,氢气在负极被氧化 D.原电池中一定发生了氧化还原反应 答案 A 解析 太阳能电池的主要材料是高纯硅,A错误;铜锌原电池工作时电子从锌极流出,沿外电路流入铜极,B正确;燃料电池中燃料在负极被氧化,C正确;原电池中一定发生氧化还原反应,D正确。 2.(2017·吉林模拟)原电池中,B极逐渐变粗,A极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的( ) A.A是Zn,B是Cu,C为稀硫酸 B.A是Cu,B是Zn,C为稀硫酸 C.A是Fe,B是Ag,C为稀AgNO3溶液 D.A是Ag,B是Fe,C为稀AgNO3溶液 答案 C 解析 该原电池中,B极逐渐变粗,A极逐渐变细,A失电子作负极,B作正极,所以A的活泼性大于B的活泼性,排除B、D;A极逐渐变粗,说明有金属析出,A中析出氢气不是金属,C中析出金属,故C正确。 3.某电池以K2FeO4和Zn为电极材料、KOH溶液为电解溶质溶液。下列说法正确的是( ) A.Zn为电池的负极 B.正极反应式为2FeO+10H++6e-===Fe2O3+5H2O C.该电池放电过程中,电子流向Zn D.电池工作时OH-向正极迁移 答案 A 解析 Zn为负极,失去电子,发生氧化反应,电子从Zn流出,A正确,C错误;KOH溶液为电解质溶液,则正极电极反应式为2FeO+6e-+8H2O===2Fe(OH)3+10OH-,B错误;电池工作时阴离子向负极迁移,D错误。 4.用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂KNO3的U形管)构成一个原电池。以下有关该原电池的叙述正确的是( ) ①在外电路中,电流由铜电极流向银电极 ②正极反应:Ag++e-===Ag ③实验过程中取出盐桥,原电池仍继续工作 ④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同 A.①② B.②③ C.②④ D.③④ 答案 C 解析 原电池中,较活泼的金属铜作负极,负极上金属铜失去电子发生氧化反应,较不活泼的金属银作正极,正极上银离子得电子发生还原反应。①在外电路中,电流由银电极流向铜电极,错误;② 正极上Ag+得电子发生还原反应,电极反应为Ag++e-===Ag,正确;③实验过程中取出盐桥,不能构成闭合回路,所以原电池不能继续工作,错误;④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应均为Cu+2Ag+===2Ag+Cu2+,正确。 5.有A、B、C、D、E五块金属片,进行如下实验:①A、B用导线相连后,同时浸入稀H2SO4溶液中,A极为负极;②C、D用导线相连后,同时浸入稀H2SO4溶液中,电流由D→导线→C;③A、C相连后,同时浸入稀H2SO4溶液中,C极产生大量气泡;④B、D相连后,同时浸入稀H2SO4溶液中,D极发生氧化反应;⑤用惰性电极电解含B离子和E离子的溶液,E先析出。据此,判断五种金属的活动性顺序是( ) A.A>B>C>D>E B.A>C>D>B>E C.C>A>B>D>E D.B>D>C>A>E 答案 B 解析 ①A、B相连时,A为负极,金属活动性:A>B;②C、D相连时,电流由D→导线→C,说明C为负极,金属活动性:C>D;③A、C相连后,同时浸入稀H2SO4溶液中,C极产生大量气泡,说明C为正极,金属活动性:A>C;④B、D相连后,D极发生氧化反应,说明D为负极,金属活动性:D>B;⑤用惰性电极电解含B离子和E离子的溶液,E先析出,说明金属活动性B>E。由此可知,金属活动性:A>C>D>B>E,B正确。 6.(2017·厦门模拟)将反应2Fe3++2I-??2Fe2++I2设计成如图所示的原电池。 下列说法不正确的是( ) A.盐桥中的K+移向FeCl3溶液 B.反应开始时,乙中石墨电极上发生氧化反应 C.电流计读数为零时,反应达到化学平衡状态 D.电流计读数为零后,在甲中溶入FeCl2固体,乙中石墨电极为负极 答案 D 解析 氯化铁电极为正极,碘化钾电极为负极,盐桥中阳离子向正极移动,所以K+移向FeCl3溶液,A正确;反应开始时,因乙中I-失去电子放电,元素的化合价升高,则发生氧化反应,B正确;当电流计为零时,说明没有电子发生转移,则反应达到平衡,C正确;当加入Fe2+,导致平衡逆向移动,则Fe2+失去电子生成Fe3+,作为负极,而乙中石墨成为正极,D错误。 7.研究人员最近发明了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为5MnO2+2Ag+2NaCl===Na2Mn5O10+2AgCl。下列“水”电池在海水中放电时的有关说法正确的是( ) A.正极反应式:Ag+Cl--e-===AgCl B.每生成1 mol Na2Mn5O10转移2 mol电子 C.Na+不断向“水”电池的负极移动 D.AgCl是还原产物 答案 B 解析 原电池的正极得电子,发生还原反应,A错误;阳离子向正极移动,C错误;Ag化合价升高生成AgCl,AgCl是氧化产物,D错误。 8.实验发现,298 K时,在FeCl3酸性溶液中加入少量锌粒后,Fe3+立即被还原成Fe2+。某化学兴趣小组根据该实验事实设计了如右图所示的原电池装置。下列有关说法正确的是( ) A.该原电池的正极反应式:Zn-2e-===Zn2+ B.左烧杯中溶液的红色逐渐褪去 C.该电池铂电极上有气泡出现 D.该电池总反应式为3Zn+2Fe3+===2Fe+3Zn2+ 答案 B 解析 Zn失去电子发生氧化反应,作负极,A错误;Fe3+在正极得电子被还原为Fe2+,溶液红色逐渐褪去,B正确;铂电极上Fe3+被还原为Fe2+,没有气体生成,C错误;该电池总反应式为Zn+2Fe3+===2Fe2++Zn2+,没有单质生成,D错误。 9.镁-次氯酸盐燃料电池,具有能量高、安全方便等优点。该电池的正极反应式为ClO-+H2O+2e-===Cl-+2OH-,关于该电池的叙述正确的是( ) A.该电池中镁为负极,发生还原反应 B.电池工作时,OH-向正极移动 C.该电池的总反应为Mg+ClO-+H2O===Mg(OH)2↓+Cl- D.电池工作时,正极周围溶液的pH将不断变小 答案 C 解析 该原电池中,镁作负极,负极上镁失电子发生氧化反应,正极上次氯酸根离子得电子发生还原反应,电池反应式为Mg+ClO-+H2O===Mg(OH)2↓+Cl-,A错误,C正确;原电池放电时,电解质溶液中阳离子向正极移动,阴离子向负极移动,B错误;电池工作时正极上的反应为ClO-+H2O+2e-===Cl-+2OH-,pH增大,D 错误。 10.工业上常将铬镀在其他金属表面,同铁、镍组成各种性质的不锈钢,在如图装置中,观察到图1装置铜电极上产生大量的无色气泡,而图2装置中铜电极上无气体产生,铬电极上产生大量有色气体,则下列叙述正确的是( ) A.图1为原电池装置,Cu电极上产生的是O2 B.图2装置中Cu电极上发生的电极反应式为Cu-2e-===Cu2+ C.由实验现象可知:金属活动性Cu>Cr D.两个装置中,电子均由Cr电极流向Cu电极 答案 B 解析 图1为原电池装置,铜为正极,氢离子得电子生成氢气,A错误;图2装置中铜电极上无气体产生,铬电极上产生大量有色气体,说明铜为负极,铬电极为正极,负极发生Cu-2e-===Cu2+,B正确;由图1根据原电池原理知金属铬的活动性比铜强,C错误;图1中,电子由Cr经导线流向Cu,图2中电子由Cu极经导线流向Cr,D错误。 11.某同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4===2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如图所示原电池,盐桥中装有饱和溶液。下列说法正确的是( ) A.b电极上发生还原反应 B.外电路电子的流向是从a到b C.电池工作时,盐桥中的SO移向甲烧杯 D.a电极上发生的反应为MnO+8H++5e-===Mn2++4H2O 答案 D 解析 根据氧化还原反应方程式可知,氧化剂是KMnO4,故a为正极,发生还原反应,A错误;a为正极,b为负极,电子沿外电路从负极流向正极,即电子从b流向a,B错误;原电池工作时,阴离子流向负极,即乙烧杯,C错误;a电极为正极,MnO得电子生成Mn2+,D正确。 12.氮的化合物可以通过电化学转化,如图为NO转化为NO2的工作原理示意图,下列说法正确的是( ) A.Pt电极上发生的是氧化反应 B.Pt电极的电极反应式为O2+2H2O+4e-===4OH- C.每转化1 mol NO,消耗O2的体积为11.2 L D.外电路中电子由NiO电极向Pt电极移动 答案 D 解析 根据装置图可知,Pt电极上氧气得到电子转化为O2-,所以Pt电极作正极,发生还原反应,NiO电极作负极,A错误;Pt电极上氧气得到电子转化为O2-,B错误;不能确定氧气所处的状况,则不能计算氧气的体积,C错误;NiO是负极,NO在负极上失去电子,外电路中电子由NiO电极向Pt电极移动,D正确。 二、非选择题(共28分) 13.(14分)某实验小组同学对电化学原理进行了一系列探究活动。 (1)如图为某实验小组依据氧化还原反应:(用离子方程式表示)________________________________________________________________________ 设计的原电池装置,反应前,电极质量相等,一段时间后,两电极质量相差12 g,导线中通过________mol电子。 (2)其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极反应式为________________,这是由于NH4Cl溶液显________(填“酸性”“碱性”或“中性”),用离子方程式表示溶液显此性的原因______________________,用吸管吸出铁片附近溶液少许置于试管中,向其中滴加少量新制饱和氯水,写出发生反应的离子方程式:____________________,然后滴加几滴硫氰化钾溶液,溶液变红,继续滴加过量新制饱和氯水,颜色褪去,同学们对此做了多种假设,某同学的假设是:“溶液中的+3价铁被氧化为更高的价态。”如果+3价铁被氧化为FeO,试写出该反应的离子方程式: ________________________________________________________________________________________________________________________________________________。 答案 (1)Fe+Cu2+===Fe2++Cu 0.2 (2)2H++2e-===H2↑ 酸性 NH+H2O??NH3·H2O+H+ 2Fe2++Cl2===2Fe3++2Cl- 2Fe3++3Cl2+8H2O===2FeO+6Cl-+16H+ 解析 (1)负极反应Fe-2e-===Fe2+,正极反应Cu2++2e-===Cu,则原电池反应为Fe+Cu2+===Fe2++Cu。设导线中通过电子的物质的量为x,则负极减少28 g·mol-1·x,正极增加32 g·mol-1·x,28x+32x=12,x=0.2 mol。 (2)NH4Cl水解使溶液显酸性,正极上H+得电子,负极上Fe失电子生成Fe2+。 14.(14分)根据下图回答下列问题: Ⅰ.(1)若烧杯中溶液为稀硫酸,则观察到的现象是________________________________________________________________________________________________________________________________________________, 负极的电极反应式为_________________________ _______________________________________________。 (2)若烧杯中溶液为氢氧化钠溶液,则负极为________(填“Mg”或“Al”),总反应的化学方程式为 ________________________________________________________________________________________________________________________________________________。 Ⅱ.中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆。甲醇燃料电池的工作原理如图所示。 (1)该电池工作时,b口通入的物质为________,c口通入的物质为________。 (2)该电池负极的电极反应式为________________________________________________________________________________________________________________________________________________。 (3)工作一段时间后,当12.8 g甲醇完全反应生成CO2时,有________NA个电子转移。 答案 Ⅰ.(1)Mg逐渐溶解,Al片上有气泡冒出,电流计指针偏转 Mg-2e-===Mg2+ (2)Al 2Al+2NaOH+2H2O===2NaAlO2+3H2↑ Ⅱ.(1)CH3OH O2或空气 (2)CH3OH-6e-+H2O===CO2↑+6H+ (3)2.4 解析 Ⅰ.(1)若烧杯中溶液为稀硫酸,因Mg的活泼性比Al强,故Mg作负极,负极上发生反应Mg-2e-===Mg2+,镁片溶解;Al作正极,正极上发生反应2H++2e-===H2↑,故Al 片上有气泡冒出;因电路中产生电流,故电流计指针偏转。 (2)若烧杯中溶液为氢氧化钠溶液,因为Mg不与NaOH溶液反应,所以Al是负极,Mg是正极,总反应为2Al+2NaOH+2H2O===2NaAlO2+3H2↑。 Ⅱ.由H+移动方向可知,左侧为负极,右侧为正极,故b口通入CH3OH,c口通入O2或空气。负极反应式为CH3OH-6e-+H2O===CO2↑+6H+。当12.8 g甲醇(即0.4 mol)完全反应生成CO2时,转移2.4 mol电子,即转移2.4NA个电子。查看更多