- 2021-04-22 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考复习策略——化学更多关注高中学习资料库
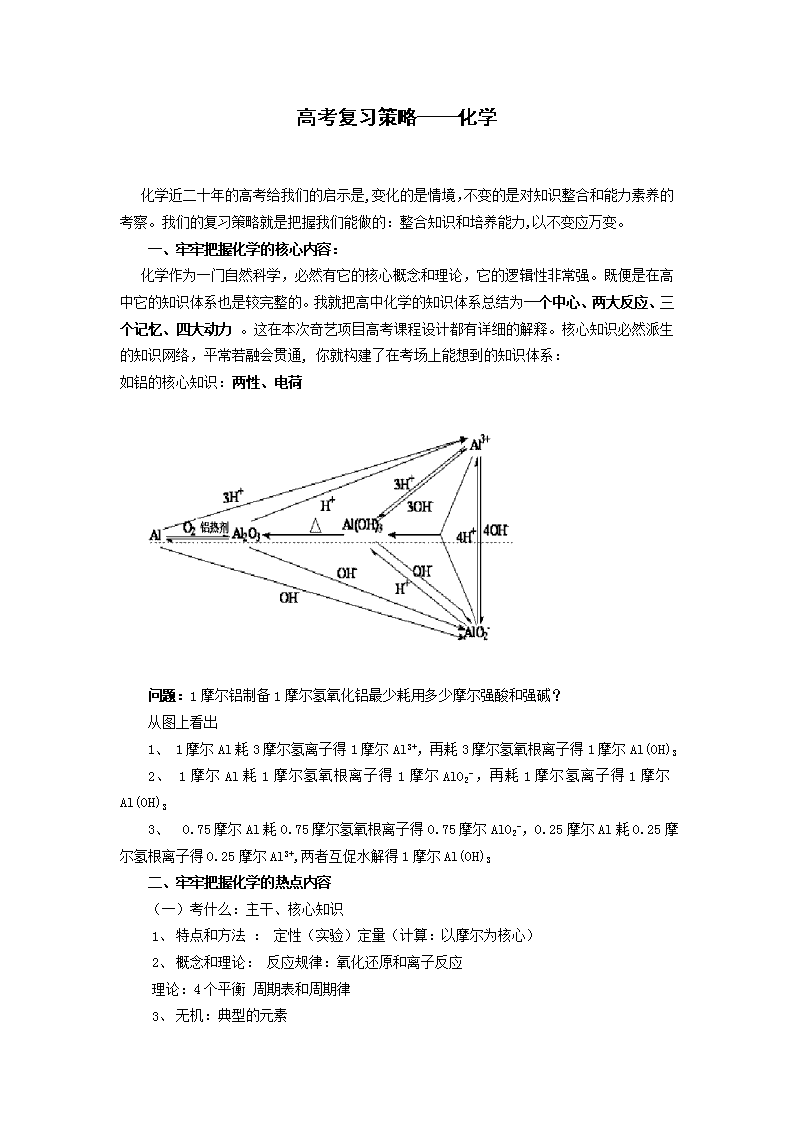
高考复习策略——化学 化学近二十年的高考给我们的启示是,变化的是情境,不变的是对知识整合和能力素养的考察。我们的复习策略就是把握我们能做的:整合知识和培养能力,以不变应万变。 一、牢牢把握化学的核心内容: 化学作为一门自然科学,必然有它的核心概念和理论,它的逻辑性非常强。既便是在高中它的知识体系也是较完整的。我就把高中化学的知识体系总结为一个中心、两大反应、三个记忆、四大动力 。这在本次奇艺项目高考课程设计都有详细的解释。核心知识必然派生的知识网络,平常若融会贯通, 你就构建了在考场上能想到的知识体系: 如铝的核心知识:两性、电荷 问题:1摩尔铝制备1摩尔氢氧化铝最少耗用多少摩尔强酸和强碱? 从图上看出 1、 1摩尔Al耗3摩尔氢离子得1摩尔Al3+,再耗3摩尔氢氧根离子得1摩尔Al(OH)3 2、 1摩尔Al耗1摩尔氢氧根离子得1摩尔AlO2-,再耗1摩尔氢离子得1摩尔Al(OH)3 3、 0.75摩尔Al耗0.75摩尔氢氧根离子得0.75摩尔AlO2-,0.25摩尔Al耗0.25摩尔氢根离子得0.25摩尔Al3+,两者互促水解得1摩尔Al(OH)3 二、牢牢把握化学的热点内容 (一)考什么:主干、核心知识 1、 特点和方法 : 定性(实验)定量(计算:以摩尔为核心) 2、 概念和理论: 反应规律:氧化还原和离子反应 理论:4个平衡 周期表和周期律 3、 无机:典型的元素 1、 有机:逆合成推断法,信息!! (二)2012高考方向 1、结构: 2、创新的氧还离方 3、三大平衡的应用、平衡常数 4、有机(推断、合成) 5、探究实验 (三)题型: 1、选择(11个中的7个) 2、无机 3、原理(流程、海水、污水) 4、实验(课本的经典) 5、有机(生活、药物) 三、牢牢把握化学的经典母题从而培养能力 有同学习喜欢多做题,此观点我不认同,我历来反对题海!只要选准好题,做一道,弄透一道,特别注重题后的反思、总结,每个知识点做透三、四道这样的好题就足够了!有同学问怎样算作透?请参考以下做题的五种境界: ①这道题怎么做? ②这道题为什么要这么做? ③我怎么能想到这么做? ④有无别的方法?那个最好? ⑤改变设问,会变成什么题目? 是难了还是容易了?(出题人的境界) 我建议同学们牢牢把握住第三境界,把所有的知识和能力都变成自己的!本册书选用的例题都可称为“母题”,选用的习题可称为好题,例题和习题伴有详细解析,站在同学们的角度已把本题提升到第三境界! 例1、有下图所示的反应关系,A是中学常见的无机物,A、B、C中含有同一种元素R,不含R的产物已经略去。 (1)A与NaOH溶液反应,既可只生成B,又可只生成C,还可生成B+C。写出符合上述反应关系的A的两种不同类物质的分子式________________; (2)若A与NaOH无论以何种物质的量之比反应,其产物必有B+C,则A的分子式可能是____________________,R在A、B、C中的化合价必须满足的条件是____________________。 分析:此题学生思维的重点是考虑A是什么?苦思冥想,物质一个一个的从脑子里向外崩,看是否符合题意,这样思考既费时又不全面。 究其本质,学生没有掌握元素化合物的学法,没有掌握物质通性的学法! 从八点图可知:NaOH作为强碱,具有碱的五大通性:⑴与指示剂反应;⑵与非金属反应(如氯气、硫);⑶与酸性氧化物反应(如CO2、SO2);⑷与酸反应(H2S、H3PO4);⑸与盐反应(如铝盐)。以此为指导,此题极为简单,第一问可选:酸性氧化物、多元弱酸、盐(如铝盐);第二问可选:非金属(如氯气、硫)。 启示:学习元素化合物必须掌握物质的通性:八点图、氧化还原等。 例2、用尽可能多的试剂或方法鉴别:Na2S 、 K2SO4。 分析:此题学生所能考虑到的只有几种可能:BaCl2溶液、盐酸、硫酸,个别同学能想到用焰色反应来鉴别阳离子。思维极不全面,学生对于氧化还原、水解等知识非常不敏感。 此题的现象是:老师一经提示都知道,不提示根本想不到! 究其本质,学生没有掌握离子的学法,能否把物质的性质转变成离子的性质,是衡量学生高中化学是否入门的标志。 我们可以这样来梳理硫离子的性质: ⑴ 复分解: ① 沉淀方面:Fe2+、Cu2+、Ag+等; ② 气体方面:加非氧化性酸(酸性比H2S强)就产生H2S气体; ③ 弱电解质方面:S2-水解显碱性,所以可以用酸碱指示剂、试纸,也可以用Al3+等双水解的离子来检验; ⑵氧化还原: S2-水具有强还原性,可用氧化剂来鉴别,如氯气、浓或稀的硝酸,浓硫酸、双氧水、等等。 启示:我们可以这种模式来记忆离子的性质。 又如:Fe3+的记忆模式: ⑴ 复分解: ① 沉淀方面:OH-等; ② 气体方面:无; ③ 弱电解质方面:Fe3+水解显酸性,与CO32-、HCO3-、S2-、HS-、SO32-、HSO3-等离子双水解; ⑵氧化还原: Fe3+水具有较强氧化性,可氧化S2-、I-等离子。 ⑶整体:“万紫千红” 与SCN-络和呈红色、与苯酚络和呈紫色。 例3 、 X、Y、Z是主族元素的单质,U、V是化合物。它们会有如下反应(式中的反应系数和条件均已略去): ①X+U→V+Y ②X+Z→V ③Y+Z→U (1)若X、Y的组成元素不是同一族,请写出符合①式的3个不同的化学方程式,并要求3个式子中的3种X和3种Y,全部由不同族的元素组成。 _____________________________________________。 (2)今有某化合物W,它跟化合物U或CO2反应,都能生成单质Y。符合题设的3个反应式关系的单质X是______,单质Y是______,单质Z是______,化合物W为______。 分析:此题学生认为很难,没有思路,也是一个一个的凑,看是否符合题意。凑不出来时就放弃。 究其本质,学生没有进行总结,没有总结象:同族置换、非同族置换、歧化反应、归中反应、化合物+单质→化合物+化合物、化合物+化合物→化合物+单质等规律。 更为重要的是,学生没有对每一个物质进行总结,如本题中明确给出的物质只有CO2,有的同学视CO2不见,绞尽脑汁,苦思冥想而不得。 我们可以这样来梳理CO2的性质: ⑴ 复分解:酸性氧化物的通性 ① 与水的反应; ② 与碱性氧化物(如Na2O)的反应,派生:CO2与Na2O2的反应; ③ 与碱的反应; ⑵氧化还原:从价态考虑 CO2中的碳为正四价,为最高价,只具有氧化性,是弱氧化剂,可与非金属碳、金属镁反应。 ⑶整体:CO2与水发生光合作用的反应(较偏的知识点)。 如果有了这种思路,此题是信手拈来:某化合物W,它跟化合物U或CO2反应,都能生成单质Y,则W是Na2O2,Y是O2,U是H2O,又可推出X是F2。 启示:我们可以以这种模式来记忆物质的性质。 总结:我们可以借助八点图、氧化还原(化合价)、元素周期表,以一定的思维模式来记忆物质、离子的性质,注意总结,把握细节。 四、多总结、多实战、多反思 没有总结,无法在实战中获胜,实战失利后不反思,无法提升。示例如下: 例4.(03江苏)根据下列反应框图填空,已知反应①是工业上生产化合物D的反应,反应⑤是实验室鉴定化合物E的反应。 (1)单质L是 。 (2)化合物B是 。 (3)图中除反应①以外,还有两个用于工业生产的反应,是 和 (填代号)。 它们的化学反应方程式分别是 和 。 【实战】解此题的切入点有两处:首先由反应①为分解反应且为工业生产化合物D的反应可初步确定该反应为CaCO3CaO+CO2↑。再由反应②的反应形式及“电解”条件可知中学阶段接触符合题意的反应为“饱和食盐水的电解”,即氯碱工业的反应原理。然后根据框图中提供的转化关系可初步确定D为CaO,E为CO2,B为H2O,G为Ca(OH)2,H为Cl2,从而进一步推出反应④为工业生产漂白粉的反应,反应⑤为:Ca(OH)2+CO2=CaCO3↓+H2O,即实验室检验CO2的反应。 【答案】(1)H2 (2)H2O (3)②,④ 2NaCl+2H2O2NaOH+H2↑+Cl2↑ 2Ca(OH)2+2Cl2=Ca(ClO)2+CaCl2+2H2O 【反思和总结】本题中的突破点是常见化学工业制法。高中常见化学工业制法:高温下反应的:石灰工业、炼铁;连续氧化的:硫酸工业,硝酸工业;电解:氯碱工业,冶金工业(炼钠、镁和铝等)、精炼铜。催化剂:合成氨工业等等。 例5. (98年)图1—2—8中①~⑩分别代表有关反应中的一种物质,请填写以下空白: (1)①、③、④的化学式分别是________、________、________。 (2)⑧与⑨反应的化学方程式是_________________。 【实战】通过框图可从物质①热分解产物全部是气体来判断,它是一种由挥发性酸组成的铵盐。再由混合气体分别通过碱性干燥剂和酸性干燥剂后,可能存在的水蒸气都已被吸收,因而得知能通过碱石灰而未被吸收的气体③只能是氨气。至于通过浓硫酸没有被吸收的气体②,一定是一种酸性气体。 从图中可见,气体②可分别与过氧化钠和燃着的镁条发生反应,从而判断出气体②是二氧化碳。那么,物质①就是碳酸氢铵。 二氧化碳与过氧化钠反应的生成物是碳酸钠和氧气,它们就是物质④、⑤。众所周知,在高温条件下,氨气可以跟氧气发生催化氧化,生成一氧化氮和水,由此可确定物质④是氧气。因为一氧化氮易被氧气所氧化,所以在物质⑥和中可确认⑥是一氧化氮,则是水。这样一来,显然⑦是二氧化氮,⑧是硝酸。燃着的镁条和二氧化碳反应,产物有氧化镁和碳。这两种生成物分别与硝酸反应时,前者会生成两种产物(硝酸镁和水),后者则能得到3种产物(二氧化碳、二氧化氮和水),由此可确定物质⑨应是碳。 【答案】(1)NH4HCO3,NH3,O2 (2)C+4HNO3(浓)====2H2O+4NO2↑+CO2↑ 【反思和总结】本题通过无机化合物之间的网络图来考查相关的反应知识。试题以氮的化合物为主线,涉及金属,并涉及用于气体的干燥剂和二氧化碳,共15种物质。本题的突破点非常多,在高中范围内逐一总结如下: 1、连续被氧化的反应 2、需要催化剂的反应 2KClO32KCl+3O2↑ 2H2O22 H2O +O2↑ 2SO2 +O2 2SO3 4NH3 +5O2 4NO+6H2O N2 +3H2 2NH3 要多反思考场的状态,从而达到实战层面: 1心态:按照平时的节奏,松弛而不懈怠,不紧张,不恋战,该扔就扔!! 全身心地投入,全神贯注,思维深刻、敏捷、细腻、专注(抑制)物我两忘!!! 每一点的圈点,每一点的适度推理(翻译),适度停顿,主动去想!! 2、答案没看出来时: a′不着急,干什么?审题去!相信自己一定有没看见的题的信息! b′还不行!闭目,积极暗示!再从头审题!积极的多写!多推理! c′2—3 min出不来,坚决放弃! 3、答案一看就会时,要慎之再慎 回归课本,回归母题? 多答点,不倒扣分! 多思考!把握主要矛盾! 4、答题绝对不能太快!!! 总之,希望同学们多检测自己的基础知识,把握好自己的审题过程、规范表达过程,天天给自己的学习心态产生良好促进作用、逐渐产生自信,这样我们就成功了。 查看更多