- 2021-04-21 发布 |
- 37.5 KB |
- 15页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018届二轮复习近三年高考试题(速率平衡)分析课件(15张)(全国通用)
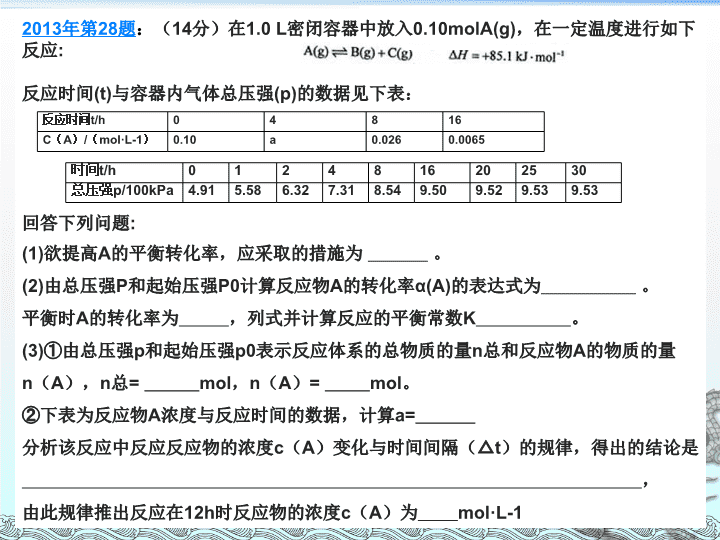
近三年高考试题(国 II 卷)研究与分析 化学反应能量、速率及平衡 二 O 一六年三月二日 2013 年第 28 题 : ( 14 分)在 1.0 L 密闭容器中放入 0.10molA(g) ,在一定温度进行如下反应 : 反应时间 (t) 与容器内气体总压强 (p) 的数据见下表: 回答下列问题 : (1) 欲提高 A 的平衡转化率,应采取的措施为 。 (2) 由总压强 P 和起始压强 P0 计算反应物 A 的转化率 α(A) 的表达式为 。 平衡时 A 的转化率为 ,列式并计算反应的平衡常数 K 。 (3) ① 由总压强 p 和起始压强 p0 表示反应体系的总物质的量 n 总和反应物 A 的物质的量 n ( A ), n 总 = mol , n ( A ) = mol 。 ② 下表为反应物 A 浓度与反应时间的数据,计算 a= 分析该反应中反应反应物的浓度 c ( A )变化与时间间隔( △ t )的规律,得出的结论是 , 由此规律推出反应在 12h 时反应物的浓度 c ( A )为 mol·L-1 时间 t/h 0 1 2 4 8 16 20 25 30 总压强 p/100kPa 4.91 5.58 6.32 7.31 8.54 9.50 9.52 9.53 9.53 反应时间 t/h 0 4 8 16 C ( A ) / ( mol·L-1 ) 0.10 a 0.026 0.0065 2014 年第 26 题 :( 13 分)在容积为 1.00L 的容器中,通入一定量的 N 2 O 4 ,发生反应 N 2 O 4 (g) 2NO 2 (g) , 随温度升高,混合气体的颜色变深。 回答下列问题: ( 1 )反应的 △ H 0 (填 “ 大于 ”“ 小于 ” ); 100 ℃时,体系中各物质浓度随时间变化如上图所示。在 0~60s 时段,反应速率 v(N 2 O 4 ) 为 mol·L -1 ·s -1 反应的平衡常数 K 1 为 。 ( 2 ) 100 ℃时达到平衡后,改变反应温度为 T , c(N 2 O 4 ) 以 0.0020 mol·L -1 ·s -1 的平均速率降低,经 10s 又达到平衡。 ① T 100 ℃ (填 “ 大于 ”“ 小于 ” ),判断理由是 。 ②列式计算温度 T 是反应的平衡常数 K 2 ( 3 )温度 T 时反应达平衡后,将反应容器的容积减少一半,平衡向 (填 “ 正反应 ” 或 “ 逆反应 ” )方向移动,判断理由是 。 2015 年第 27 题 :( 14 分)甲醇是重要的化工原料,又可称为燃料。利用合成气(主要成分为 CO 、 CO 2 和 H 2 )在催化剂的作用下合成甲醇,发生的主反应如下: 回答下列问题: 化学键 H - H C - O C O H - O C - H E / ( kJ . mol - 1 ) 436 343 1076 465 413 ( 1 )已知反应①中的相关的化学键键能数据如下: 由此计算△ H 1 = kJ . mol - 1 ,已知△ H 2 =- 58kJ . mol - 1 ,则△ H 3 = kJ . mol - 1 ( 2 )反应①的化学平衡常数 K 的表达式为 ;图 1 中能正确反映平衡常数 K 随温度变化关系的曲线为 (填曲线标记字母),其判断理由是 ; ( 3 )合成气的组成 n ( H 2 )/ n ( CO + CO 2 )= 2 . 60 时体系中的 CO 平衡转化率( a )与温度和压强的关系如图 2 所示。 a ( CO )值随温度升高而 (填 “ 增大 ” 或 “ 减小 ” ),其原因是 。图 2 中的压强由大到小为 _____ ,其判断理由是 _____ 。 一 、试题概况 2013 年 28 题 2014 年 26 题 2015 年 27 题 题干 表格 2 个已知数值 时间与浓度的图像 温度与平衡常数的图像 温度与转化率的图像 表格 材料 未知物间的反应 N 2 O 4 与 NO 2 的转化 甲醇的合成 涉及元素 N 、 O C 、 H 、 O 题眼 阿伏伽德罗定律及推论 分析图像中的体现的转化率 影响平衡移动的因素 题量 3 小题 9 个空 2 个简答 3 小题 8 个空 2 个简答 3 小题 9 个空 3 个简答 分值 14 13 15 试题难度 中上 中上 中上 2013 年 28 题 2014 年 26 题 2015 年 27 题 考查点 反应热 应用盖斯定律书写热化学方程式 应用盖斯定律书写热化学方程式 应用盖斯定律进行计算 反应速率 1. 转化率的计算 2. 反应速率数据的规律分析 反应速率的计算 化学平衡 1. 影响平衡移动的因素 2. 平衡常数计算 1. 影响平衡移动的因素 2. 平衡常数计算 1. 影响平衡移动的因素 2. 平衡常数的表达式 3. 溶度积 其它 表格数据的分析与应用 图像分析 解题方法 1. 三段式 2. 比较分析 1. 三段式 2. 比较分析 1. 盖斯定律 2. 比较分析 二 、 试题特点 1 、题量稳定,赋分合理,体 现 重要 地位 此类型的题是近年来 高 考中的必考知识 ,题 量和赋分基本保持稳 定 , 均为平衡常数、速率比较、图象分析。由此可见化学反应速率和化学平衡在高考中的重要地位 。 2 、源于教材,符合考纲,突出主干知识 ; 试题均在考试大纲要求范围之内,源于教材而又高于和活于教材。化学反应速率的概念和计算、化学平衡的特征和标志、外界条件对化学反应速率和化学平衡的影 响等 主干知识得到了突出的考查。 3 、考查基础,角度丰富,凸现热点题型 高 考反复和重点考查的都是化学基础知识和基本能力 。 反应速率的考查,一是通过图像或表格的数据分析影响反应速率的因素,二是反应速率的计算及应用; 化 学平衡中的基础知 识 则 全 方位、多角度地出现在平衡移动、图象分析、平衡计 算等 热点题型 中。 4 、注重整合,适度综合,增大知识覆盖面 此类题 涉 及多个知识点 的 考查 , 为体现学科内综合特点,增大知识覆盖面,往往是在一道题中对化学反应速率和化学平衡进 行简单 的 或 程度较高的综合,综合的形式 是 图像与表格交替出现, 对图 象进行分析、对表格中的多组数据进行处理、 在 答题 中 进 行综合设问等 。 5 、形式新颖,灵活多变,彰显能力立意 试题在题型上似乎没有明显的变化,但创新性仍是非常突出的。给人的感觉是化学反应速率的计算和平衡图象的分析更加灵活多 变 , 对 化学反应速率的变化、化学平衡移动的起因、过程和结果、多种平衡状态的比较等考查的更加透 彻 , 这 样的题目推陈出新,不落俗套,体现的是能力立意,考查的是灵活运用所学知识解决实际问题的能力 。 三、 错 因分析 4 、简答时,不会合理有效的应用反应原理解释问题。 1 、不能从题目中提取有效信息, 不 会 从 图像及表格中判断影响反应速率及平衡的因素; 2 、未能熟练掌握非金属元素及其化合物的知识,不能正确书写方程式,应用盖斯定律计算时数据处理不准确; 3 、对三段式法的应用不熟练; 化学学科 2016 年的 《 大纲 》 与去年几乎相同,这一信息说明今年化学学科的命题会遵循往年化学试题的命题原则和方向,无论试题形式还是试题内容都不会有太大改变。 《 说明 》 比 2015 年增加了 2 个选择题,一个为电化学,一个为电解质溶液 。 那可能 2016 年在高考中化学原理的考查比重会加大,尤其是选择题。必考非选择题部分新增了 2 个化学原理大题,其中一个涉及反应热、反应速率及化学平衡( 2015 国 I 卷 28 题),因此 2016 年可能会参考新增的典型事例题。 此类型题是对学生分析问题、解决实际问题能力的综合考查,有一定的陌生度,对考生的思维能力要求高,是高考能力考查的核心,应重视。 四 、 命题 预测 1 、稳 定 高考命题的指导思想一直是稳中有变, 2016 年 高考对化学平衡的考查也会在题型、题量、赋分、取材、命题风格上保持相对稳定 。因 此, 以 图像、表格、 实 验、计算相融合的综合题来考查化 学 速率及 平 衡的可能性也是存在的。 2 、创 新 创新是试题的灵魂和魅力所在。化学平衡中包含很广阔的创新空间,如化学反应速率和化学平衡的实验分析和设计、灵活多变的化学平衡图象、小巧新颖的速率和平衡计算等,特别是在情景、取材上创新,在图象上创新,化学平衡 的 思 想和勒夏特列原理在其它平衡体系中的应用等值得关注。 3 、迁 移 各 种不同类型的高考试卷之 间 可以 借 鉴迁移 。现行教 材 中 的 化 学反应速率的定量测定和曲线绘 制、 活化能、平衡常数、沉淀溶解平衡、溶度积 等知 识 , 通过借鉴变换,可以形成更能考查思维能力、 应 用能 力 的考题。 五 、 备考策略 高考考题中,对主干知识的考查基本不变,在非选择题的题型上,目前看来,反应热、化学平衡等化学原理题是比较固定地考查点,在教学备考中我认为可以做好以下几点: 1 、 分 析教材 , 归纳方法 由教材知识整合出知 识框架 , 化解知识难 点, 归纳 解题方法 。比如 ① 演 绎法:用 v — t 图象 来演 绎平衡建立与移动的过程,理解反应速率和化学平衡的内在联 系 ; ② “定一议二”和“先拐先平” 法 ; ③ 平 衡计 算 中 行 之有效的 “ 三段式 ” 法 ; ④ 等 效平衡中的“一边倒”、“投料量相同”、“投料比相同”等等 。 2 、 题型借鉴 拓展训练 高考试题的命题形式经常会发生变化,其实这种变化也不是“莫名其妙”的变化,是全国各地高考试题相互借鉴的结果。在平时的题型训练中,我们也要横向比较,参考借鉴其他自主命题省份的此类型题命题形式,拓展学生视野。 3 、 弱项突破 能 力 提高 全国卷的高考特别重视图表分析能力、计算能力、信息读取能力、实验分析能力等考查,所以在备考中应对这些能力做专项训练,加强对基本概念的理解,总结解题方法技巧,做到有的放矢,提高得分能力。 4 、 重视纠 错 消除盲 点 把平时练习中的错题收集起来,通过错题归纳总结,“知其然,知其所以然 ” , 消除 知 识盲点 。 且 做 练习时要由点及面,训练发散思维 , 提高审 题 和 排 除干扰的能 力 , 善于 利用基础知识和基本理论解决问题,以达到巩固基础知识的目的 。 5 、 概 念求 准 规范 书写 在复习过程中, 如 v 正、 v 逆、活化分子、平衡特征、平衡标志等概 念 ,要 理 解清楚,在简答题中 注 意概 念 描述 的 准确 性。 总之,这类题目多是结合 图像 和 表格 的形式出现,看上去多半是比较新颖的题目,但实际上总是包括了 定性分析 及 定量计算 ,而且所涉及的内容基本上是 反应热的计算和判断 、 盖斯定律的应用 、热 化学方程式的书写 、 影响速率和平衡的因素 、 平衡状态的判断 、 反应速率及平衡常数的计算 等,解题时看清要求,结合图像、表格提供的信息分析和挖掘,以建立已知和未知的关系,而且,此类试题还有一个特点是,各个 小题之间并不存在着必然的联系 ,有时是相对独立的,所以可以通过 分段解决 , 降低试题本身的难度,提高得分率 ,当然,必要时还是要考虑其间的联系和影响。查看更多