- 2021-04-21 发布 |
- 37.5 KB |
- 99页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届高考化学二轮复习化学反应速率与化学平衡课件(99张)
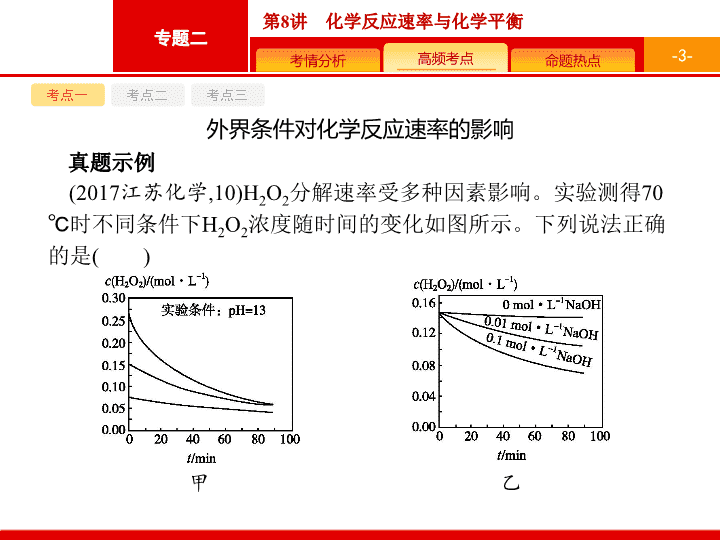
第 8 讲 化学反应速率与化学平衡 - 2 - - 3 - 考点 一 考点 二 考点三 外界条件对化学反应速率的影响 真题示例 (2017 江苏化学 ,10)H 2 O 2 分解速率受多种因素影响。实验测得 70 ℃ 时不同条件下 H 2 O 2 浓度随时间的变化如图所示。下列说法正确的是 ( ) 甲 乙 - 4 - 考点 一 考点 二 考点三 丙 丁 A. 图甲表明 , 其他条件相同时 ,H 2 O 2 浓度越小 , 其分解速率越快 B. 图乙表明 , 其他条件相同时 , 溶液 pH 越小 ,H 2 O 2 分解速率越快 C. 图丙表明 , 少量 Mn 2+ 存在时 , 溶液碱性越强 ,H 2 O 2 分解速率越快 D. 图丙和图丁表明 , 碱性溶液中 ,Mn 2+ 对 H 2 O 2 分解速率的影响大 答案 解析 解析 关闭 A 项 , 从图甲看 , 其他条件相同时 , 起始时 H 2 O 2 的浓度越小 , 对应曲线的斜率越小 , 则反应速率越慢 , 错误 ;B 项 , 从图乙看 , 其他条件相同时 , 溶液中 OH - 的浓度越大 ,pH 越大 , 对应曲线的斜率越大 , 则 H 2 O 2 分解得越快 , 错误 ;C 项 , 从图丙看 , 相同时间内 ,0.1 mol · L -1 NaOH 溶液条件下 ,H 2 O 2 分解速率最快 ,0 mol · L -1 NaOH 溶液的条件下 ,H 2 O 2 分解速率最慢 , 而 1.0 mol · L -1 NaOH 溶液的条件下 ,H 2 O 2 分解速率处于二者之间 , 错误。 答案 解析 关闭 D - 5 - 考点 一 考点 二 考点三 误区警示 1 . 化学反应速率计算的常见错误 (1) 不注意容器的容积。 (2) 漏写单位或单位写错。 (3) 忽略有效数字。 2 . 比较化学反应速率大小的注意事项 (1) 看单位是否统一 , 若不统一 , 要换算成相同单位。 (2) 比较不同时间段内的化学反应速率大小时 , 可先换算成用同一物质表示的反应速率 , 再比较数值的大小。 - 6 - 考点 一 考点 二 考点三 考点突破 1 . 化学反应速率的计算 ① 浓度变化只适用于气体和溶液中的溶质 , 不适用于固体和纯液体。 ② 化学反应速率是某段时间内的平均反应速率 , 而不是瞬时速率 , 且计算时取正值。 ③ 同一反应用不同的物质表示反应速率时 , 数值可能不同 , 但意义相同。同一化学反应中用不同物质表示的反应速率之比等于其化学计量数之比。 (2) 比值法 : 同一化学反应 , 各物质的反应速率之比等于方程式中各物质的化学计量数之比。如对于反应 : m A(g)+ n B(g) p C(g)+ q D(g), 存在 - 7 - 考点 一 考点 二 考点三 2 . 气体反应体系中充入惰性气体 ( 或无关气体 ) 时 , 对反应速率的影响 - 8 - 考点 一 考点 二 考点三 3 . 外界条件对可逆反应的正、逆反应速率的影响方向是一致的 , 但影响程度不一定相同。 (1) 当增大反应物浓度时 , v ( 正 ) 瞬间增大 , 随后逐渐减小 ; v ( 逆 ) 瞬间不变 , 随后逐渐增大 ; 直至 v ( 正 ) 和 v ( 逆 ) 相等时达到平衡。 (2) 增大压强 , 气体分子数减小方向的反应速率变化程度大。 (3) 对于反应前后气体分子数不变的反应 , 改变压强可以同等程度地改变正、逆反应速率。 (4) 升高温度 , v ( 正 ) 和 v ( 逆 ) 都增大 , 但吸热反应方向的反应速率增大的程度大。 (5) 使用催化剂 , 能同等程度地改变正、逆反应速率。 - 9 - 考点 一 考点 二 考点三 应考训练 考向 1 化学反应速率的影响因素 1 .(2019 石景山区高三统练 ) 资料显示 : 自催化作用是指反应产物之一使该反应速率加快的作用。用稀硫酸酸化的 KMnO 4 进行下列三组实验 , 一段时间后溶液均褪色 (0.01 mol·L -1 可以记作 0.01M) 。 - 10 - 考点 一 考点 二 考点三 - 11 - 考点 一 考点 二 考点三 下列说法不正确的是 ( ) A. 实验 ① 中发生氧化还原反应 ,H 2 C 2 O 4 是还原剂 , 产物 MnSO 4 能起自催化作用 B. 实验 ② 褪色比 ① 快 , 是因为 MnSO 4 的催化作用加快了反应速率 C. 实验 ③ 褪色比 ① 快 , 是因为 Cl - 的催化作用加快了反应速率 D. 若用 1 mL 0.2M 的 H 2 C 2 O 4 做实验 ① , 推测比实验 ① 褪色快 答案 解析 解析 关闭 由分析可知 , 实验①中发生氧化还原反应 ,H 2 C 2 O 4 是还原剂 , 生成 MnSO 4 能起自催化作用 , 故 A 正确 ; 实验②加入了 MnSO 4 固体后 , 褪色比①快 , 说明 MnSO 4 的催化作用加快了反应速率 , 故 B 正确 ; 实验③加入了稀盐酸之后 ,Cl - 与 KMnO 4 发生氧化还原反应 , 所以褪色比①快 ,Cl - 是还原剂不是催化剂 , 故 C 错误 ; 若用 1 mL 0.2M 的 H 2 C 2 O 4 做实验① , 还原剂 H 2 C 2 O 4 的浓度增大 , 反应速率更快 , 可推测比实验①褪色快 , 故 D 正确。 答案 解析 关闭 C - 12 - 考点 一 考点 二 考点三 考向 2 化学反应速率的计算 2 .(2019 安徽肥东高中高三调研 ) 一定条件下 , 反应 4NH 3 (g)+ 5O 2 (g) 4NO(g )+6H 2 O(g) Δ H =- a kJ·mol -1 在 5 L 密闭容器中进行 ,10 s 时 , 水蒸气的物质的量增加了 0.60 mol 。则下列说法不正确的是 ( ) A.10 s 内 ,NH 3 的平均反应速率为 0.008 mol·(L·s) -1 B. 该反应达到平衡时 6 v 正 (O 2 )=5 v 逆 (H 2 O) C.10 s 内 , 反应放出的热量为 0.1 a kJ D.10 s 时 ,H 2 O 的反应速率为 0.012 mol·(L·s) -1 答案 解析 解析 关闭 答案 解析 关闭 - 13 - 考点 一 考点 二 考点三 考向 3 化学反应速率的图像分析 3 .(2019 河北唐山一中高三冲刺 ) 恒容条件下 ,1 mol SiHCl 3 发生如下反应 :2SiHCl 3 (g ) SiH 2 Cl 2 (g )+SiCl 4 (g) 。已知 : v 正 = v 消耗 (SiHCl 3 )= k 正 x 2 (SiHCl 3 ), v 逆 =2 v 消耗 (SiH 2 Cl 2 )= k 逆 x (SiH 2 Cl 2 ) x (SiCl 4 ), k 正 、 k 逆 分别为正、逆向反应速率常数 ( 仅与温度有关 ), x 为物质的量分数。如图是不同温度下 x (SiHCl 3 ) 随时间的变化。下列说法正确的是 ( ) - 14 - 考点 一 考点 二 考点三 A. 该反应为放热反应 , v 正 ,a < v 逆 ,b B. 达到化学平衡状态时 2 v 消耗 (SiHCl 3 )= v 消耗 (SiCl 4 ) D. T 2 K 时平衡体系中再充入 1 mol SiHCl 3 , 平衡正向移动 , x (SiH 2 Cl 2 ) 增大 答案 C - 15 - 考点 一 考点 二 考点三 - 16 - 考点 一 考点 二 考点三 - 17 - 考点 一 考点 二 考点三 考向 4 “ 控制变量 ” 思想在探究影响化学反应速率因素中的应用 4 . 铬是广泛存在于环境中的金属元素 , 在水体中主要以三价和六价铬的化合物为主 , 其中六价铬对人有害。通常含六价铬的酸性工业废水的处理流程为 : 为进一步研究初始 pH 和草酸的浓度对第 ② 步反应速率的影响 , 某学习小组设计对比实验如下表 : - 18 - 考点 一 考点 二 考点三 (1) 实验设计表中 z = ; (2) 实验甲中 O ~ t 1 时间段反应速率 v (Cr 3+ )= mol·(L·min) -1 ( 用含字母的代数式表示 ) 。 (3) 常温下 , 第 ③ 步反应生成的 Cr(OH) 3 在溶液中存在以下平衡 :Cr(OH) 3 (s ) Cr 3 + (aq)+3OH - (aq), 其溶度积 K sp [Cr(OH) 3 ]=1×10 -32 , 要使反应后溶液中 c (Cr 3+ ) 不高于 10 -5 mol·L -1 , 溶液的 pH 应调至 。 - 19 - 考点 一 考点 二 考点三 - 20 - 考点一 考点二 考点三 化学平衡及其影响因素 化学平衡常数及其计算 真题示例 1 .(2018 天津理综 ,5) 室温下 , 向圆底烧瓶中加入 1 mol C 2 H 5 OH 和含 1 mol HBr 的氢溴酸 , 溶液中发生反应 : C 2 H 5 OH+HBr C 2 H 5 Br+H 2 O , 充分反应后达到平衡。已知常压下 ,C 2 H 5 Br 和 C 2 H 5 OH 的沸点分别为 38.4 ℃ 和 78.5 ℃ 。下列有关叙述错误的是 ( ) A. 加入 NaOH, 可增大乙醇的物质的量 B. 增大 HBr 浓度 , 有利于生成 C 2 H 5 Br C. 若反应物均增大至 2 mol, 则两种反应物平衡转化率之比不变 D. 若起始温度提高至 60 ℃ , 可缩短反应达到平衡的时间 答案 解析 解析 关闭 加入 NaOH 能与 HBr 反应 , 平衡左移 , 可增大乙醇的物质的量 ,A 项正确 ; 增大反应物 HBr 的浓度 , 平衡右移 , 有利于生成 C 2 H 5 Br,B 项正确 ; 由于两种反应物的起始量相等 , 且反应中两种物质的化学计量数之比为 1 ∶ 1, 则两种反应物平衡转化率之比不变 ,C 项正确 ; 由于 C 2 H 5 Br 的沸点为 38.4 ℃ , 若起始温度提高至 60 ℃ , 则会造成 C 2 H 5 Br 的挥发 , 因此反应达到平衡的时间会延长 ,D 项错误。 答案 解析 关闭 D - 21 - 考点一 考点二 考点三 2 .(2019 全国 3,28 节选 ) 近年来 , 随着聚酯工业的快速发展 , 氯气的需求量和氯化氢的产出量也随之迅速增长。因此 , 将氯化氢转化为氯气的技术成为科学研究的热点。回答下列问题 : (1)Deacon 发明的直接氧化法为 :4HCl(g)+ O 2 (g) 2Cl 2 (g )+2H 2 O(g) 。下图为刚性容器中 , 进料浓度比 c (HCl) ∶ c (O 2 ) 分别等于 1 ∶ 1 、 4 ∶ 1 、 7 ∶ 1 时 HCl 平衡转化率随温度变化的关系 : - 22 - 考点一 考点二 考点三 可知反应平衡常数 K (300 ℃ ) K (400 ℃ )( 填 “ 大于 ” 或 “ 小于 ”) 。设 HCl 初始浓度为 c 0 , 根据进料浓度比 c (HCl) ∶ c (O 2 )=1 ∶ 1 的数据计算 K (400 ℃ )= ( 列出计算式 ) 。按化学计量比进料可以保持反应物高转化率 , 同时降低产物分离的能耗。进料浓度比 c (HCl) ∶ c (O 2 ) 过低、过高的不利影响分别是 。 (2) 在一定温度的条件下 , 进一步提高 HCl 的转化率的方法是 。 ( 写出 2 种 ) - 23 - 考点一 考点二 考点三 解析 (1) 分析任意一条平衡曲线可知 , 在进料浓度比固定的条件下 , 随着温度的升高 ,HCl 的平衡转化率降低 , 说明正反应为放热反应 , 由于 K 只与温度有关 , 升高温度 , 平衡逆向移动 , 平衡常数 K 减小 , 即 K (300 ℃ ) 大于 K (400 ℃ ) 。 根据进料浓度比及 HCl 的平衡转化率间的关系可知 , c (HCl) ∶ c (O 2 )=1 ∶ 1 的曲线为最上面的那条曲线 , 由该曲线可知 : 温度为 400 ℃ 时 HCl 的平衡转化率为 84% 。 根据条件可列三段式如下 : - 24 - 考点一 考点二 考点三 离两气体时导致能耗较高。而进料浓度比 c (HCl) ∶ c (O 2 ) 过高 , 则导致 HCl 的转化率过低 , 浪费原料。 (2) 在温度一定时 , 要增大 HCl 的平衡转化率 , 可采取的措施有 : 及时移走部分产物、增大体系压强等。 - 25 - 考点一 考点二 考点三 3 .(2018 全国 1,28) 采用 N 2 O 5 为硝化剂是一种新型的绿色硝化技术 , 在含能材料、医药等工业中得到广泛应用。回答下列问题 : (1)1840 年 Devil 用干燥的氯气通过干燥的硝酸银 , 得到 N 2 O 5 。该反应的氧化产物是一种气体 , 其分子式为 。 (2)F.Daniels 等曾利用测压法在刚性反应器中研究了 25 ℃ 时 N 2 O 5 (g) 分解反应 : 其中 NO 2 二聚为 N 2 O 4 的反应可以迅速达到平衡。体系的总压强 p 随时间 t 的变化如下表所示 [ t =∞ 时 ,N 2 O 5 (g) 完全分解 ]: - 26 - 考点一 考点二 考点三 ② 研究表明 ,N 2 O 5 (g) 分解的反应速率 v =2×10 -3 × ( kPa·min -1 ), t =62 min 时 , 测得体系 中 = 2.9 kPa, 则此时 的 = kPa , v = kPa·min -1 。 ③ 若提高反应温度至 35 ℃ , 则 N 2 O 5 (g) 完全分解后体系压强 p ∞ (35 ℃ ) 63.1 kPa( 填 “ 大于 ”“ 等于 ” 或 “ 小于 ”), 原因是 。 ④ 25 ℃ 时 N 2 O 4 (g ) 2NO 2 (g ) 反应的平衡常数 K p = kPa( K p 为以分压表示的平衡常数 , 计算结果保留 1 位小数 ) 。 - 27 - 考点一 考点二 考点三 (3) 对于反应 2N 2 O 5 (g) → 4NO 2 (g)+O 2 (g),R.A.Ogg 提出如下反应历程 : 第一步 N 2 O 5 NO 2 +NO 3 快速平衡 第二步 NO 2 +NO 3 → NO+NO 2 +O 2 慢反应 第三步 NO+NO 3 → 2NO 2 快反应 其中可近似认为第二步反应不影响第一步的平衡。下列表述正确的是 ( 填标号 ) 。 A. v ( 第一步的逆反应 )> v ( 第二步反应 ) B. 反应的中间产物只有 NO 3 C. 第二步中 NO 2 与 NO 3 的碰撞仅部分有效 D. 第三步反应活化能较高 - 28 - 考点一 考点二 考点三 答案 (1)O 2 (2) ① 53.1 ② 30.0 6.0×10 -2 ③ 大于 温度提高 , 体积不变 , 总压强提高 ;NO 2 二聚为放热反应 , 温度提高 , 平衡左移 , 体系物质的量增加 , 总压强提高 ④ 13.4 (3)AC 解析 (1) 干燥的氯气与干燥的 AgNO 3 之间发生氧化还原反应时 , 氯气作氧化剂 , 而 AgNO 3 中 Ag 、 N 元素都处于最高价 , 所以被氧化的只能为氧元素 , 则得到的气体为氧气。 - 29 - 考点一 考点二 考点三 - 30 - 考点一 考点二 考点三 - 31 - 考点一 考点二 考点三 考点突破 1 . 化学平衡状态的标志 (1) 绝对标志。 - 32 - 考点一 考点二 考点三 (2) 相对标志。 ① 有气体参加的反应 , 气体的总压强、总体积、总物质的量不变时 , 如果是等体积反应时 , 不一定达到平衡 ; 如果是不等体积反应时 , 一定达到平衡。 ③ 如果平衡体系中的物质有颜色 , 则平衡体系的颜色不变时 , 一定达到平衡。 - 33 - 考点一 考点二 考点三 2 . 分析化学平衡移动的一般 思路 - 34 - 考点一 考点二 考点三 3 . 物质转化率的变化规律 ( 恒容容器中 ) 对于反应 m A(g)+ n B(g ) p C(g )+ q D(g): ① 增加 A 的量 , 平衡正向移动 ,B 的转化率增大 ,A 的转化率减小。 ② 若按原比例同倍数地增加反应物 A 和 B 的量 , 则平衡向正反应方向移动 , 反应物的转化率与气体反应物的化学计量数有关 : 若 m + n = p + q ,A 、 B 的转化率都不变。 若 m + n > p + q ,A 、 B 的转化率都增大。 若 m + n < p + q ,A 、 B 的转化率都减小。 - 35 - 考点一 考点二 考点三 4 . 化学平衡计算的基本模式 ——“ 三段式 ” 根据反应进行 ( 或平衡移动 ) 的方向 , 设出某反应物消耗的量 , 然后列式求解 。 起始量 : a b 0 0 变化量 : mx nx px qx 平衡量 : a - mx b - nx px qx 其中 : ① 各物质的变化量之比等于化学方程式中各物质的化学计量数之比。 ② 这里 a 、 b 可指物质的量、浓度、气体体积等。 ③ 弄清起始量、平衡量、平衡转化率三者之间的互换关系。 ④ 在计算平衡常数时 , 要注意反应物或生成物的状态 。 - 36 - 考点一 考点二 考点三 注意 :(1) 反应起始时 , 反应物和生成物可能同时存在。 (2) 由于起始浓度是人为控制的 , 故不同的物质起始浓度比不一定等于化学计量数之比。若反应物起始浓度之比等于化学计量数之比 , 则隐含着各反应物转化率相等 , 且平衡时各反应物的浓度之比等于化学计量数之比。 (3) 起始浓度、平衡浓度不一定等于化学计量数之比 , 但物质之间是按化学计量数之比反应和生成的 , 故各物质的浓度变化之比一定等于化学计量数之比 , 这是计算的关键。 - 37 - 考点一 考点二 考点三 应考训练 考向 1 化学平衡状态的判断 1 .(2019 黑龙江哈尔滨第六中学高三期中 ) 在一定温度下的恒压容器中 , 进行可逆反应 A(g)+B(g ) C(g )+2D(g) 。下列能说明该反应达到平衡状态的是 ( ) ① 反应混合物的密度不再改变 ② 混合气体的平均相对分子质量不再改变 ③ C 和 D 的物质的量之比为 1 ∶ 2 ④ 体系压强不再改变 ⑤ C 的质量分数不再改变 ⑥ v (A) ∶ v (C)=1 ∶ 1 A. ①②④⑤ B. ①②⑤ C. ②⑤⑥ D. ①②③④⑤⑥ 答案 解析 解析 关闭 答案 解析 关闭 - 38 - 考点一 考点二 考点三 考向 2 外界条件对化学平衡的影响 2 . 一定温度下 , 某容器中加入足量的碳酸钙 , 发生反应 CaCO 3 (s ) CaO(s )+CO 2 (g) 。达到平衡 , 下列说法正确的是 ( ) A. 将体积缩小为原来的一半 , 当体系再次达到平衡时 ,CO 2 的浓度不变 B. 将体积增大为原来的 2 倍 , 再次达到平衡时 , 气体的密度变大 C. 因 CaCO 3 (s) 需加热条件才分解生成 CaO(s) 和 CO 2 (g), 所以是 Δ H <0 D. 保持容器压强不变 , 充入 He, 平衡向逆反应方向进行 答案 解析 解析 关闭 答案 解析 关闭 - 39 - 考点一 考点二 考点三 考向 3 化学平衡常数的计算与应用 3 .(2019 湖北名校联盟高三第三次模拟 )C 、 N 、 S 的氧化物常会造成一些环境问题 , 科研工作者正在研究用各种化学方法来消除这些物质对环境的不利影响。在 500 ℃ 下合成甲醇的反应原理为 : CO 2 (g)+3H 2 (g ) CH 3 OH(g )+H 2 O(g) 。在 1 L 的密闭容器中 , 充入 1 mol CO 2 和 3 mol H 2 , 压强为 p 0 kPa, 测得 CO 2 (g) 和 CH 3 OH(g) 的浓度随时间的变化如图所示 ( 可逆反应的平衡常数可以用平衡浓度计算 , 也可以用平衡分压代替平衡浓度计算 K p , 分压 = 总压 × 物质的量分数 ) 。 - 40 - 考点一 考点二 考点三 (1) 反应进行到 4 min 时 , v ( 正 ) ( 填 “>”“<” 或 “=”) v ( 逆 ) 。 0~4 min 时 H 2 的平均反应速率 v (H 2 )= mol·(L·min) -1 。 (2)CO 2 平衡时的体积分数为 , 该温度下 K p 为 ( 用含有 p 0 的式子表示 ) 。 (3) 下列能说明该反应已达到平衡状态的是 。 A. v 正 (CH 3 OH)=3 v 逆 (H 2 ) B.CO 2 、 H 2 、 CH 3 OH 和 H 2 O 浓度之比为 1 ∶ 3 ∶ 1 ∶ 1 C. 恒温恒压下 , 气体的体积不再变化 D. 恒温恒容下 , 气体的密度不再变化 - 41 - 考点一 考点二 考点三 (4)500 ℃ 时 , 在 2 个容积都是 2 L 的密闭容器中 , 按不同方式投入反应物 , 保持恒温、恒容 , 测得反应达到平衡时的有关数据如下 : 则容器乙中反应起始向 方向进行 ; c 1 ( 填 “>”“<” 或 “=”) c 2 。 - 42 - 考点一 考点二 考点三 - 43 - 考点一 考点二 考点三 - 44 - 考点一 考点 二 考点三 化学反应速率与化学平衡的有关 图像 A. 反应 2NO(g)+O 2 (g ) === 2NO 2 (g ) 的 Δ H >0 B. 图中 X 点所示条件下 , 延长反应时间能提高 NO 转化率 C. 图中 Y 点所示条件下 , 增加 O 2 的浓度不能提高 NO 转化率 D.380 ℃ 下 , c 起始 (O 2 )=5.0×10 -4 mol·L -1 ,NO 平衡转化率为 50%, 则平衡常数 K >2 000 真题示例 1 .(2019 江苏化学 ,15) 在恒压、 NO 和 O 2 的起始浓度一定的条件下 , 催化反应相同时间 , 测得不同温度下 NO 转化为 NO 2 的转化率如下图中实线所示 ( 图中虚线表示相同条件下 NO 的平衡转化率随温度的变化 ) 。下列说法正确的是 ( ) 答案 解析 解析 关闭 答案 解析 关闭 - 45 - 考点一 考点 二 考点三 2 .(2019 全国 2,27 节选 ) 环戊二烯 ( ) 是重要的有机化工原料 , 广泛用于农药、橡胶、塑料等生产。回答下列问题 : (1) 某温度下 , 等物质的量的碘和环戊烯 ( ) 在刚性容器内发生反应 ③ , 起始总压为 10 5 Pa, 平衡时总压增加了 20%, 环戊烯的转化率为 , 该反应的平衡常数 K p = Pa 。达到平衡后 , 欲增加环戊烯的平衡转化率 , 可采取的措施有 ( 填标号 ) 。 A. 通入惰性气体 B. 提高温度 C. 增加环戊烯浓度 D. 增加碘浓度 - 46 - 考点一 考点 二 考点三 (2) 环戊二烯容易发生聚合生成二聚体 , 该反应为可逆反应。不同温度下 , 溶液中环戊二烯浓度与反应时间的关系如图所示 , 下列说法正确的是 ( 填标号 ) 。 A. T 1 >T 2 B.a 点的反应速率小于 c 点的反应速率 C.a 点的正反应速率大于 b 点的逆反应速率 D.b 点时二聚体的浓度为 0.45 mol·L -1 - 47 - 考点一 考点 二 考点三 答案 (1)40% 3.56×10 4 BD ( 2)CD 解析 (1) 温度、体积一定 , 压强与物质的量成正比 , 则起始状态碘和环戊烯的分压分别为 5×10 4 Pa, 设环戊烯的转化率为 x , 根据反应 : 起始 /Pa 5×10 4 5×10 4 0 0 转化 /Pa 5×10 4 x 5×10 4 x 5×10 4 x 1×10 5 x 平衡 /Pa 5×10 4 (1- x ) 5×10 4 (1- x ) 5×10 4 x 1×10 5 x 根据平衡时总压增加了 20%, 则 5×10 4 (1- x ) Pa+5×10 4 (1- x ) Pa+5×10 4 x Pa+1×10 5 x Pa=1.2×10 5 Pa 解得 x =0.4, 即环戊烯的转化率为 40% 。平衡时各物质的分压为 p ( 环戊烯 )=3×10 4 Pa, p (I 2 )=3×10 4 Pa, p ( 环戊二烯 )=2×10 4 Pa , - 48 - 考点一 考点 二 考点三 通 入惰性气体 , 不会引起各物质的浓度的变化 , 反应速率不变 , 平衡不移动 , 环戊烯的平衡转化率不变 ,A 项不符合题意 ; 由于该反应为吸热反应 , 故升高温度使平衡向右移动 , 环戊烯的平衡转化率增大 ,B 项符合题意 ; 增加一种物质的量 , 自身的转化率减少 , 而其他反应物的转化率增大 , 增加环戊烯浓度 , 环戊烯的平衡转化率减小 , 增加碘浓度 , 环戊烯的平衡转化率增大 ,C 项不符合题意 ,D 项符合题意。 - 49 - 考点一 考点 二 考点三 (2) 根据曲线的变化趋势可知 , T 2 温度下反应速率大 , 因此 T 2 大于 T 1 ,A 项错误 ;a 点、 c 点对应的反应物的浓度、温度都不同 , 无法比较 a 、 c 两点的反应速率的大小 ,B 项错误 ;a 点的正反应速率大于 b 点的正反应速率 , 而 b 点还没有达到平衡 , 因此 b 点的正反应速率大于其逆反应速率 , 则 a 点的正反应速率大于 b 点的逆反应速率 ,C 项正确 ; 根据曲线可知 , 环戊二烯的初始浓度为 1.5 mol · L -1 ,b 点环戊二烯的浓度为 0.6 mol · L -1 , 环戊二烯的浓度变化量为 0.9 mol · L -1 , 因此 b 点二聚体的浓度为 0.45 mol · L -1 ,D 项正确。 - 50 - 考点一 考点 二 考点三 3 .(2018 全国 2,27)CH 4 -CO 2 催化重整不仅可以得到合成气 (CO 和 H 2 ), 还对温室气体的减排具有重要意义。回答下列问题 : (1)CH 4 -CO 2 催化重整反应为 :CH 4 (g)+CO 2 (g ) === 2CO(g )+2H 2 (g) 。 已知 : 该催化重整反应的 Δ H = kJ·mol -1 , 有利于提高 CH 4 平衡转化率的条件是 ( 填标号 ) 。 A. 高温 低压 B . 低温 高压 C . 高温 高压 D . 低温低压 某温度下 , 在体积为 2 L 的容器中加入 2 mol CH 4 、 1 mol CO 2 以及催化剂进行重整反应 , 达到平衡时 CO 2 的转化率是 50%, 其平衡常数为 mol 2 ·L -2 。 - 51 - 考点一 考点 二 考点三 (2) 反应中催化剂活性会因积碳反应而降低 , 同时存在的消碳反应则使积碳量减少 , 相关数据如下表 : - 52 - 考点一 考点 二 考点三 ① 由上表判断 , 催化剂 X Y( 填 “ 优于 ” 或 “ 劣于 ”), 理由是 。在反应进料气组成、压强及反应时间相同的情况下 , 某催化剂表面的积碳量随温度的变化关系如图所示 , 升高温度时 , 下列关于积碳反应、消碳反应的平衡常数 ( K ) 和速率 ( v ) 的叙述正确的是 ( 填标号 ) 。 A. K 积 、 K 消 均增加 B. v 积 减小、 v 消 增加 C. K 积 减小、 K 消 增加 D. v 消 增加的倍数比 v 积 增加的倍数大 - 53 - 考点一 考点 二 考点三 ② 在一定温度下 , 测得某催化剂上沉积碳的生成速率方程为 v=k · p (CH 4 )·[ p (CO 2 )] -0.5 ( k 为速率常数 ), 在 p (CH 4 ) 一定时 , 不同 p (CO 2 ) 下积碳量随时间的变化趋势如下图所示 , 则 p a (CO 2 ) 、 p b (CO 2 ) 、 p c (CO 2 ) 从大到小的顺序为 。 - 54 - 考点一 考点 二 考点三 (2) ① 劣于 相对于催化剂 X, 催化剂 Y 积碳反应的活化能大 , 积碳反应的速率小 ; 而消碳反应活化能相对较小 , 消碳反应速率大 AD ② p c (CO 2 ) 、 p b (CO 2 ) 、 p a (CO 2 ) 解析 (1) 将已知热化学方程式依次编号为 ①②③ , 根据盖斯定律 , ③ ×2- ① - ② , 得到 CH 4 —CO 2 催化重整反应的 Δ H =+247 kJ · mol -1 。由于该反应是正反应气体体积增大的吸热反应 , 所以有利于提高 CH 4 平衡转化率的条件是高温低压 ,A 项正确。某温度下 , 在体积为 2 L 的容器中加入 2 mol CH 4 ,1 mol CO 2 , 达到平衡时 CO 2 的转化率是 50%, 则平衡时各物质的物质的量浓度分别为 c (CH 4 )=0.75 mol · L -1 、 c (CO 2 )=0.25 mol · L -1 、 c (CO)=0.5 mol · L -1 、 c (H 2 )=0.5 mol · L -1 , 根据 - 55 - 考点一 考点 二 考点三 (2) ① 根据表格中活化能数据分析 , 催化剂 X 劣于催化剂 Y 。因为相对于催化剂 X, 催化剂 Y 积碳反应的活化能大 , 积碳反应的速率小 , 而消碳反应活化能相对较小 , 消碳反应速率大。由于积碳反应和消碳反应均为吸热反应 , 所以升高温度平衡正向移动 , K 积 、 K 消 均增加 ; 温度高于 600 ℃ 时 , 积碳量随温度的升高而下降 , 说明 v 消 增加的倍数比 v 积 增加的倍数大 ,A 、 D 两项正确。 ② 根据 v = k·p (CH 4 ) · [ p (CO 2 )] -0.5 , 当 p (CH 4 ) 一定时 , 积碳量随 p (CO 2 ) 的增大而减小 , 故 p c (CO 2 )> p b (CO 2 )> p a (CO 2 ) 。 - 56 - 考点一 考点 二 考点三 考点突破 1 . 常见基本图像 [ 以反应 m A(g)+ n B(g) p C(g )+ q D(g) 为例 , 已知该反应 Δ H >0, m + n > p + q ] (1) 速率曲线图 : - 57 - 考点一 考点 二 考点三 (2) 转化率曲线图 : - 58 - 考点一 考点 二 考点三 2 . 几种特殊的图像 (1) 对于化学反应 m A(g)+ n B(g ) p C(g )+ q D(g), 如下图甲、乙 , M 点之前 , 表示从反应物开始 , v ( 正 )> v ( 逆 ); M 点为达到平衡 ; M 点之后为平衡受温度的影响情况 , 即升温时 A 的百分含量增加、 C 的百分含量减少 , 平衡左移 , 故正反应的 Δ H <0 。 (2) 对于化学反应 m A(g)+ n B(g ) p C(g )+ q D(g), 如上图丙 , l 曲线上所有的点都是平衡点。 l 曲线的左上方 ( E 点 )A 的百分含量大于此压强时平衡体系的 A 的百分含量 , 所以 E 点时 v ( 正 )> v ( 逆 ); 则 l 曲线的右下方 ( F 点 ) v ( 正 )< v ( 逆 ) 。 - 59 - 考点一 考点 二 考点三 3 . 速率、平衡图像题的分析方法 (1) 认清坐标系 , 弄清纵、横坐标所代表的意义 , 并与有关原理相结合。 (2) 看清起点 , 分清反应物、生成物 , 浓度减小的是反应物 , 浓度增大的是生成物 , 一般生成物多数以原点为起点。 (3) 看清曲线的变化趋势 , 注意渐变和突变 , 分清正、逆反应曲线 , 从而判断反应特点。 (4) 注意终点。例如 , 在浓度 — 时间图像上 , 一定要看清平衡时反应物的消耗量、生成物的增加量 , 并结合有关原理进行推理判断。 (5) 图像中先拐先平数值大。例如 , 在转化率 — 时间图像上 , 先出现拐点的曲线先达到平衡 , 此时逆向推理可得该曲线对应的温度高、浓度大或压强大。 (6) 定一议二原则。当图像中有三个量时 , 先确定一个量不变再讨论另外两个量的关系。 - 60 - 考点一 考点 二 考点三 应考训练 考向 1 通过图像分析题考查反应速率、化学平衡知识的综合应用 1 .(2019 浙江台州中学统练 ) 已知反应 : 2A(l) B(l ) Δ H =- Q kJ·mol -1 , Q >0 。 取等量 A 分别在 0 ℃ 和 20 ℃ 下反应 , 测 得 其转化率 Y 随时间 t 变化的关系曲线 ( Y - t 曲线 ) 如图 所示。下列说法正确的是 ( ) A.a 代表 20 ℃ 下 A 的 Y - t 曲线 B. 反应到 66 min 时 ,0 ℃ 和 20 ℃ 下反应放出的热量相等 C.0 ℃ 和 20 ℃ 下达到平衡时 , 反应都放出 Q kJ 热量 D. 反应都达到平衡后 , 正反应速率 a>b 答案 解析 解析 关闭 答案 解析 关闭 - 61 - 考点一 考点 二 考点三 考向 2 以表格分析题考查反应速率、化学平衡知识的综合应用 2 .(2019 福建三明高三期末 ) 已知 :N 2 O 4 (g ) 2NO 2 (g ) Δ H =+ Q kJ·mol -1 ( Q >0),80 ℃ 时在 2 L 密闭容器中充入 0.40 mol N 2 O 4 , 发生反应获得如下数据 : 下列判断正确的是 ( ) A. 升高温度会使混合气体的颜色变浅 B. 反应达平衡时 , 吸收的热量为 0.30 Q kJ C.20~40 s 内 , v (N 2 O 4 )=0.004 mol·(L·s) -1 D.100 s 时再充入 0.40 mol N 2 O 4 , 达到新平衡时 N 2 O 4 的转化率增大 答案 解析 解析 关闭 答案 解析 关闭 - 62 - 热点 ( 六 ) 化学反应原理综合题解题策略 一、题型分析 本题型一般取材于能源问题、环境问题、化工生产等情景 , 题目围绕一个主题 , 以 “ 拼盘 ” 的形式呈现 , 将热化学、化学反应速率、电化学及三大平衡知识融合在一起进行考查 , 每个小题相对独立。题目中通常结合图像、表格、数据、装置等给出信息 , 考查考生的读图、分析、归纳等能力 , 试题的难度较大。考点主要涉及盖斯定律的应用、热化学方程式的书写、化学反应速率的计算及其影响因素的分析、平衡常数的计算及其影响因素的分析、化学平衡移动及其影响因素的分析、电极反应方程式的书写等。 - 63 - 二、重难考向剖析 考向 1 化学图表、图像等信息的提取和加工 【例 1 】 (2019 全国 1,28) 水煤气变换 [CO(g)+H 2 O(g ) CO 2 (g )+H 2 (g)] 是重要的化工过程 , 主要用于合成氨、制氢以及合成气加工等工业领域中。回答下列问题 : (1)Shibata 曾做过下列实验 : ① 使纯 H 2 缓慢地通过处于 721 ℃ 下的过量氧化钴 CoO(s), 氧化钴部分被还原为金属钴 Co(s), 平衡后气体中 H 2 的物质的量分数为 0.025 0 。 ② 在同一温度下用 CO 还原 CoO(s), 平衡后气体中 CO 的物质的量分数为 0.019 2 。 根据上述实验结果判断 , 还原 CoO(s) 为 Co(s) 的倾向是 CO H 2 ( 填 “ 大于 ” 或 “ 小于 ”) 。 - 64 - (2)721 ℃ 时 , 在密闭容器中将等物质的量的 CO(g) 和 H 2 O(g) 混合 , 采用适当的催化剂进行反应 , 则平衡时体系中 H 2 的物质的量分数为 ( 填标号 ) 。 A.<0.25 B.0.25 C.0.25~0.50 D.0.50 E.> 0.50 - 65 - 可知水煤气变换的 Δ H 0( 填 “ 大于 ”“ 等于 ” 或 “ 小于 ”), 该历程中最大能垒 ( 活化能 ) E 正 = eV, 写出该步骤的化学方程式 。 (3) 我国学者结合实验与计算机模拟结果 , 研究了在金催化剂表面上水煤气变换的反应历程 , 如图所示 , 其中吸附在金催化剂表面上的物种用 * 标注。 - 66 - (4)Shoichi 研究了 467 ℃ 、 489 ℃ 时水煤气变换中 CO 和 H 2 分压随时间变化关系 ( 如下图所示 ), 催化剂为氧化铁 , 实验初始时体系中 的 计算曲线 a 的反应在 30~90 min 内的 平均速率 ( a)= kPa·min -1 。 467 ℃ 时 和 p CO 随时间变化关系的曲线分别是 、 。 489 ℃ 时 和 p CO 随时间变化关系的曲线分别是 、 。 - 67 - 答案 : (1) 大于 (2)C (3) 小于 2.02 COOH * +H * +H 2 O * === COOH * +2H * +OH * ( 或 H 2 O * === H * +OH * ) (4)0.004 7 b c d a 解析 : (1) 因平衡后气体 CO 的物质的量分数小于氢气的物质的量分数 , 因此 CO 还原 CoO(s) 为 Co(s) 的倾向大于氢气还原 CoO(s) 为 Co(s) 的倾向。 - 68 - - 69 - 当 x =0.5 时 , 氢气的物质的量分数为 0.25, 当完全反应时 , 氢气的物质的量分数为 0.5, 因此平衡时氢气的物质的量分数应介于 0.25 和 0.5 之间 , 所以 C 项正确。 (3) 由图示可知 , 最终生成物的相对能量低于反应物的相对能量 , 所以该反应为放热反应 , 即 Δ H <0 。由图示可知 , 该历程中最大活化能为 2.02 eV, 即最大能垒为 2.02 eV 。由图示给出参加反应的微粒和生成的微粒可知 , 该步骤的化学方程式为 COOH * +H * +H 2 O * === COOH * +2H * +OH * ( 或 H 2 O * === H * +OH * ) 。 - 70 - - 71 - 【例 2 】 (2018 全国 3,28) 三氯氢硅 (SiHCl 3 ) 是制备硅烷、多晶硅的重要原料。回答下列问题 : (1)SiHCl 3 在常温常压下为易挥发的无色透明液体 , 遇潮气时发烟生成 (HSiO) 2 O 等 , 写出该反应的化学方程式 。 (2)SiHCl 3 在催化剂作用下发生反应 : - 72 - (3) 对于反应 2SiHCl 3 (g ) === SiH 2 Cl 2 (g )+SiCl 4 (g), 采用大孔弱碱性阴离子交换树脂催化剂 , 在 323 K 和 343 K 时 SiHCl 3 的转化率随时间变化的结果如图所示 。 ① 343 K 时反应的平衡转化率 α = % 。 平衡常数 K 343 K = ( 保留 2 位小数 ) 。 ② 在 343 K 下 : 要提高 SiHCl 3 转化率 , 可采取的措施是 ; 要缩短反应达到平衡的时间 , 可采取的措施有 、 。 - 73 - 答案 : ( 1)2SiHCl 3 +3H 2 O === (HSiO) 2 O+6HCl (2)114 (3) ① 22 0.02 ② 及时移去产物 改进催化剂 提高反应物压强 ( 浓度 ) ③ 大于 1.3 - 74 - (3) ① 由图根据 “ 先拐先平速率大 ” 可知 a 曲线温度较高 (343 K), 平衡转化率为 22%; 设 SiHCl 3 起始物质的量为 1 mol, 则有 - 75 - ③ a 处反应相当于在 b 处反应的基础上升高温度 , 反应速率 v a 大于 v b ; a 处 SiHCl 3 转化率为 20%, 设起始时 SiHCl 3 物质的量为 1 mol, 则有 : - 76 - 解题策略 1 . 图表类分析 (1) 明确图表所呈现的化学含义 , 如物质的量浓度变化 ( 质量分数变化 ) 与时间的二维关系等。 (2) 通过图表明确相应数学规律 , 分析变化趋势等 , 如正向或逆向变化、极值点等。 (3) 结合题意及图表规律分析确定其对应的化学原理 , 并提炼出相应变化规律及原因。 - 77 - 2 . 图像类分析 (1) 明确纵、横坐标所表示的化学含义 , 这是理解题意和进行正确思维的前提。明确坐标含义 , 也就是用变量的观点分析坐标 , 找出纵、横坐标的关系 , 再结合题目 , 联系相应的知识点。 (2) 找出曲线中的特殊点 ( 起点、顶点、拐点、终点、交叉点、平衡点等 ), 分析这些点所表示的化学意义以及影响这些点的主要因素及限制因素等 , 大多考题就落在这些点的含义分析上 , 因为这些点往往隐含着某些限制条件或某些特殊的化学含义。 (3) 正确分析曲线的走向、变化趋势 ( 上升、下降、平缓、转折等 ), 同时对走势有转折变化的曲线 , 要分段进行分析 , 找出各段曲线的变化趋势及其含义。 在绘制图像时通常题目会有参考的曲线 , 要在分析新的条件与原曲线对应条件关系的基础上进行绘制。 - 78 - 考向 2 化学反应原理的语言表达 【例 3 】 (2019 北京理综 ,27) 氢能源是最具有应用前景的能源之一 , 高纯氢的制备是目前的研究热点。 (1) 甲烷水蒸气催化重整是制高纯氢的方法之一。 ① 反应器中初始反应的生成物为 H 2 和 CO 2 , 其物质的量之比为 4 ∶ 1, 甲烷和水蒸气反应的方程式是 。 ② 已知反应器中还存在如下反应 : …… ⅲ 为积碳反应 , 利用 Δ H 1 和 Δ H 2 计算 Δ H 3 时 , 还需要利用 反应的 Δ H 。 - 79 - ③ 反应物投料比采用 n (H 2 O) ∶ n (CH 4 )=4 ∶ 1, 大于初始反应的化学计量数之比 , 目的是 ( 选填字母序号 ) 。 a. 促进 CH 4 转化 b. 促进 CO 转化为 CO 2 c. 减少积碳生成 ④ 用 CaO 可以去除 CO 2 。 H 2 体积 分数 和 CaO 消耗率随时间变化关系如下 图 所 示。 从 t 1 时开始 ,H 2 体积分数显著降低 , 单位时间 CaO 消耗率 ( 填 “ 升高 ”“ 降低 ” 或 “ 不变 ”) 。此时 CaO 消耗率约为 35%, 但已失效 , 结合化学方程式解释原因 : 。 - 80 - (2) 可利用太阳能光伏电池电解水制高纯氢 , 工作示意图如下。通过控制开关连接 K 1 或 K 2 , 可交替得到 H 2 和 O 2 。 ① 制 H 2 时 , 连接 。 产生 H 2 的电极方程式是 。 ② 改变开关连接方式 , 可得 O 2 。 ③ 结合 ① 和 ② 中电极 3 的电极反应式 , 说明电极 3 的作用 : 。 - 81 - - 82 - - 83 - - 84 - 解题策略 (1) 通读全题。明确题中有哪些考点 , 并弄清相关考点的上下文联系 , 如反应条件与平衡移动间的关系等。 (2) 准确定位。即准确判断该题中针对文字表达的知识点。通过题中所给信息确定文字表达知识点所涉及的化学原理、化学规律 , 如针对速率变化、平衡移动、主副反应间的关系等。该点是解决此类题目的重中之重 , 若能准确判断所考查的化学原理 , 则文字表述便是水到渠成。 (3) 文字表述。先讲普遍原理 , 再结合题目论述。如升高温度有利于反应向吸热反应方向进行 , 若题给反应的正反应吸热 , 则升高温度时平衡将正向移动。 - 85 - 应考训练 1 .(2019 安徽合肥高三上学期调研 ) 氨作为重要的化工原料 , 被大量应用于工业生产。氨在不同催化剂条件下可发生下列两个反应 : ( 1) 写出 NO 分解生成 N 2 与 O 2 的热化学方程式 : 。 - 86 - (2) 反应 Ⅰ 在容积固定的密闭容器中进行 , 容器内部分物质的物质的量浓度如下表 : ① 反应从开始到第 2 min 时 , v (H 2 O)= 。 ② 在第 3 min 时 , 改变的反应条件可能是 ( 填选项字母 ) 。 A. 使用催化剂 B. 减小压强 C. 升高温度 D. 增加 O 2 的浓度 - 87 - ③ 该反应达到平衡状态的标志是 ( 填选项字母 ) 。 A. 在恒温恒容的容器中 , 混合气体的密度不再变化 B. 单位时间内消耗 n mol NO 的同时消耗 n mol NH 3 C. 百分含量 w (NH 3 )= w (NO) D. 反应速率 v (NH 3 ) ∶ v (O 2 ) ∶ v (NO) ∶ v (H 2 O)=4 ∶ 5 ∶ 4 ∶ 6 (3) ① 若在容积为 2 L 的密闭容器中充入 8 mol NH 3 (g) 和 6 mol O 2 (g) 发生反应 Ⅱ 。保持其他条件不变 , 在相同时间内测得 c (N 2 ) 与温度的关系如图所示。则 T 1 ℃ 下 ,NH 3 的平衡转化率为 。 ② 图中 a 、 c 两点对应的容器内部压强 p a p c ( 填 “>”“<” 或 “=”) 。 - 88 - - 89 - mol · (L · min) -1 ; ② 在第 3 min 后到 4 min, 根据数据可知反应按比例向逆反应方向进行 , 因为该反应为气体体积增大的放热反应 , 故使用催化剂不能使平衡移动 , 选项 A 不选 ; 减小压强平衡向气体体积增大的正反应方向移动 , 不符合 , 选项 B 不选 ; 升高温度平衡向逆反应方向移动 , 选项 C 符合题意 ; 增加 O 2 的浓度平衡向正反应方向移动 , 不符合题意 , 选项 D 不选 ; ③ 恒容条件下 , 气体的总质量不变 , 则混合气体的密度一直不变 , 密度不变不能作为达到平衡状态的标志 , 选项 A 错误 ; 单位时间内消耗 n mol NO 的同时消耗 n mol NH 3 , 符合正逆反应速率相等 , 可作为达到平衡状态的标志 , 选项 B 正确 ; 物质的百分含量 w (NH 3 )= w (NO) 不一定是平衡状态 , 所以不能作为达到平衡状态的标志 , 选项 C 错误 ; 用 NH 3 、 O 2 、 NO 、 H 2 O 的物质的量浓度变化表示的反应速率的比为 4 ∶ 5 ∶ 4 ∶ 6 的状态 , 不一定是平衡状态 , 所以不能作为达到平衡状态的标志 , 选项 D 错误。 - 90 - - 91 - 2 .(2019 山东潍坊高三二模 )CH 4 超干重整 CO 2 技术可得到富含 CO 的化工原料。回答下列问题。 (1)CH 4 超干重整 CO 2 的催化转化如图所示。 - 92 - ① 已知相关反应的能量变化如图所示 : 过程 Ⅰ 的热化学方程式为 。 ② 关于上述过程 Ⅱ 的说法不正确的是 ( 填序号 ) 。 a. 实现了含碳物质与含氢物质的分离 b. 可表示为 CO 2 +H 2 === H 2 O(g )+CO c.CO 未参与反应 d.Fe 3 O 4 、 CaO 为催化剂 , 降低了反应的 Δ H - 93 - ③ 其他条件不变 , 在不同催化剂 ( Ⅰ 、 Ⅱ 、 Ⅲ ) 作用下 , 反应 CH 4 (g)+CO 2 (g ) 2CO(g )+2H 2 (g) 进行相同时间后 ,CH 4 的转化率随反应温度的变化如图所示。 a 点所代表的状态 ( 填 “ 是 ” 或 “ 不是 ”) 平衡状态 ;b 点 CH 4 的转化率高于 c 点 , 原因是 。 - 94 - (2) 在一刚性密闭容器中 ,CH 4 和 CO 2 的分压分别为 20 kPa 、 25 kPa, 加入 Ni/ α -Al 2 O 3 催化剂并加热至 1 123 K 使其发生反应 CH 4 (g)+CO 2 (g ) 2CO(g )+2H 2 (g) 。 ① 研究表明 CO 的生成速率 v (CO)=1.3×10 -2 · p (CH 4 )· p (CO 2 ) mol·(L·s) -1 , 某时刻测得 p (CO)=20 kPa, 则 p (CO 2 )= kPa, v (CO)= mol·(L·s) -1 。 ② 达到平衡后测得体系压强是起始时的 1.8 倍 , 则该反应的平衡常数的计算式为 K p = (kPa) 2 。 ( 用各物质的分压代替物质的量浓度计算 ) (3)CH 4 超干重整 CO 2 得到的 CO 经偶联反应可制得草酸 (H 2 C 2 O 4 ) 。常温下 , 向某浓度的草酸溶液中加入一定浓度的 NaOH 溶液 , 所得溶液中 c (H 2 C 2 O 4 )= c ( ), 则此时溶液的 pH= 。 ( 已知常温下 H 2 C 2 O 4 的 K a1 =6×10 -2 , K a2 =6×10 -5 ,lg6=0.8) - 95 - - 96 - Ⅱ 物质变化为 : 左上 (CO 、 H 2 、 CO 2 )+ 右下 ( 惰性气体 )→ 左下 (H 2 O)+ 右上 (CO 、惰性气体 ), 总反应为 H 2 +CO 2 === H 2 O+CO 。 Fe 3 O 4 、 CaO 为总反应的催化剂 , 能降低反应的活化能 , 但不能改变反应的 Δ H 。故 ab 正确 ,cd 错误。 ③ 通常 , 催化剂能加快反应速率 , 缩短反应到达平衡的时间。但催化剂不能使平衡发生移动 , 即不能改变平衡转化率。若图中 a 点为化学平衡 , 则保持温度不变 (800 ℃ ), 将催化剂 Ⅱ 换成 Ⅰ 或 Ⅲ ,CH 4 转化率应不变 , 故 a 点不是化学平衡状态。同理 , 图中 b 、 c 两点都未达到化学平衡。根据题意 ,b 、 c 两点只有温度不同 ,b 点温度较高 , 反应速率快 , 相同时间内 CH 4 转化率高。 - 97 - - 98 - - 99 -查看更多