- 2021-04-21 发布 |
- 37.5 KB |
- 16页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届二轮复习化学常用计量——物质的量学案(全国通用)
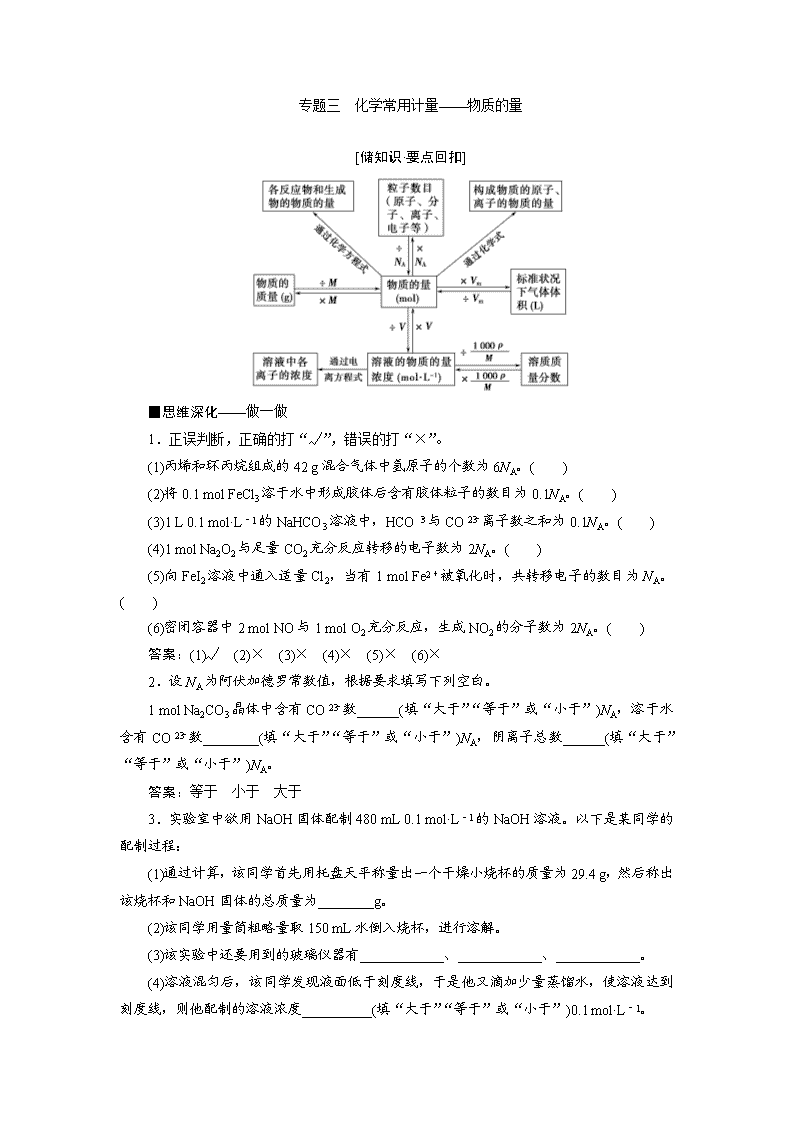
专题三 化学常用计量——物质的量 [储知识·要点回扣] ■思维深化——做一做 1.正误判断,正确的打“√”,错误的打“×”。 (1)丙烯和环丙烷组成的42 g混合气体中氢原子的个数为6NA。( ) (2)将0.1 mol FeCl3溶于水中形成胶体后含有胶体粒子的数目为0.1NA。( ) (3)1 L 0.1 mol·L-1的NaHCO3溶液中,HCO与CO离子数之和为0.1NA。( ) (4)1 mol Na2O2与足量CO2充分反应转移的电子数为2NA。( ) (5)向FeI2溶液中通入适量Cl2,当有1 mol Fe2+被氧化时,共转移电子的数目为NA。( ) (6)密闭容器中2 mol NO与1 mol O2充分反应,生成NO2的分子数为2NA。( ) 答案:(1)√ (2)× (3)× (4)× (5)× (6)× 2.设NA为阿伏加德罗常数值,根据要求填写下列空白。 1 mol Na2CO3晶体中含有CO数______(填“大于”“等于”或“小于”)NA,溶于水含有CO数________(填“大于”“等于”或“小于”)NA,阴离子总数______(填“大于”“等于”或“小于”)NA。 答案:等于 小于 大于 3.实验室中欲用NaOH固体配制480 mL 0.1 mol·L-1的NaOH溶液。以下是某同学的配制过程: (1)通过计算,该同学首先用托盘天平称量出一个干燥小烧杯的质量为29.4 g,然后称出该烧杯和NaOH固体的总质量为________g。 (2)该同学用量筒粗略量取150 mL水倒入烧杯,进行溶解。 (3)该实验中还要用到的玻璃仪器有____________、____________、____________。 (4)溶液混匀后,该同学发现液面低于刻度线,于是他又滴加少量蒸馏水,使溶液达到刻度线,则他配制的溶液浓度__________(填“大于”“等于”或“小于”)0.1 mol·L-1。 答案:(1)31.4 (3)500 mL容量瓶 玻璃棒 胶头滴管 (4)小于 [探高考·真题鉴赏] 1.(2018·全国高考卷Ⅰ)NA是阿伏加德罗常数的值。下列说法正确的是( ) A.16.25 g FeCl3水解形成的Fe(OH)3胶体粒子数为0.1NA B.22.4 L(标准状况)氩气含有的质子数为18NA C.92.0 g甘油(丙三醇)中含有羟基数为1.0NA D.1.0 mol CH4与Cl2在光照下反应生成的CH3Cl分子数为1.0NA 解析:氩气是单原子分子,标准状况下,22.4 L氩气的物质的量为1 mol,含有的质子数为18NA,B正确。Fe(OH)3胶体粒子是若干个Fe(OH)3分子的集合体,所以胶体粒子数小于0.1NA,A错误。92.0 g甘油的物质的量为1 mol,每个甘油分子含有3个羟基,所以1 mol甘油含有的羟基数为3.0NA,C错误。CH4与Cl2发生取代反应生成的有机物除了CH3Cl以外,还有CH2Cl2、CHCl3和CCl4,生成的CH3Cl分子数小于 1.0NA,D错误。 答案:B 2.(2018·全国高考卷Ⅱ)NA代表阿伏加德罗常数的值。下列说法正确的是( ) A.常温常压下,124 g P4中所含P-P键数目为4NA B.100 mL 1 mol·L-1 FeCl3溶液中所含Fe3+的数目为0.1NA C.标准状况下,11.2 L甲烷和乙烯混合物中含氢原子数目为2NA D.密闭容器中,2 mol SO2和1 mol O2催化反应后分子总数为2NA 解析:标准状况下,11.2 L甲烷和乙烯混合物的物质的量为0.5 mol,每个甲烷和乙烯分子都含有4个氢原子,所以含有氢原子数目为2NA,C正确。124 g P4的物质的量为1 mol,每个P4分子中含有6个P-P键,所以含有P-P键数目为6NA,A错误。Fe3+在水溶液中能发生水解,100 mL 1 mol·L-1 FeCl3溶液中所含Fe3+的数目小于0.1NA,B错误。SO2和O2的化合反应为可逆反应,2 mol SO2和1 mol O2催化反应后,混合气体的物质的量大于2 mol,即分子总数大于2NA,D错误。 答案:C 3.(2017·全国高考卷Ⅱ)阿伏加德罗常数的值为NA。下列说法正确的是( ) A.1 L 0.1 mol·L-1 NH4Cl溶液中,NH的数量为0.1NA B.2.4 g Mg与H2SO4完全反应,转移的电子数为0.1NA C.标准状况下,2.24 L N2和O2的混合气体中分子数为0.2NA D.0.1 mol H2和0.1 mol I2于密闭容器中充分反应后,其分子总数为0.2NA 解析:由于NH4Cl溶液中NH水解,所以1 L 0.1 mol·L-1 NH4Cl溶液中,NH的数量少于0.1NA,A错;2.4 g Mg与H2SO4完全反应,转移的电子数为0.2NA,B错;标准状况下,2.24 L N2和O2的混合气体为0.1 mol,则所含分子数为0.1NA,C错;H2(g)+I2(g)??2HI(g)在反应前后气体分子总数不变,D正确。 答案:D 4.(2018·全国高考卷Ⅰ节选)Na2S2O5可用作食品的抗氧化剂。在测定某葡萄酒中Na2S2O5残留量时,取50.00 mL葡萄酒样品,用0.010 00 mol·L-1的碘标准液滴定至终点,消耗10.00 mL。滴定反应的离子方程式为________________________,该样品中Na2S2O5的残留量为__________g·L-1(以SO2计)。 解析:根据电子、电荷及质量守恒,可写出反应的离子方程式为S2O+2I2+3H2O===2SO+4I-+6H+。n(S2O)=×n(I2)=×0.010 00 mol·L-1×10.00×10-3 L=5×10-5 mol,该样品中S2O的残留量(以SO2计)为5×10-5 mol×2×64 g·mol-1×=0.128 g·L-1。 答案:S2O+2I2+3H2O===2SO+4I-+6H+ 0.128 [研考纲·聚焦素养] 最新考纲 1.了解物质的量(n)及其单位摩尔(mol)、摩尔质量(M)、气体摩尔体积(Vm)、物质的量浓度(c)、阿伏加德罗常数(NA)的含义。 2.理解质量守恒定律。 3.能根据微观粒子(原子、分子、离子等)物质的量、数量、气体体积(标准状况下)之间的相互关系进行有关计算。 4.了解溶液的含义。 5.了解溶解度、饱和溶液的概念。 6.了解溶液浓度的表示方法,理解溶液中溶质的质量分数和物质的量浓度的概念,并能进行有关计算。 7.掌握配制一定溶质质量分数溶液和物质的量浓度溶液的方法。 核心素养 1.宏观辨识与微观探析:能从元素和原子、分子水平认识物质的组成和构成微粒。 2.平衡思想:能认识物质是变化的,并遵循质量守恒定律。 3.证据推理:能基于证据对物质组成及其变化明确物质的量浓度的含义,掌握一定物质的量浓度溶液的配制及相关仪器的使用,掌握与阿伏加德罗常数相结合的有关计算和判断。 [题型突破·通法悟道] 摆题型示例 巧取应考宝典 题型一 阿伏加德罗常数的综合应用 [研——题型探究] ►角度一 与气体摩尔体积22.4 L·mol-1相关的NA的应用 1.正误判断,正确的打“√”,错误的打“×”。 (1)标准状况下,11.2 L苯中含有分子的数目为0.5NA。( ) (2)标准状况下,22.4 L的SO2中含有的SO2分子数为NA。( ) (3)常温常压下,35.5 g氯气与足量镁粉充分反应,转移的电子数为2NA。( ) (4)常温常压下,22.4 L NO2和CO2的混合气体含有的氧原子数为2NA。( ) (5)2.24 L CO和CO2混合气体中含有的碳原子数目为0.1NA。( ) (6)2.24 L CO2中含有的原子数为0.3×6.02×1023。( ) 答案:(1)× (2)√ (3)× (4)× (5)× (6)× ►角度二 与物质的组成相关的NA的应用 2.正误判断,正确的打“√”,错误的打“×”。 (1)32 g 18O2中含有2NA个氧原子。( ) (2)17 g —OH与17 g OH-所含电子数均为10NA。( ) (3)相同质量的N2O4与NO2中所含原子数目相同。( ) (4)乙烯和环丙烷(C3H6)组成的28 g混合气体中含有3NA个氢原子。( ) (5)18 g D2O和18 g H2O中含有的质子数均为10NA。( ) (6)30 g甲醛中含共用电子对总数为4NA。( ) (7)4.5 g SiO2晶体中含有的硅氧键的数目为0.3NA。( ) (8)12 g金刚石含有的共价键数为4NA。( ) 答案:(1)× (2)× (3)√ (4)× (5)× (6)√ (7)√ (8)× ►角度三 与氧化还原反应相关的NA的应用 3.正误判断,正确的打“√”,错误的打“×”。 (1)1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,转移的电子数为NA。( ) (2)5.6 g铁粉与硝酸反应失去的电子数一定为0.3NA。( ) (3)1 mol Cl2参加反应转移电子数一定为2NA。( ) (4)0.1 mol Zn与含0.1 mol HCl的盐酸充分反应,转移的电子数目为0.2NA。( ) (5)足量KMnO4与含1 mol HCl的浓HCl溶液反应生成标准状况下7 L Cl2。( ) (6)足量Cl2与含1 mol NaOH的浓溶液反应转移 mol e-。( ) 答案:(1)√ (2)× (3)× (4)× (5)× (6)× ►角度四 与可逆反应相关的NA的应用 4.正误判断,正确的打“√”,错误的打“×”。 (1)2 mol SO2和1 mol O2在一定条件下充分反应后,混合物的分子数为2NA。( ) (2)标准状况下,22.4 L NO2气体中所含分子数目为NA。( ) (3)100 g 17%的氨水溶液中含有的NH3分子数为NA。( ) (4)标准状况下,0.1 mol Cl2溶于水,转移的电子数目为0.1NA。( ) 答案:(1)× (2)× (3)× (4)× ►角度五 电解质溶液中粒子数目的判断 5.正误判断,正确的打“√”,错误的打“×”。 (1)0.1 L 3.0 mol·L-1的NH4NO3溶液中含有的NH的数目为0.3NA。( ) (2)等体积、等物质的量浓度的NaCl和KCl溶液中,阴、阳离子数目之和均为2NA。( ) (3)0.1 mol·L-1的NaHSO4溶液中,阳离子的数目之和为0.2NA。( ) (4)25 ℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2NA。( ) 答案:(1)× (2)× (3)× (4)× [题型建模] 关于NA试题常设的“六大陷阱” (1)气体摩尔体积的运用条件:考查气体时经常给定非标准状况下(如25 ℃、1.01×105 Pa)气体体积,让学生用22.4 L·mol-1进行换算,误入陷阱;考查气体质量时,增加迷惑性信息“常温常压”,让很多学生判断错误。 (2)忽视物质的聚集状态:22.4 L·mol-1适用对象是气体(包括混合气体)。命题者常用在标准状况下非气态的物质来迷惑学生,如H2O、CCl4等。 (3)混淆某些氧化还原反应中电子转移的数目:命题者常用一些反应中转移电子的数目来迷惑学生,如Na2O2与H2O反应、Cl2与NaOH溶液反应、Fe与盐酸反应、1 mol氯气与过量铁反应、电解硫酸铜溶液等。 (4)不理解物质的组成结构:如Na2O2是由Na+和O构成,而不是Na+和O2-;NaCl为离子化合物,只有离子,没有分子;苯中不含碳碳单键和碳碳双键。气体单质的组成除常见的双原子分子外,还有单原子分子(如He、Ne等)、三原子分子(如O3)等。 (5)忽视电离、水解对溶液中离子数目的影响:考查电解质溶液中离子数目或浓度时常设置弱电解质的电离、盐类水解等方面的陷阱。 (6)忽视可逆反应不能进行到底:如2NO2??N2O4、2SO2+O22SO3、合成氨反应等。[练——即学即用] 1.(2018·湖北武汉模拟)通常监测SO2含量是否达到排放标准的反应原理是SO2+H2O2+BaCl2===BaSO4↓+2HCl。NA表示阿伏加德罗常数的值,下列说法正确的是( ) A.0.1 mol BaCl2晶体中所含微粒总数为0.1NA B.25 ℃时,pH=1的HCl溶液中含有H+的数目为0.1NA C.17 g H2O2中含有非极性键数目为0.5NA D.生成2.33 g BaSO4沉淀时,转移电子数目为0.01NA 解析:BaCl2晶体由钡离子和氯离子构成,故0.1 mol BaCl2晶体中所含微粒总数为0.3NA,A项错误;没有给定溶液体积,无法计算H+的数目,B项错误;H2O2的结构式为 ,17 g H2O2为0.5 mol,含有非极性键的数目为0.5NA,C项正确;根据反应SO2+H2O2+BaCl2===BaSO4↓+2HCl,生成2.33 g(0.01 mol)BaSO4沉淀时,转移电子数目为0.02NA,D项错误。 答案:C 2.NA为阿伏加德罗常数的值,下列说法正确的是( ) A.常温下pH=2的CH3COOH溶液中,H+的数目为0.01NA B.常温常压下,18 g D2O含有的质子数为10NA C.标准状况下,11.2 L乙烯和环丙烷(C3H6)的混合气体中,共用电子对数目为3NA D.0.1 mol Cu溶于足量稀硝酸中,转移的电子数为0.2NA 解析:没有说明溶液的体积,所以无法计算H+的数目,选项A错误。D2O的分子量为20,所以18 g D2O的物质的量为0.9 mol,一个D2O分子含有10个质子,所以18 g D2O含有9 mol质子,选项B错误。一个乙烯分子有6个共用电子对(4个碳氢共用电子对和2个碳碳共用电子对),一个环丙烷分子有9个共用电子对(6个碳氢共用电子对和3个碳碳共用电子对),不知道两个有机物各自的含量,所以无法计算共用电子对数,选项C错误。Cu溶于硝酸一定转化为Cu2+,所以0.1 mol Cu溶于足量稀硝酸中,转移的电子数为0.2NA,选项D正确。 答案:D 题型二 以物质的量为中心的计算 [研——题型探究] ►角度一 关系式法 1.将500 mL(标准状况)含有CO的某气体样品通过盛有足量I2O5的干燥管,170 ℃下充分反应,用水-乙醇混合液充分溶解产物I2,定容到100 mL。取25.00 mL用0. 010 0 mol·L-1 Na2S2O3标准溶液滴定,消耗标准溶液20.00 mL,则样品中CO的体积分数为________。(保留三位有效数字)(已知:气体样品中其他成分与I2O5不反应;2Na2S2O3+I2===2NaI+Na2S4O6) 解析:由信息可知5CO+I2O55CO2+I2,所以5CO~I2~2Na2S2O3即5CO~2Na2S2O3,n(CO)=n(Na2S2O3)=×4×(0.010 0 mol·L-1×0.02 L)=2×10-3mol,V(CO)=2×10-3mol×22.4 L·mol-1×1 000 mL·L-1=44.8 mL。故样品中CO的体积分数=×100%=8.96%。 答案:8.96% [题型建模] 多步反应计算的特征是多个反应连续发生,起始物与目标物之间存在确定的量的关系。解题时应先写出有关反应的化学方程式或关系式,依据化学方程式找出连续反应的过程中不同反应步骤之间反应物、生成物的物质的量的关系,最后确定已知物和目标产物之间的物质的量的关系,列出计算式求解,从而简化运算过程。 ►角度二 守恒法 2.碱式氯化铜有多种组成,其化学式可表示为Cua(OH)bClc·xH2O。为测定某碱式氯化铜的组成,进行下列实验:①称取样品1.116 0 g,用少量稀HNO3溶解后配成100.00 mL溶液A;②取25.00 mL溶液A,加入足量AgNO3溶液,得AgCl 0.172 2 g;③另取25.00 mL溶液A,调节pH 4~5,用浓度为0.080 00 mol·L-1的EDTA(Na2H2Y·2H2O)标准溶液滴定Cu2+(离子方程式为Cu2++H2Y2-===CuY2-+2H+),滴定至终点,消耗标准溶液30.00 mL。通过计算确定该样品的化学式(写出计算过程)。 解析:由②中生成AgCl的质量,可计算出1.116 0 g样品中Cl-的物质的量n(Cl-);由③可计算出1.116 0 g样品中Cu2+的物质的量n(Cu2+),根据电荷守恒:n(OH-)+n(Cl-)=2n(Cu2+),得出n(OH-),最后由质量守恒得出n(H2O);由四种粒子的物质的量,可确定样品的化学式。 答案:n(Cl-)=n(AgCl)×=×=4.800×10-3mol, n(Cu2+)=n(EDTA)×=0.080 00 mol·L-1×30.00 mL×10-3 L·mL-1×=9.600×10-3 mol。 由电荷守恒n(OH-)+n(Cl-)=2n(Cu2+)可得n(OH-)=2n(Cu2+)-n(Cl-)=2×9.600×10-3mol-4.800×10-3mol=1.440×10-2mol。 m(Cl-)=4.800×10-3mol×35.5 g·mol-1 =0.170 4 g, m(Cu2+)=9.600×10-3mol×64 g·mol-1 =0.614 4 g, m(OH-)=1.440×10-2mol×17 g·mol-1 =0.244 8 g。 再由质量守恒可得 n(H2O)= =4.800×10-3mol。 a∶b∶c∶x=n(Cu2+)∶n(OH-)∶n(Cl-)∶n(H2O)=2∶3∶1∶1。 化学式为Cu2(OH)3Cl·H2O。 [题型建模] 所谓“守恒”就是物质在发生“变化”或两物质在发生“相互作用”的过程中某些物理量的总量保持“不变”。一切化学反应都遵循守恒定律,在化学变化中有各种各样的守恒,如质量守恒、元素原子守恒、得失电子守恒、电荷守恒等。►角度三 热重分析法确定物质组成及含量 3.PbO2在加热过程中发生分解的失重曲线如图所示,已知失重曲线上的a点为样品失重4.0%(即 ×100%)的残留固体。若a点固体组成表示为PbOx或mPbO2·nPbO,列式计算x值和m∶n值_________________________________________。 答案:根据PbO2PbOx+O2↑,有×32=239×4.0%,x=2-≈1.4; 根据mPbO2·nPbO,=1.4,==, 即m∶n=2∶3。 4.0.80 g CuSO4·5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示。 试确定200 ℃时固体物质的化学式(要求写出推断过程)。_________________。 答案: CuSO4·5H2OnH2O+CuSO4·(5-n)H2O 250 18n 0.80 g 0.80 g-0.57 g=0.23 g =,解得n≈4,则此时固体物质的化学式为CuSO4·H2O。 即200 ℃时固体物质的化学式为CuSO4·H2O。 [题型建模] 热重分析的方法 (1)设晶体为1 mol。 (2)失重一般是先失水、再失非金属氧化物。 (3)计算每步的m余,=固体残留率。 (4)晶体中金属质量不减少,仍在m余中。 (5)失重最后一般为金属氧化物,由质量守恒得mO,由n金属∶nO,即可求出失重后物质的化学式。 [练——即学即用] 1.碱式次氯酸镁[Mga(ClO)b(OH)c·xH2O]是一种有开发价值的微溶于水的无机抗菌剂。为确定碱式次氯酸镁的组成,进行如下实验: ①准确称取1.685 g碱式次氯酸镁试样于250 mL锥形瓶中,加入过量的KI溶液,用足量乙酸酸化,用0.800 0 mol·L-1 Na2S2O3标准溶液滴定至终点(离子方程式为2S2O+I2===2I-+S4O),消耗25.00 mL。 ②另取1. 685 g碱式次氯酸镁试样,用足量乙酸酸化,再用足量3% H2O2溶液处理至不再产生气泡(H2O2被ClO-氧化为O2),稀释至1 000 mL。移取25.00 mL溶液至锥形瓶中,在一定条件下用0.020 00 mol·L-1 EDTA(Na2H2Y)标准溶液滴定其中的Mg2+(离子方程式为Mg2++H2Y2-===MgY2-+2H+),消耗25.00 mL。 (1)步骤①需要用到的指示剂是____________。 (2)通过计算确定碱式次氯酸镁的化学式(写出计算过程)。 答案:(1)淀粉溶液 (2)关系式:ClO-~I2~2S2O n(ClO-)=n(S2O)=×0.800 0 mol·L-1×25.00×10-3L=0.01 mol, n(Mg2+)=0.020 00 mol·L-1×25.00×10-3L×=0.02 mol, 根据电荷守恒,可得: n(OH-)=2n(Mg2+)-n(ClO-)=2×0.02 mol-0.01 mol=0.03 mol, m(H2O)=1.685 g-0.01 mol×51.5 g·mol-1-0.02 mol×24 g·mol-1-0.03 mol×17 g·mol-1=0.180 g, n(H2O)==0.01 mol, n(Mg2+)∶n(ClO-)∶n(OH-)∶n(H2O)=0.02 mol∶0.01 mol∶0.03 mol∶0.01 mol=2∶1∶3∶1, 碱式次氯酸镁的化学式为Mg2ClO(OH)3·H2O。 2.为研究一水草酸钙(CaC2O4·H2O)的热分解性质,进行如下实验:准确称取36.50 g样品加热,样品的固体残留率(×100%)随温度的变化如图所示。 (1)300 ℃时残留固体的成分为________,900 ℃时残留固体的成分为________。 (2)通过计算求出500 ℃时固体的成分及质量(写出计算过程)。 ________________________________________________________________________。 答案:(1)CaC2O4 CaO (2)500 ℃时残留固体的成分为CaC2O4和CaCO3的混合物,样品中CaC2O4·H2O的物质的量n(CaC2O4·H2O)==0.25 mol,设混合物中CaC2O4和CaCO3的物质的量分别为x mol和y mol,根据500 ℃时固体总质量可得128x+100y=36.50 g×76.16%,根据钙元素守恒可得x+y=0.25,解得x=0.10,y=0.15,m(CaC2O4)=0.10 mol×128 g·mol-1=12.80 g,m(CaCO3)=0.15 mol×100 g·mol-1=15.0 g,500 ℃时固体的成分为12.8 g CaC2O4和15.0 g CaCO3。 [限时规范训练] 单独成册 1.下列条件下,两物质所含分子数不相等的是( ) A.同温度、相同质量的N2和CO B.常温常压,同体积的H2O和O2 C.同压强、同物质的量的N2和O2 D.同温度、同压强、同体积的N2O和CO2 解析:N2和CO摩尔质量都是28 g·mol-1,质量相同,则二者物质的量相同,即分子数相同,故A不符合题目要求;同温同压下,同体积的气体所含分子数相同,但常温常压下,水是液体,二者分子数不相等,故B符合题目要求;物质的量相同,分子数相等,故C不符合题目要求;同温同压下,同体积的气体所含分子数相同,故D不符合题目要求。 答案:B 2.(2018·甘肃兰州模拟)设NA为阿伏加德罗常数的值,下列有关叙述错误的是( ) A.由H2O2分解制得标准状况下2.24 L O2,转移电子数为0.2NA B.氢气与氯气反应生成36.5 g氯化氢气体,断裂的共价键总数为NA C.44 g丙烷中含有的极性键为8NA D.1 L 0.1 mol·L-1的NaHSO3溶液中HSO和SO离子数之和为0.1NA 解析:根据2H2O2===2H2O+O2↑、生成标准状况下2.24 L(0.1 mol)O2、氧元素化合价变化,可知反应转移0.2 mol电子,A项正确;1 mol H2和1 mol Cl2反应生成2 mol HCl时断裂2 mol共价键,则生成36.5 g(1 mol)HCl时断裂1 mol共价键,B项正确;每个丙烷分子中含8个C—H键,44 g丙烷为1 mol,1 mol丙烷中含8 mol极性键,C项正确;1 L 0.1 mol·L-1的NaHSO3溶液中含HSO、H2SO3、SO的物质的量之和为0.1 mol,D项错误。 答案:D 3.(2018·深圳二调)设NA为阿伏加德罗常数的值。下列说法正确的是( ) A.0.1 mol SiO2晶体中含有Si—O键的数目为0.2NA B.56 g铁粉与高温水蒸气反应,生成H2数目为1.5NA C.标准状况下,22.4 L Cl2溶于水,转移电子数为NA D.18 g HO和D2O的混合物中,所含中子数为9NA 解析:A.根据SiO2的结构,1 mol SiO2中含有4 mol Si—O键,即0.1 mol SiO2晶体中含有0.4 mol Si—O键,故A错误;B.铁与水蒸气反应生成Fe3O4和H2,因此56 g铁与水蒸气反应,转移电子物质的量为× mol=8/3mol,故B错误;C.氯气溶于水,只有少量的氯气与水反应,无法计算出转移电子的物质的量,故C错误;D.假设18 g全部是HO,含有中子的物质的量为18×(0+10)/20 mol=9 mol,假设18 g全部是D2O,D为2H,含有中子的物质的量为18×(2+8)/20 mol=9 mol,因此18 g此混合物中含有中子的物质的量为9 mol,故D正确。 答案:D 4.(2018·广东汕头模拟)NA代表阿伏加德罗常数的值。下列叙述正确的是( ) A.6.4 g由S2、S4、S8组成的混合物含硫原子数为0.2NA B.将1 mol Cl2通入水中,HClO、Cl-、ClO-粒子数之和为2NA C.标准状况下,44.8 L NO与22.4 L O2反应后的分子数是2NA D.27 g铝中加入1 mol·L-1的NaOH溶液,转移电子数是3NA 解析:6.4 g由S2、S4、S8组成的混合物含硫原子数为×NA=0.2NA,A正确;将1 mol Cl2通入水中,部分氯气与水反应,HClO、Cl-、ClO-粒子数之和小于2NA,B错误;标准状况下,44.8 L NO与22.4 L O2若完全反应生成44.8 L NO2,但NO2与N2O4之间存在平衡2NO2??N2O4,所以反应后的分子数小于2NA,C错误;27 g铝的物质的量是1 mol,加入1 mol·L-1的NaOH溶液,氢氧化钠的物质的量不能确定,不能计算转移电子数目,D错误。 答案:A 5.(2018·山西太原三模)设NA为阿伏加德罗常数的值,下列有关叙述正确的是( ) A.28 g乙烯和丙烯中的极性键数目为4NA B.32 g Cu和32 g S充分反应,转移电子数为NA C.1 L 0.3 mol·L-1 Na2CO3溶液中的阴离子数目小于0.3NA D.0.2 mol NH3与0.3 mol O2在催化剂的作用下充分反应,所得NO的分子数为0.2NA 解析:A.乙烯和丙烯的最简式为CH2,28 g CH2的物质的量为2 mol,而2 mol CH2中含4 mol极性键,所以28 g乙烯和丙烯中的极性键数目为4NA,A正确;B.Cu和S反应生成CuS,Cu不足,转移电子数为0.5NA,B错误;C.CO水解生成HCO和OH-,导致阴离子数目增多,因此1 L 0.3 mol·L-1 Na2CO3溶液中的阴离子数目大于0.3NA,C错误;D.依据4NH3+5O24NO+6H2O,0.2 mol NH3与0.3 mol O2在催化剂的作用下加热充分反应,氧气剩余,则生成的一氧化氮部分与氧气反应生成二氧化氮,所以最终生成一氧化氮分子数小于0.2NA,D错误。 答案:A 6.现有一瓶1 000 mL、含25%NaClO、密度是1.19 g·cm-3的“84消毒液”,使用时需要稀释100倍(体积比),密封保存。下列分析不正确的是( ) A.该“84消毒液”中NaClO物质的量浓度为4.0 mol·L-1 B.该“84消毒液”稀释100倍后,Na+的物质的量浓度为0.04 mol·L-1 C.空气中的CO2与“84消毒液”发生反应的化学方程式是NaClO+CO2+H2O===NaHCO3+HClO D.用容量瓶配制上述浓度的“84消毒液”480 mL,需要称量的NaClO固体质量为143.0 g 解析:c(NaClO)= ==4.0 mol·L-1,A正确;稀释前后NaClO的物质的量不变,体积变为原来的100倍,则浓度变为原来的,即稀释后浓度为0.04 mol·L-1,故B正确;酸性:H2CO3>HClO>HCO,由强酸制弱酸原理可知,CO2与“84消毒液”发生反应的化学方程式是NaClO+CO2+H2O===NaHCO3+HClO,故C正确;配制480 mL溶液需要500 mL的容量瓶,由n=cV=4.0 mol·L-1×0.5 L=2.0 mol,则m=nM=2.0 mol×74.5 g·mol-1=149.0 g,故D错误。 答案:D 7.在标准状况下,将V L A气体(摩尔质量为M g/mol)溶于0.1 L水中,所得溶液密度为ρ g/cm3,则此溶液中溶质的物质的量浓度(mol/L)为( ) A. B. C. D. 解析:标准状况下,V L A气体的质量为×M g/mol= g,0.1 L水的质量为100 mL×1 g/mL=100 g。 所以溶液中溶质的质量分数w==, 所得溶液密度为ρ g/cm3,所以溶液中溶质的物质的量浓度c= mol/L= mol/L。 答案:B 8.(1)实验探究小组在实验中需要用到456 mL 1 mol·L-1的HNO3溶液,但是在实验室中只发现一瓶8 mol·L-1的HNO3溶液,该小组用8 mol·L-1的HNO3溶液配制所需溶液。 ①实验中所需的玻璃仪器包括________、________mL量筒、烧杯、________、胶头滴管等。 ②该实验中需要量取8 mol·L-1的HNO3溶液________mL。 ③下列实验操作中导致配制的溶液浓度偏高的是________。 A.取8 mol·L-1的HNO3溶液时仰视刻度线 B.量取用的量筒水洗后未进行任何操作 C.8 mol·L-1的HNO3溶液从量筒转移至烧杯后用水洗涤量筒并全部转移至烧杯 D.定容时仰视刻度线 E.定容后,将容量瓶振荡摇匀后,发现液面低于刻度线,未进行任何操作 (2)某同学转移溶液的操作如图所示,该同学操作中的错误是________________________________________________________________________ ________________________________________________________________________。 容量瓶的刻度线标在比较细的瓶颈之上的原因是________________________________________________________________________ ________________________________________________________________________。 A.为了美观 B.为了统一标准 C.为了提高准确度 D.方便刻画 解析:(1)①实验室没有456 mL的容量瓶,则本实验需要配制的溶液体积为500 mL,另外需要用量筒量取8 mol·L-1的HNO3溶液倒在烧杯中加水稀释,同时需要玻璃棒搅拌,转移到容量瓶中时也需要玻璃棒引流,最后还需要用胶头滴管定容,整个实验需要的玻璃仪器包括500 mL容量瓶、100 mL量筒、烧杯、玻璃棒、胶头滴管等。②设需要量取8 mol·L-1的HNO3溶液V mL,则8 mol·L-1×V×10-3L=1 mol·L-1×500×10-3L,解得V=62.5。③取8 mol·L-1的HNO3溶液时仰视刻度线,液面在刻度线上方,即浓硝酸的体积偏大,导致配制的溶液浓度偏高,故A正确;量取用的量筒水洗后未进行任何操作,会稀释浓硝酸,即浓硝酸的体积偏小,导致配制溶液浓度偏低,故B错误;量筒量取浓硝酸后,不应该水洗,否则浓硝酸的体积偏大,导致配制溶液浓度偏高,故C正确;定容时仰视刻度线,液面在刻度线上方,溶液体积偏大,导致浓度偏低,故D错误;定容后,将容量瓶振荡摇匀后,不用再加水定容,这样做对实验结果无影响,故E错误。 (2)转移溶液的错误操作是未用玻璃棒引流。容量瓶的刻度线标在比较细的瓶颈之上,这样做的目的是提高准确度,与美观、方便刻画等没有关系。 答案:(1)①500 mL容量瓶 100 玻璃棒 ②62.5 ③AC (2)未用玻璃棒引流 C 9.如图所示的实验装置可用来测定含两种元素的某种气体X的化学式。 在注射器A中装有240 mL气体X,慢慢通过不含空气并装有红热的氧化铜的玻璃管B,使之完全反应,得到下面的实验结果: 实验前B管重20.32 g,实验后B管重20.00 g,B管中的黑色粉末变成红色粉末。在C管中收集到的无色液体是水;在注射器D中收集到的气体是氮气。 试回答下列问题: (1)气体X是由________和________元素组成的。 (2)若240 mL气体X完全反应后,收集到的氮气质量是0.28 g;根据实验时的温度和压强计算出1 mol气体X的体积是24 000 mL,则X的摩尔质量是_______________g·mol-1。 (3)通过计算,确定X的化学式为____________。 (4)写出B中发生反应的化学方程式:__________________________________________ ________(X在该条件下不发生分解反应)。 解析:在C管中收集到水,其中的氧来源于CuO,则X中一定含有氢元素;在D中收集到N2,说明X中一定含有N元素,即X中含N、H两种元素。反应生成的水中O 的质量为20.32 g-20.00 g=0.32 g,n(O)==0.02 mol,故n(H)=0.02 mol×2=0.04 mol;n(N2)==0.01 mol;本实验条件下Vm=24 L·mol-1,所以n(X)==0.01 mol,因此n(X)∶n(N)∶n(H)=0.01 mol∶(0.01 mol×2)∶0.04 mol=1∶2∶4,所以X的化学式为N2H4,摩尔质量为32 g·mol-1。 答案:(1)N H (2)32 (3)N2H4 (4)N2H4+2CuON2+2H2O+2Cu 10.将MnO2与FeSO4溶液、硫酸充分反应后过滤,将滤液加热至60 ℃后,再加入Na2CO3溶液,最终可制得碱式碳酸锰[aMnCO3·bMn(OH)2·cH2O]。 (1)用废铁屑与硫酸反应制备FeSO4溶液时,所用铁屑需比理论值略高,原因是________________________________________________________________________, 反应前需将废铁屑用热Na2CO3溶液浸泡,其目的是_____________________。 (2)为测定碱式碳酸锰的组成,取7.390 g样品溶于硫酸,生成CO2 224.0 mL(标准状况),并配成500 mL溶液。准确量取10.00 mL该溶液,用0.050 0 mol·L-1EDTA(化学式Na2H2Y)标准溶液滴定其中的Mn2+(原理为Mn2++H2Y2-===MnY2-+2H+),至终点时消耗EDTA标准溶液28.00 mL。通过计算确定该样品的化学式。 答案:(1)防止FeSO4被氧气氧化 除去铁屑表面的油污 (2)n(CO2)=n(MnCO3)=0.01 mol, n(EDTA)=0.001 4 mol, 10 mL溶液中n(Mn2+)=0.001 4 mol, 7.390 g该碱式碳酸锰中n(Mn2+)=0.001 4 mol×=0.07 mol, n[Mn(OH)2]=0.06 mol, m(H2O)=0.9 g,n(H2O)=0.05 mol, a∶b∶c=1∶6∶5, 碱式碳酸锰的化学式为: MnCO3·6Mn(OH)2·5H2O。 11.钴及其化合物广泛应用于磁性材料、电池材料及超硬材料等领域。草酸钴是制备钴的氧化物的重要原料。如图为二水合草酸钴(CoC2O4·2H2O)在空气中受热的质量变化曲线,曲线中300 ℃及以上所得固体均为钴氧化物。 (1)通过计算确定C点剩余固体的化学成分为______(填化学式)。试写出B点对应的物质与O2在225~300 ℃发生反应的化学方程式:______________________________________。 (2)取一定质量的二水合草酸钴分解后的钴氧化物(其中Co的化合价为+2、+3),用480 mL 5 mol·L-1盐酸恰好完全溶解固体,得到CoCl2溶液和4.48 L(标准状况)黄绿色气体。试确定该钴氧化物中Co、O的物质的量之比。 答案:(1)由图可知,CoC2O4·2H2O的起始质量为18.3 g,其物质的量为0.1 mol,Co元素质量为5.9 g,C点钴氧化物质量为8.03 g,氧化物中氧元素质量为8.03 g-5.9 g=2.13 g,则氧化物中Co原子与O原子物质的量之比为0.1 mol∶≈3∶4,故C点为Co3O4;B点对应物质的质量为14.7 g,与其起始物质的质量相比减少18.3 g-14.7 g=3.6 g,为结晶水的质量,故B点物质为CoC2O4,与氧气反应生成Co3O4与二氧化碳,反应的化学方程式为3CoC2O4+2O2Co3O4+6CO2。 (2)由电子守恒:n(Co3+)=2n(Cl2)=2×=0.4 mol,由电荷守恒:n(Co原子)总=n(Co2+)溶液=n(Cl-)=×(0.48 L×5 mol·L-1-2×)=1 mol,所以固体中的n(Co2+)=1 mol-0.4 mol=0.6 mol,根据化合价代数和为0,氧化物中n(O)=(0.6 mol×2+0.4 mol×3)÷2=1.2 mol,故该钴氧化物中n(Co)∶n(O)=1 mol∶1.2 mol=5∶6。 即:(1)Co3O4 3CoC2O4+2O2Co3O4+6CO2 (2)该钴氧化物中Co、O的物质的量之比为5∶6。查看更多