- 2021-04-21 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
安徽省安庆市桐城市某中学2019-2020学年高三第三次模拟考试化学试卷
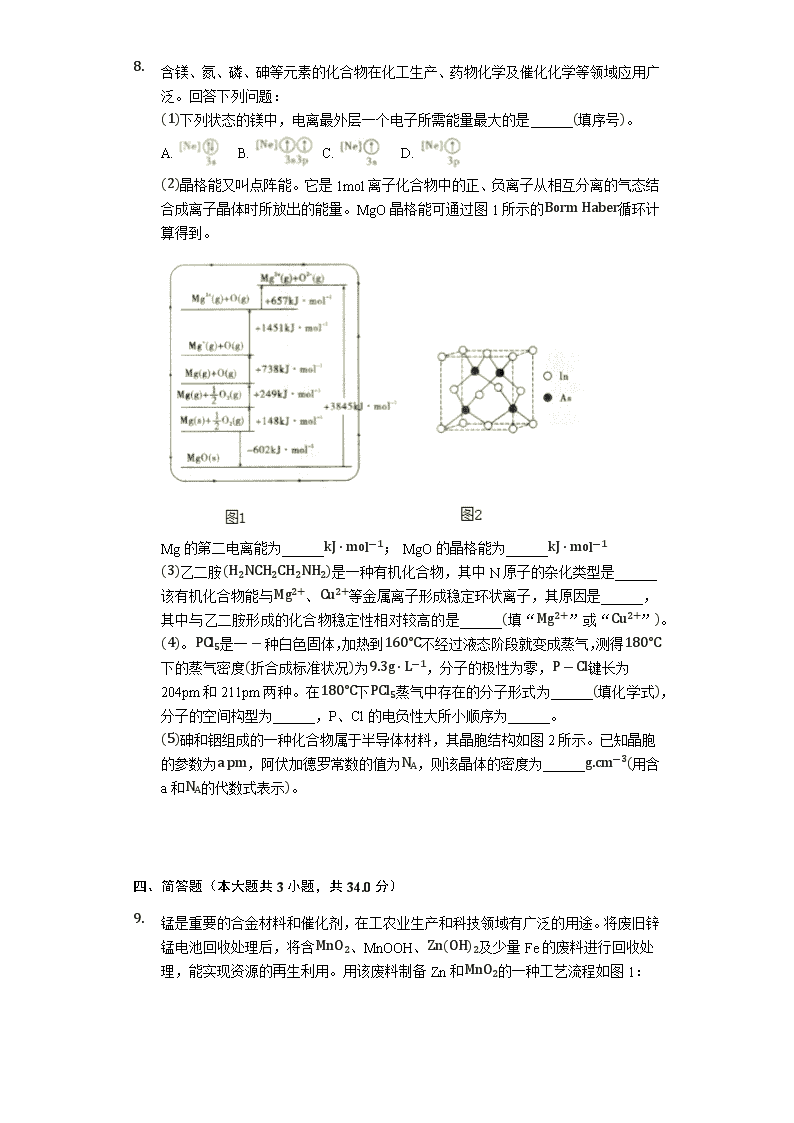
化学模拟试卷 一、单选题(本大题共6小题,共36.0分) 1. 在电影《我和我的祖国》之《前夜》中有这一场景,升旗杆上阻断球锈断,林治远工程师向原材料中加入铬和镍形成不锈钢,赶制出新的阻断球。不锈钢是常见的合金。关于合金,下列说法不正确的是( ) A. 多数合金熔点低于其组分中任意一种组成金属的熔点 B. 人类使用最早的合金是青铜 C. 钠钾合金是原子反应堆的导热剂 D. 目前世界上使用量最大的合金是铝合金 2. 已知NA为阿伏加德罗常数的值,下列说法正确的是( ) A. 向FeI2溶液中通入适量Cl2,当有1mol Fe2+被氧化时,共转移的电子数为NA B. 3克由CO2和SO2组成的混合气体中含有的质子数为1.5NA C. 2.8g聚乙烯中含有的磁碳双键数目为0.1NA D. IL0.lmol/LAlCl3溶液中所含Al3+的数目为0.1NA 3. 有机化合物X的结构简式如图。下列有关该化合物说法正确的是( ) A. X的分子式为C16H11O4 B. X分子中有3种不同的官能团 C. lmol X能与8mol氢气发生加成反应 D. 既能发生酯化反应,又能发生水解反应 4. 从下列实验操作、现象得出的相应结论不正确的是( ) 选项 实验操作、现象 结论 A 向FeCl3和BaCl2混合溶液中通入足量SO2,溶液变为浅绿色且有白色沉淀生成 Fe3+被还原为Fe2+,白色沉淀为BaSO4 B 氯水中存在多种分子和离子,向新制氯水中加入有色布条,片刻后有色布条褪色 说明氯水中有HClO存在 C 将淀粉与KCl混合液装于半透膜内,浸泡在盛蒸馏水的烧杯中,5min后取烧杯中液体,加碘水变为蓝色 证明半透膜有破损 D 将气体通入盛饱和的硫酸钠溶液的洗气瓶 可用于除去CO2中的HCl A. A B. B C. C D. D 1. X、Y、Z、U、W为原子序数依次增大的短周期主族元素,已知X、Y为同周期的相邻元素且形成的某种二元化合物能形成光化学烟雾,Z为金属元素且Z原子的L层电子数比其他各层上电子数之和大5,U的最高价与最低价的代数和为0,W的最高价氧化物对应水化物和其氢化物均为强酸。下列说法正确的是( ) A. X、Y、Z、U、W原子半径大小:W>U>Z>Y>X B. X、W不可能形成共价化合物 C. UY2可用于制光导纤维 D. Z单质在Y单质中燃烧生成白色固体 2. 电化学降解法可用于治理水中硝酸盐的污染,电化学降解NO3-的原理如图所示,下列说法正确的是( ) A. 电源正极为B B. H+由右侧通过交换膜移动到左侧 C. 该电解池的阴极反应式为2NO3-+12H++10e-=N2↑+6H2O D. 标况下,若有2.24LN2生成,理论上铅蓄电池中有20.7克Pb消耗 二、双选题(本大题共1小题,共6.0分) 3. 电解质溶液的电导率越大,导电能力越强。用0.100mol⋅L-1的NaOH溶液分别滴定10 00mL浓度均为0.100mol⋅L-1的盐酸和CH3COOH溶液。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确的是( ) A. 曲线②代表滴定CH3COOH溶液的曲线 B. 在相同温度下,C、D两点溶液中水的电商程度:C>D C. 取A点溶液1mL加水稀释,溶液中的所有离子浓度都减小 D. B点溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) 三、计算题(本大题共1小题,共15.0分) 1. 含镁、氮、磷、砷等元素的化合物在化工生产、药物化学及催化化学等领域应用广泛。回答下列问题: (1)下列状态的镁中,电离最外层一个电子所需能量最大的是______(填序号)。 A. B. C. D. (2)晶格能又叫点阵能。它是1mol离子化合物中的正、负离子从相互分离的气态结合成离子晶体时所放出的能量。MgO晶格能可通过图1所示的Borm Haber循环计算得到。 Mg的第二电离能为______kJ⋅mol-1; MgO的晶格能为______kJ⋅mol-1 (3)乙二胺(H2NCH2CH2NH2)是一种有机化合物,其中N原子的杂化类型是______该有机化合物能与Mg2+、Cu2+等金属离子形成稳定环状离子,其原因是______, 其中与乙二胺形成的化合物稳定性相对较高的是______(填“Mg2+”或“Cu2+”)。 (4)。PCl5是一-种白色固体,加热到160°C不经过液态阶段就变成蒸气,测得180°C下的蒸气密度(折合成标准状况)为9.3g⋅L-1,分子的极性为零,P-Cl键长为204pm和211pm两种。在180°C下PCl5蒸气中存在的分子形式为______(填化学式),分子的空间构型为______,P、Cl的电负性大所小顺序为______。 (5)砷和铟组成的一种化合物属于半导体材料,其晶胞结构如图2所示。已知晶胞的参数为a pm,阿伏加德罗常数的值为NA,则该晶体的密度为______g.cm-3(用含a和NA的代数式表示)。 四、简答题(本大题共3小题,共34.0分) 2. 锰是重要的合金材料和催化剂,在工农业生产和科技领域有广泛的用途。将废旧锌锰电池回收处理后,将含MnO2、MnOOH、Zn(OH)2及少量Fe的废料进行回收处理,能实现资源的再生利用。用该废料制备Zn和MnO2的一种工艺流程如图1: 已知:Mn2+ 在酸性条件下比较稳定,pH高于5.5时易被O2氧化。 回答下列问题: (1)还原培烧过程中,MnOOH与炭黑反应,锰元素被还原为MnO,该反应的化学方程式为______。 (2)滤渣1主要成分的化学式是______。 (3)净化阶段 ①为了除掉滤渣2中的元素,选择最佳的加入试剂为______(填序号)。 A.氯水 B.O2 C.氨水 D.MnCO3 ②已知:室温下,Ksp[Mn(OH)2]=10-13,Ksp[Fe(OH)3]=1×10-38,Ksp[Zn(OH)2]=10-17.净化时溶液中Mn2+、Zn2+的浓度约为0.1mol⋅L-1,调节pH的合理范围是______。 (4)将MnO2和Li2CO3按4:1的物质的量比配料,混合搅拌,然后升温至600C~750°C,制取产品LiMn2O4.写出该反应的化学方程式:______。 (5)LiMn2O4材料常制作成可充电电池(如图2),该电池的总反应为 ①充电时,锰酸锂为电池的______(填“正极”“负极”“阴极”或“阳极”);该电极上发生的电极反应式为______。 ②该电池作为电源放电时,若电路中转移0.2mol e-,则石墨电极将减重______。 1. 在合成氨工业和硝酸制备工业中,常产生N2O、NO和NO2等氮氧化物造成一些环境问题,科研工作者正在研究用各种化学方法来消除这些物质对环境的影响。 (1)在2L密闭容器中通入3mol H2和1mol N2,测得不同温度下,NH3的产率随时间的变化如图所示。 ①下列有关说法正确的是______(填序号)。 A.a处的v正>0 B.c点的v逆=0 C.由b点到c点混合气体相对分子质量逐渐增大 D. 平衡时,通入氩气平衡正向移动 ②T2温度时,0~5min内v(N2)=______mol⋅L-1⋅min-l ③已知:瞬时速率表达式v正=k正c3(H2)c(N2),v逆=k逆c2(NH3) (k为速率常数,只与温度有关)。温度由T1调到T2,活化分子百分率______。(填“增大”“减小”或“不变”), k正增大倍数______k逆增大倍数(填“大于”“小于”或“等于”)。T1℃时,k正k逆=______。 (2)工业生产尾气中产生的N2O需进行分解处理,用碘蒸气可大大提高N2O的分解速率,反应历程如下: 第一步:I2(g)=2I(g) (快反应) 第二步:I(g)+N2O(g)→N2(g)+IO(g) (慢反应) 第三步:IO(g)+N2O(g)→N2(g)+O2(g)+I(g) (快反应) 在反应过程中,I2的浓度与N2O分解速率______ (填“有关”或“无关”);第______ 步反应对总反应速率起决定性作用:第二步的活化能比第三步______(填“大”“小”或“相等”)。 (3)已除去N2O的硝酸尾气NO和NO2可用NaOH溶液吸收,写出NO和NO2与NaOH反应生成一种盐的反应方程式:______已知,常温下HNO2的电离常数Ka=5×10-4,则0.5mol/L对应钠盐的pH值为______。 1. 限可由1.3-丁二烯可制备醇酸树脂的原料M以及杀菌剂N,其合成路线如图: 已知: i.DieIs-Alder: 、R' 代表烃基或氢) iii.A是一个六元环状化合物,1molC能与2mol反应生成N。 (1)N中含有的官能团名称为______。 (2)CH2=CH-CH=CH2能发生加聚反应生成顺式聚合物,请写出该顺式聚合物的结构简式:______。 (3)反应I的化学方程式是______;该反应的反应类型为______。 (4)lmol B完全转化成M所消耗的H2的质量是______g。 (5)反应II的化学方程式是______。 (6)A的某些同分异构体在相同的反应条件下也能生成B和C,写出其中一种同分异构体的结构简式:______。 (7)已知:乙快与1,3-丁二烯也能发生Diels-AIder反应。请以1,3-丁二烯和乙炔为原料,选用必要的无机试剂合成丙二酸,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件。 ______。 五、实验题(本大题共1小题,共14.0分) 1. 某化学实验小组同学利用如图1所示装置制备氨气,并探究氨气的性质(部分仪器已略去)。请回答: Ⅰ.实验室制备氨 (1)实验室制备氨气的化学方程式为______;干燥氨气常用的干燥剂是______。 (2)若观察到装置B中的烧瓶内产生了红色喷泉,则说明氨气具有的性质是______。 Ⅱ.探究NH3的还原性。用氨气和如图2所示仪器设计实验。 (3)①NH3与Na2O2反应不会生成NO、NO2的现象是______。 ②检验产物是否有H2O 等,按气流从左至右,仪器连接顺序为______。 (4)G装置的作用是______。 (5)实验完毕后,D装置中收集到一定量气体;将E中得到的固体加入少量酚酞试液中,观察到溶液变红; F装置中无水CuSO4不变蓝,据此写出E中反应的化学方程式:______。 化学模拟试卷 一、单选题(本大题共6小题,共36.0分) DBDDC C 二、双选题(本大题共1小题,共6.0分) BD 三、计算题(本大题共1小题,共15.0分) 8【答案】C 1451 3845 sp3 乙二胺的两个N提供孤对电子给金属离子形成配位键 Cu2+ PCl5 三角双锥型 P查看更多
相关文章
- 当前文档收益归属上传用户
- 下载本文档