甘肃省张掖市第二中学2019-2020学年高一4月开学测试化学试卷
高一化学
可能用到的相对原子质量:H:1 C:12 O:16 N:14 Na:23 Mg:24 Al:27 S:32 Cl:35.5
K:39 Cu:64 Mn:55 Fe:56 Ba:137 Ca:40
第Ⅰ卷 选择题(共50分)
一、 选择题(共25小题,每小题2分,共50分)
1.下列有关描述正确的是( )
A.钠在空气中燃烧,发出淡蓝色的火焰,生成淡黄色固体
B.硅能导电,可用作光导纤维
C.玻璃花瓶和餐桌上的瓷盘都是硅酸盐产品
D.久置的氯水与新制的氯水,都能使有色布条退色
2.下列实验方案设计中可行的是( )
A.用分液的方法分离碘和四氯化碳
B.利用丁达尔效应鉴别Fe(OH)3胶体和FeCl3溶液
C.用溶解、过滤的方法分离CaCl2和AlCl3固体混合物
D.用澄清石灰水试液鉴别SO2和CO2两种气体
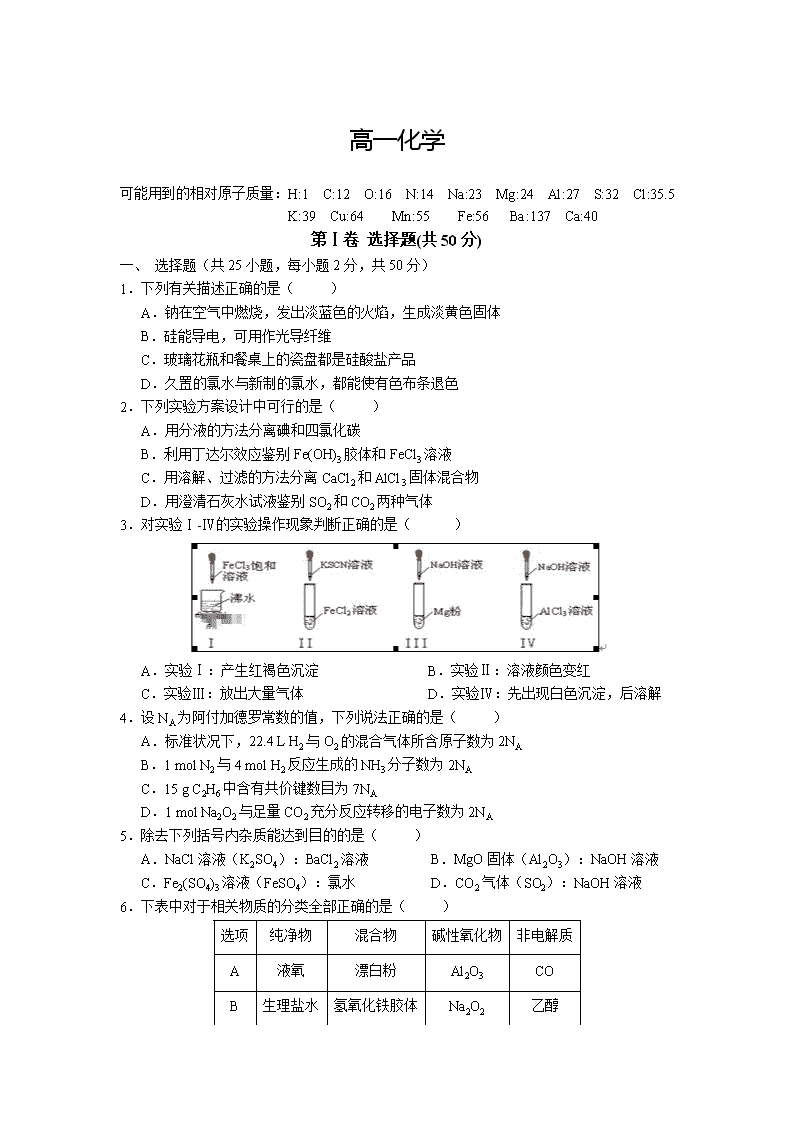
3.对实验Ⅰ-Ⅳ的实验操作现象判断正确的是( )
A.实验Ⅰ:产生红褐色沉淀 B.实验Ⅱ:溶液颜色变红
C.实验Ⅲ:放出大量气体 D.实验Ⅳ:先出现白色沉淀,后溶解
4.设NA为阿付加德罗常数的值,下列说法正确的是( )
A.标准状况下,22.4 L H2与O2的混合气体所含原子数为2NA
B.1 mol N2与4 mol H2反应生成的NH3分子数为2NA
C.15 g C2H6中含有共价键数目为7NA
D.1 mol Na2O2与足量CO2充分反应转移的电子数为2NA
5.除去下列括号内杂质能达到目的的是( )
A.NaCl溶液(K2SO4):BaCl2溶液 B.MgO固体(Al2O3):NaOH溶液
C.Fe2(SO4)3溶液(FeSO4):氯水 D.CO2气体(SO2):NaOH溶液
6.下表中对于相关物质的分类全部正确的是( )
选项
纯净物
混合物
碱性氧化物
非电解质
A
液氧
漂白粉
Al2O3
CO
B
生理盐水
氢氧化铁胶体
Na2O2
乙醇
C
碱石灰
盐酸
K2O
Cl2
D
胆矾
水玻璃
CaO
SO2
7.下列反应的离子方程式正确的是( )
A.将铜丝插入稀硝酸中:Cu + 4H+ + 2NO3- ===Cu2+ + 2NO2↑ + H2O
B.向氢氧化钡溶液中加入稀硫酸:Ba2++OH-+H++SO42- === BaSO4↓ + H2O
C.向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3·H2O===Al(OH)3↓+3NH4+
D.Cl2溶于水:Cl2 + H2O=2H+ + Cl- + ClO-
8.在下列各溶液中,离子一定能大量共存的是( )
A.强碱性溶液中:K+、Al3+、Cl-、SO42-
B.在无色透明的溶液中:K+、Cu2+、SO42-、NO3-
C.含有0.1 mol·L-1 Ca2+的溶液中:Na+、K+、CO32-、Cl-
D.室温下,pH=1的溶液中:Na+、Fe3+、NO3-、SO42-
9.O2F2可以发生反应:H2S+4O2F2===SF6+2HF+4O2,下列说法正确的是( )
A.氧气是氧化产物 B.O2F2既是氧化剂又是还原剂
C.还原剂与氧化剂的物质的量之比为1∶4 D.若生成4.48 L HF,则转移0.8 mol电子
10.右图是研究SO2性质的微型实验装置。现用60%硫酸溶液和亚硫酸钠晶体反应制取SO2气
体,实验现象很明显,且不污染空气。下列说法中错误的是( )
A.紫色石蕊溶液先变红色再褪色
B.品红溶液褪色
C.溴水的橙色褪去
D.含酚酞的NaOH溶液红色变浅
11.下列化学用语的书写,正确的是( )
A.氯原子的结构示意图:
B.质子数为117,中子数为176的Ts原子:
C.氯化镁的电子式:
D.氮气的电子式:∶N∶∶∶N∶
12.下列递变规律正确的是( )
A.O、S、Na、K的原子半径依次增大
B.Na、Mg、Al、Si的金属性逐渐增强
C.HF、HCl、H2S、PH3的稳定性依次增强
D.KOH、Ca(OH)2、Mg(OH)2、Al(OH)3的碱性逐渐增强
13.下列事实不能作为实验判断依据的是( )
A.钠和镁分别与冷水反应,判断金属活动性强弱
B.铁投入CuSO4溶液中,能置换出铜,钠投入CuSO4溶液中不能置换出铜,判断钠与铁
金属活动性强弱
C.酸性H2CO3
W->X+>Y3+
17.下列图示变化为吸热反应的是( )
18.将用导线连接的电极X、Y插入装有硫酸铜溶液的烧杯中(外电路中电子流向如图所示)。
据此判断下列说法正确的是( )
A.外电路中电流方向为X→Y
B.若电极材料分别为锌片和铜片,则Y为锌片
C.X极上发生还原反应
D.若电极材料都是金属,则金属活动性:X>Y
19.如图所示,X为单质硅,Y为金属铁,a为NaOH溶液,组装成一个原电池,下列说法正确的是
A.X为负极,电极反应式为Si-4e-=Si4+
B.X为正极,电极反应式为4H2O+4e-=4OH-+2H2↑
C.X为负极,电极反应式为Si+6OH--4e-=SiO+3H2O
D.Y为负极,电极反应式为Fe-2e-=Fe2+
20.将4 mol A气体和2 mol B气体置于1 L的密闭容器中,混合后发生如下反应:
2A(g) + B(g) = 2C(g)。若经2 s后测得C的浓度为1.2 mol/L,下列说法正确的是( )
A.用物质A表示的反应速率为1.2 mol/(L·s) B.2s时物质A的转化率为30%
C.用物质B表示的反应速率为0.6 mol/(L·s) D.2s时物质B的浓度为0.6 mol/L
21.其他条件不变时,能使反应速率加快的是( )
A.对于N2(g)+3H2(g)⇌2NH3(g),容器体积固定不变时,充入N2
B.对于反应3Fe(s)+4H2O(g)⇌Fe3O4(s)+4H2(g),增加Fe的量
C.对于N2(g)+3H2(g)⇌2NH3(g),容器体积固定不变时,充入Ar
D.对于N2(g)+3H2(g)⇌2NH3(g),容器气体压强不变时,充入Ar
22.在一定温度下的定容容器中,发生反应3A(g)+ B(s) ⇌ 2C(g)+ D(g),下列描述中能表明反应已达到平衡状态的是 ( )
①混合气体的压强不变
②混合气体的密度不变
③混合气体的平均摩尔质量不变
④容器内A、C、D三种气体的浓度之比为3:2:1
⑤单位时间内生成n mol D,同时生成3 n mol A
⑥单位时间内消耗n mol B,同时生成2 n mol C
A.①②③ B.①②⑤⑥ C.③④⑥ D.②③⑤
23.下列叙述错误的是( )
A.通常情况下,甲烷跟强酸、强碱和强氧化剂都不反应
B.甲烷化学性质稳定,不能被任何氧化剂氧化
C.甲烷与Cl2反应无论生成CH3Cl、CH2Cl2、CHCl3还是CCl4,都属于取代反应
D.甲烷的四种有机取代产物有一种气态,其余三种为液态且都不溶于水
24.下列各组中的关系互为同系物的是( )
A.1H和2H B.CH3﹣CH2﹣CH2﹣CH3和
C.C2H6和C3H8 D.O2和O3
25.下列说法说法正确的是( )
A.乙烷一氯代物的同分异构体有2种,二氯代物的同分异构体有3种
B.丙烷一氯代物的同分异构体有2种,二氯代物的同分异构体有4种
C.正丁烷一氯代物的同分异构体有2种,二氯代物的同分异构体有5种
D.正戊烷一氯代物的同分异构体有3种,二氯代物的同分异构体有8种
第 II 卷(非选择题,共 50 分)
二、填空题
26.Ⅰ.常见物质A~K之间存在如下图所示的转化关系,其中A、D、E、H为单质,请回答下列问题。
(1)下列物质的化学式是:C ,H 。
(2)反应“I→J”的离子方程式是 。
(3)检验J溶液中的金属离子的方法是(写出操作步骤、现象及结论)
。
Ⅱ.A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去)。
(1)若A是一种黄色单质固体,则B→C的化学方程式为 。
(2)若A是一种活泼金属,C是淡黄色固体,则C的名称为 ,试用化学方程式表
示该物质与水的反应 。将C长期露置于空
气中,最后将变成物质D,D的化学式为 。
(3)若C是红棕色气体,A是一种能使湿润的红色石蕊试纸变蓝的气体。请结合所学知识,写
出实验室制取A的化学方程式 。
27.A、B、C、D、E均为短周期元素,原子序数依次增大,请根据表中信息回答下列问题:
元素
元素性质或结构
A
最外层电子数是其内层电子数的2倍
B
B元素单质在空气中含量最多
C
C元素在地壳中含量最多
D
D是同周期中原子半径最小的元素
E
E元素在同周期中金属性最强
F
F元素的最外层电子数等于周期序数
G
G元素原子M层上电子数比L上少2个电子。
(1)G在元素周期表中的位置 。
(2)B最简单气态氢化物的结构式_ __,属于__ __化合物(填“离子”或“共价”);
E的最高价氧化物的水化物电子式_ __,所含化学键类型 __ _。
(3) C、D、E、F、G简单离子半径由大到小顺序为: ____(填离子符号)。
(4)用电子式表示G的氢化物的形成过程__ ___。
(5)A元素的某氧化物与E元素的某含氧化合物反应生成单质的化学方程式是
________________________________________________________________________。
(6)E、F两元素最高价氧化物对应水化物相互反应的离子方程式: 。
28.
(1)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,作负极的分别是 __(填字母)。
A. 铝片、铜片 B. 铜片、铝片 C. 铝片、铝片 D. 铜片、铜片
写出插入烧碱溶液中形成的原电池的负极反应式:_ ___。
(2)若A为Pb,B为PbO2,电解质为H2SO4溶液,工作时的总反应为
Pb+PbO2+2H2SO4=2PbSO4+2H2O。写出A电极反应式: __;
该电池在工作时,A电极的质量将_ (填“增加”“减小”或“不变”)。若该电池反
应消耗了0.1 mol H2SO4,则转移电子的数目为_ _。
(3)若A、B均为铂片,电解质为KOH溶液,分别从A、B两极通入H2和O2,该电池即为氢氧燃料电池,写出B电极反应式:____ _____;该电池在工作一段时间后,溶液的碱性将_ __(填“增强”“减弱”或“不变”)。
(4)若A、B均为铂片,电解质为H2SO4溶液,分别从A、B两极通入CH4和O2,该电池即为甲烷燃料电池,写出A电极反应式:_____ ___;若该电池反应消耗了6.4gCH4,则转移电子的数目为_ _。
29.将气体A、B置于固定容积为2 L的密闭容器中,发生如下反应:
3A(g)+B(g)2C(g)+2D(g),反应进行到10 s末,达到平衡,测得A的物质的量为1.8 mol,B的物质的量为0.6 mol,C的物质的量为0.8 mol。
(1)用C表示10 s内反应的平均反应速率为_ ___。
(2)反应前A的物质的量浓度是 ____。
(3)10 s末,生成物D的浓度为_ _。
(4)A与B的平衡转化率之比为 ___。
(5)平衡后,若改变下列条件,生成D的速率如何变化(填“增大”、“减小”或“不变”):
①降低温度__ __; ②增大压强 ;
③增大A的浓度_ ____; ④恒容下充入Ne_____ ___。
(6)下列叙述能说明该反应已达到化学平衡状态的是(填标号)__ _;
A.v(B)=2v(C) B.容器内压强不再发生变化
C.A的体积分数不再发生变化 D.器内气体密度不再发生变化
E.相同时间内消耗n mol的B的同时生成2n mol的D
高一化学(理科)答案
一、选择题:
1
C
2
B
3
D
4
A
5
B
6
D
7
C
8
D
9
C
10
A
11
C
12
A
13
B
14
C
15
B
16
D
17
A
18
D
19
C
20
B
21
A
22
D
23
B
24
C
25
B
二、填空题
26.(14分,名称或化学式每空1分,其余每空2分)
Ⅰ.
(1) AlCl3 , Fe 。
(2)2Fe2+ + Cl2 = 2Fe3+ + 2Cl-
(3)在试管中取少量J溶液,向其中滴加几滴KSCN溶液,振荡,若溶液变为红色,则说明J
溶液含有Fe3+。
Ⅱ.
(1) 。
(2)过氧化钠,2Na2O2+2H2O==4NaOH+O2,Na2CO3。
(3)。
27.(每空1 分,共9分)
(1)第3周期第ⅥA族;
(2),共价,,离子键和共价键;
(3)r(S2-)>r(O2-)>r(F-)>r(Na+)>r(Al3+)
(4)
(5)2Na2O2+2CO2==2Na2CO3+O2
(6)Al(OH)3 + OH- == AlO2- + 2H2O
28.(每空2 分,共18分)
(1)B; Al-3e-+4OH-=AlO2-+2H2O
(2)Pb -2 e-+SO42-=PbSO4 ; 增加 ;0.1NA或6.02´1022
(3)O2+4e-+2H2O=4OH- ; 减弱 (4)CH4-8e-+2H2O=CO2+8H+; 3.2NA或 3.2´6.02´1023
29.(每空1分,共9分)
(1) 0.04mol/(L∙s) (2)1.5 mol/L (3)0.4 mol/L
(4) 1:1 (5)①减小 ②增大 ③增大 ④不变 (6)C