- 2021-04-21 发布 |
- 37.5 KB |
- 22页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
河北省秦皇岛一中2019-2020学年高一上学期第一次月考化学试题
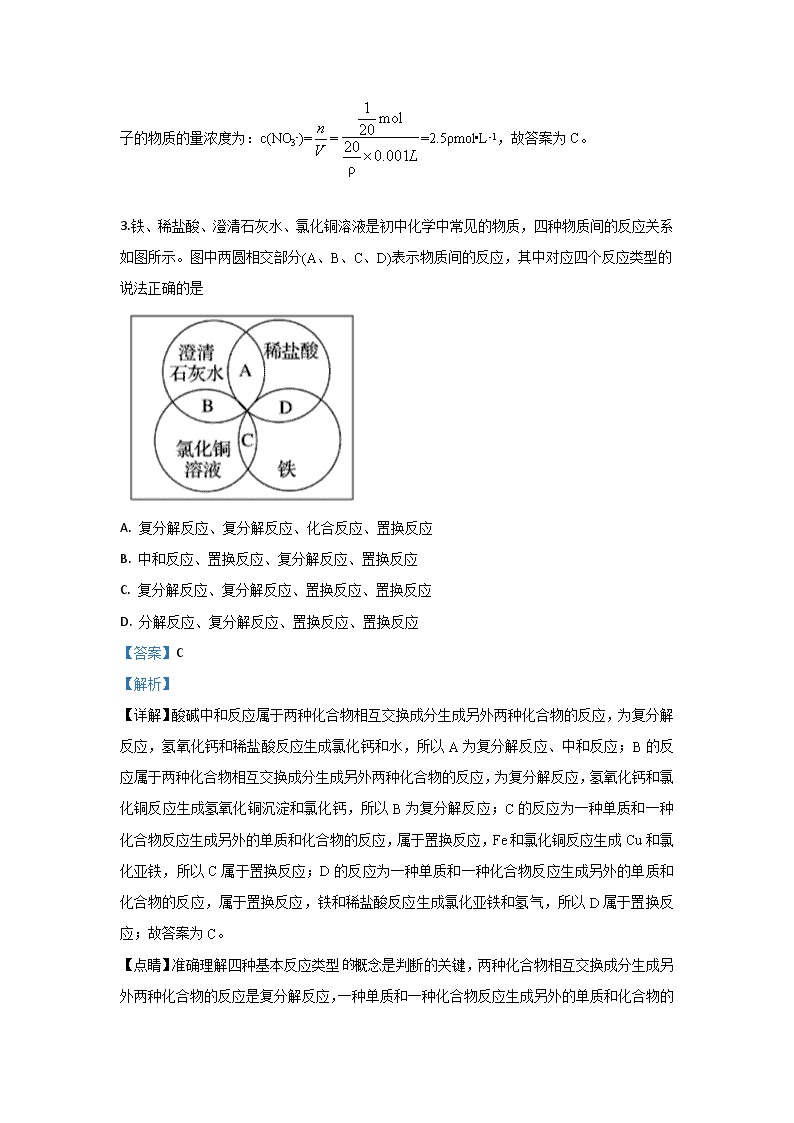
河北秦皇岛一中2019-2020学年高一上第一次月考 化学试题 1.在强酸性溶液中,下列离子组能大量共存且溶液为无色透明的是( ) A. Na+ K+ OH- Cl- B. Na+ Cu2+ SO42— NO3— C. Mg2+ Na+ SO42— Cl- D. Ba2+ K+HCO3— NO3— 【答案】C 【解析】 分析:强酸溶液中含大量的氢离子,根据离子之间不能结合生成水、气体、沉淀等,则离子大量共存,并结合离子的颜色来解答。 详解:A.因H+、OH-结合生成水,则不能共存,选项A错误;B.该组离子之间不反应,能共存,但Cu2+为蓝色,与无色溶液不符,选项B错误;C.该组离子之间不反应,能共存,且均为无色离子,选项C正确;D.HCO3-、H+结合生成水和二氧化碳气体,则不能共存,选项D错误;答案选C。 点睛:本题考查离子共存的正误判断,属于中等难度的试题,注意掌握离子反应发生条件,明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能生成难溶物的离子之间;能发生氧化还原反应的离子之间等;解决离子共存问题时还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在。 2.若20g密度为ρg·cm-3的Ca(NO3)2溶液里含1gCa2+,则NO的物质的量浓度是(mol·L-1) A. B. C. 2.5ρ D. 1.25ρ 【答案】C 【解析】 【详解】该硝酸钙溶液的体积为:V===cm3,1g钙离子的物质的量为:mol,则该硝酸钙溶液中含有硝酸根离子的物质的量为:mol ,则该溶液中硝酸根离子的物质的量浓度为:c(NO3-)===2.5ρmol•L-1,故答案为C。 3.铁、稀盐酸、澄清石灰水、氯化铜溶液是初中化学中常见的物质,四种物质间的反应关系如图所示。图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应四个反应类型的说法正确的是 A. 复分解反应、复分解反应、化合反应、置换反应 B. 中和反应、置换反应、复分解反应、置换反应 C. 复分解反应、复分解反应、置换反应、置换反应 D. 分解反应、复分解反应、置换反应、置换反应 【答案】C 【解析】 【详解】酸碱中和反应属于两种化合物相互交换成分生成另外两种化合物的反应,为复分解反应,氢氧化钙和稀盐酸反应生成氯化钙和水,所以A为复分解反应、中和反应;B的反应属于两种化合物相互交换成分生成另外两种化合物的反应,为复分解反应,氢氧化钙和氯化铜反应生成氢氧化铜沉淀和氯化钙,所以B为复分解反应;C的反应为一种单质和一种化合物反应生成另外的单质和化合物的反应,属于置换反应,Fe和氯化铜反应生成Cu和氯化亚铁,所以C属于置换反应;D的反应为一种单质和一种化合物反应生成另外的单质和化合物的反应,属于置换反应,铁和稀盐酸反应生成氯化亚铁和氢气,所以D属于置换反应;故答案为C。 【点睛】准确理解四种基本反应类型 概念是判断的关键,两种化合物相互交换成分生成另外两种化合物的反应是复分解反应,一种单质和一种化合物反应生成另外的单质和化合物的反应是置换反应,两种或多种物质生成一种物质的反应是化合反应,一种物质生成两种或多种物质的反应是分解反应,据此分析解答。 4.物质的量浓度相同的NaCl、MgCl2、AlCl3三种物质的溶液,当溶液的体积比为3∶2∶1 时,它们与同一浓度的AgNO3溶液恰好反应,则消耗的AgNO3溶液的体积比是 A. 3∶4∶3 B. 1∶1∶1 C. 1∶2∶3 D. 3∶2∶1 【答案】A 【解析】 设NaCl、MgCl2、AlCl3三种溶液的物质的量浓度为c,则三种溶液中Cl-物质的量浓度分别为c、2c、3c;又因为溶液的体积比为3∶2∶1,则三种溶液中Cl-的物质的量之比为(3×c)∶(2×2c)∶(1×3c)=3∶4∶3,消耗的AgNO3的物质的量之比为3∶4∶3;AgNO3溶液浓度相同,所以消耗AgNO3溶液的体积比为3∶4∶3。选A。 5. 下列事实与胶体性质无关的是 ( ) A. 水泥厂和冶金厂常用高压直流电除去大量烟尘,减少对空气的污染 B. 将植物油倒入水中用力搅拌形成油水混合物 C. 一束平行光线射入蛋白质溶液里,从侧面可以看到一条光亮的通路 D. 氢氧化铁胶体中滴入稀硫酸,先看到红褐色沉淀生成而后沉淀溶解 【答案】B 【解析】 6.某实验小组只领取下列仪器和用品:铁架台、铁夹、铁圈、三角架、石棉网、烧杯、漏斗、分液漏斗、酒精灯、玻璃棒、量筒、蒸发皿、圆底烧瓶、火柴、滤纸。不能进行的实验操作是 A. 蒸发 B. 萃取 C. 过滤 D. 蒸馏 【答案】D 【解析】 【详解】A.蒸发必须使用到酒精灯、蒸发皿、玻璃棒等仪器,这些仪器都有,故A正确; B.萃取必须使用分液漏斗和烧杯,这些仪器都有,故B正确; C.过滤必须使用的漏斗、玻璃棒、烧杯等及滤纸等,这些仪器都有,故C正确; D.蒸馏必须使用铁架台、铁夹、铁圈、石棉网、酒精灯、圆底烧瓶、冷凝管等,这些仪器中没有冷凝管,故D错误; 故答案为D。 7.经测定一瓶气体中只含C和O两种元素,通常情况下这瓶气体不可能是( ) A. 一种化合物 B. 两种单质 C. 两种化合物 D. 一种单质和一种化合物的混合物 【答案】B 【解析】 【详解】A、可以是CO或CO2,故A不选; B、碳单质是固体,不是气体,故B选; C、可以是CO和CO2两种化合物的混合物,故C不选; D、可以是O2和CO或CO2的混合物,D不选;答案选B。 8.下列说法正确的是 A. 摩尔既是物质的量的单位,又是粒子的数量单位 B. 2 mol O2的摩尔质量是64 g/mol C. 当摩尔质量以g·mol-1为单位时,在数值上与阿伏加德罗常数个该物质的微粒的质量总和相等(质量以g为单位) D. 1 mol SO2中含有2 mol氧元素 【答案】C 【解析】 【详解】A.摩尔是物质量的单位,不是粒子的数量单位,故A错误; B.O2的摩尔质量是32g/mol,与氧气的物质的量多少无关,故B错误; C.由于质量m=nM,故当摩尔质量以g•mol-1为单位时,摩尔质量在数值上与阿伏伽德罗常数个该物质的微粒即1mol该物质的质量总和相等,故C正确; D. SO2由1个硫原子和2个氧原子构成,即1mol二氧化硫中含2mol氧原子而不是氧元素,故D错误; 故答案为C。 9.用NA表示阿伏加德罗常数的值。下列判断错误的是( ) A. NA个H+的质量为1 g B. 2 L 0.5 mol/L Na2SO4溶液中含NA个Na+ C. 32 g O2中含有2NA个氧原子 D. 标准状况下,1 mol H2O中含有NA个分子 【答案】B 【解析】 试题分析:A、NA个H+的物质的量为1mol,1mol氢离子的质量为1g,A正确;B、2 L 0.5 mol/L Na2SO4溶液中含有1mol硫酸钠,含有2mol钠离子,溶液中含2NA个Na+,B错误;C、32g氧气的物质的量为1mol,含有2mol氧原子,含有2NA个O原子,C正确;D、1 mol H2O中含有NA个分子,D正确。答案选B。 考点:阿伏加德罗常数 10.由K2SO4、Al2(SO4)3、KAl(SO4)2形成的混合溶液,其中Al3+的物质的量浓度为0.4 mol·L-1,SO42-的物质的量浓度为0.7 mol·L-1,则此溶液中K+的物质的量浓度(mol·L-1)为 A. 0.1 B. 0.15 C. 0.2 D. 0.25 【答案】C 【解析】 【详解】溶液呈电中性,则满足:3c(Al3+)+c(K+)+c(H+)=2c(SO42-)+c(OH-),由于溶液中c(H+)和c(OH-)很小,可忽略不计,则有3c(Al3+)+c(K+)=2c(SO42-),则:3×0.4mol/L+c(K+)=2×0.7mol/L,所以溶液中钾离子浓度为:c(K+)=2×0.7mol/L-3×0.4mol/L=0.2mol/L,故答案为C。 【点睛】溶液是电中的性,根据溶液中所含有的阴、阳离子,准确写出电荷守恒式是解题关键,本题溶液中应满足:3c(Al3+)+c(K+)+c(H+)=2c(SO42-)+c(OH-),由于溶液中c(H+)和c(OH-)很小,可忽略不计,则有3c(Al3+)+c(K+)=2c(SO42-),以此结合题中数据进行解答。 11.朱自清在《荷塘月色》中写道:“薄薄的青雾浮起在荷塘里…… 月光是隔了树照过来的,高处丛生的灌木,落下参差的斑驳的黑影……”月光穿过薄雾所形成的种种美景的最本质原因是 A. 空气中小水滴颗粒大小约为10-9 m~10-7 m B. 光是一种胶体 C. 雾是一种胶体 D. 发生丁达尔效应 【答案】A 【解析】 【分析】 “薄薄的青雾浮起在荷塘里…… 月光是隔了树照过来的,高处丛生的灌木,落下参差的斑驳的黑影……”月光穿过薄雾所形成的种种美景,是胶体中的丁达尔效应,本质原因是分散质微粒直径的大小。 【详解】A、题干中所提及的雾,是空气中的小液滴,是一种胶体,本质特征是分散质粒子的直径在1~100nm,即10-9m~10-7m,故A正确; B、雾是胶体,光不是胶体,故B错误; C、雾是胶体,但这不是月光穿过薄雾所形成美景的本质原因,故C错误; D、丁达尔效应是胶体性质,但本质原因是分散质微粒直径大小,故D错误。答案选A。 12.如图是10mL量筒的一部分,数字xy之间相差2 mL,若x=5,则量筒所盛液体的体积是 A. 4.4 mL B. 3.8 mL C. 3.6 mL D. 4.7 mL 【答案】C 【解析】 【详解】用量筒量量液时,量筒必须放平,视线要与量筒内液面的凹液面的最低处保持水平,即眼睛、刻度、凹液面的最低处三点一线,再读出所取液体的体积数,量筒从下到上刻度增大,由图示可知:数字xy之间相差2ml,若x=5,则y=3,一个小格为0.2ml,量筒内液体的体积数是3.6ml,故答案为C。 13. 对于易燃、易爆、有毒的化学物质,往往会在其包装上面贴上危险警告标签。下面所列物质,贴错了包装标签的是 选项 A B C D 物质 苛性钠 酒精 苏打 硝酸铵 标签 A. A B. B C. C D. D 【答案】C 【解析】 【详解】A.苛性钠为氢氧化钠具有腐蚀性,标签正确,故A正确; B.酒精是易燃液体,标签正确,故B正确; C.苏打是碳酸钠为纯碱,无毒物质,标签贴错,故C错误; D.硝酸铵撞击或受热乙分解发生爆炸,属于爆炸品,故D正确; 故答案为C。 14.为了除去粗盐中的CA2+、Mg2+、SO及泥沙,可将粗盐溶于水,然后进行下列5项操作:①过滤;②加过量NAOH溶液;③加适量盐酸;④加过量NA2CO3溶液;⑤加过量BACl2溶液。正确的操作顺序可以是( ) A. ⑤②④③① B. ④①②⑤③ C. ②⑤④①③ D. ①④②⑤③ 【答案】C 【解析】 试题分析:除杂不能引入新杂质,除杂试剂需过量,NAOH除去Mg2+,BACl2溶液除去SO42-,NA2CO3除去CA2+和过量的BA2+,因此所加试剂的顺序是NAOH、BACl2、NA2CO3或BACl2、NAOH、NA2CO3或BACl2、NA2CO3 、NAOH,然后过滤,除去沉淀,再向滤液中加入盐酸,除去过量的NAOH和NA2CO3,故选项C正确。 考点:考查粗盐的提纯和物质除杂等知识。 15.下列实验操作:①过滤 ②溶解 ③蒸馏 ④取用药品 ⑤萃取 ⑥配制一定浓度的溶液,一定要用到玻璃棒的是 A. ①②⑥ B. ②③⑥ C. ③④⑥ D. ④⑤⑥ 【答案】A 【解析】 ①过滤时用玻璃棒引流,故①正确; ②溶解固体时搅拌是加速溶解,故②正确; ③蒸馏用蒸馏烧瓶,不用玻璃棒,故③错误; ④取用药品用药匙,不用玻璃棒,故④错误; ⑤萃取用分液漏斗,不用玻璃棒,故⑤错误; ⑥配制一定体积的物质的量浓度的溶液用玻璃棒引流,故⑥正确.故选A. 【点评】本题考查了玻璃棒在各个实验中的作用,题目难度不大,明确实验操作及操作的目的即可解答,注重对操作的理解来解答. 16.离子方程式:Ba2++SO42-=BaSO4↓可能表示:①可溶性钡盐溶液与可溶性硫酸盐溶液之间的反应②氢氧化钡溶液与可溶性硫酸盐溶液之间的反应③稀硫酸与可溶性钡盐溶液之间的反应④氢氧化钡溶液与稀硫酸反应 A. ①② B. ①②④ C. ②③ D. ①③ 【答案】D 【解析】 【详解】①可溶性钡盐溶液与可溶性硫酸盐溶液之间的反应,其离子方程式可以用离子方程式Ba2++SO42-=BaSO4↓来表示,故①正确; ②氢氧化钡溶液与可溶性硫酸盐溶液之间的反应,如硫酸钠与氢氧化钡溶液的离子方程式为:Ba2++SO42-+Cu2++2OH-=Cu(OH)2↓+BaSO4↓,不能用离子方程式Ba2++SO42-=BaSO4↓来表示,故②错误; ③稀硫酸与可溶性钡盐溶液之间的反应,能用离子方程式Ba2++SO42-=BaSO4↓来表示,故③正确; ④氢氧化钡溶液与稀硫酸的离子方程式为 2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,不能用离子方程式Ba2++SO42-=BaSO4↓来表示,故④错误; 所以可以用离子方程式Ba2++SO42-=BaSO4↓来表示的有①③,故答案为D。 【点睛】离子方程式Ba2++SO42-=BaSO4↓表示可溶性钡盐或氢氧化钡溶液与稀硫酸可溶性硫酸盐溶液之间的部分反应,要求同时反应生成产物除了硫酸钡沉淀外,不存在其它需要保留化学式的物质,如:水、弱电解质、难溶物等,据此进行判断。 17.如果Mg2+、M、Fe3+和Cl-四种离子以物质的量之比1∶3∶2∶2共存于同一溶液,那么M可能是 A. CO32- B. NO3- C. OH- D. SO42- 【答案】D 【解析】 【详解】Mg2+、M、Fe3+和Cl-四种离子以物质的量之比1:3:2:2共存于同一溶液,设Mg2+、M、Fe3+和Cl-四种离子的物质的量分别为1mol、3mol、2mol、2mol,则阳离子所带电荷总数为1mol×2+2mol×3=8mol,阴离子所带电荷总数为2mol×1=2mol,由电荷守恒可知M应为阴离子,且所带电荷总数为8mol-2mol=6mol,结合其物质的量为3mol,可知M为带2个单位负电荷的阴离子,但Fe3+和CO32-相互促进水解生成沉淀和气体,不能共存,只有SO42-符合题意,故答案为D。 18.下列叙述中正确的是 A. 在熔融状态下或溶解于水时能导电的物质叫做电解质 B. 强电解质的溶液导电性一定很强 C. Na2O的水溶液导电是因为它与水反应生成了氢氧化钠而导电,因此Na2O是非电解质 D. NaHCO3是弱酸的酸式盐,但它是强电解质 【答案】D 【解析】 【详解】A.在熔融状态下或溶解于水时能导电的化合物叫做电解质,故A错误; B.导电性的强弱与单位体积内可自由移动的阴、阳离子数目有关,与强、弱电解质的溶液无关,故B错误; C.Na2O的水溶液导电是因为它与水反应生成了氢氧化钠而导电,故NaOH是电解质,但 Na2O熔融状态下也能导电,则Na2O也是电解质,故C错误; D.NaHCO3是弱酸的酸式盐,但在水溶液中能完全电离出Na+和HCO3-,则NaHCO3是强电解质,故D正确; 故答案为D。 19.在反应X+2Y===R+2M中,已知R和M的摩尔质量之比为22∶9,当1.6 g X与Y完全反应后,生成4.4 g R。则在此反应中Y和M的质量之比为( ) A. 16∶9 B. 23∶9 C. 32∶9 D. 46∶9 【答案】A 【解析】 试题分析:①应为根据已知条件“R和M的相对分子质量之比为22:9”,则R:2M=22:2×9=22:18,设生成的M的质量为a,因为22:18=4.4g:a,解之得:a=3.6g;②根据质量守恒定律可得Y的质量=4.4g+3.6g-1.6g=6.4g;∴此反应中Y和M的质量比是6.4g:3.6g=16:9.故选A. 考点:化学方程式的有关计算 20.完成下列实验所选择的装置或仪器都正确的是( ) A B C D 实验 分离植物油和氯化钠溶液 除去氯化钠晶体中混有的氯化钾晶体 分离CCl4中的Br2 除去CO2气体中的HCl气体 装置 或仪器 A. A B. B C. C D. D 【答案】A 【解析】 试题分析:A、植物油和氯化钠溶液不混溶,可以选用分液的方法分离,故A正确;B、氯化铵受热容易分解,可以选用加热的方法除去氯化钠晶体中混有的氯化铵,故B错误;C、CCl4和Br2的沸点不同,可以选用蒸馏的方法分离分离CCl4中的Br2,故C错误;D、CO2和HCl都能够与氢氧化钠反应,故D错误;故选A。 考点:考查了物质的分离和提纯的相关知识。 21.三种气体X、Y、Z的相对分子质量关系为Mr(X)查看更多
相关文章
- 当前文档收益归属上传用户
- 下载本文档