- 2021-04-20 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019-2020学年高二人教版化学选修三练习:3_2 分子晶体与原子晶体含答案
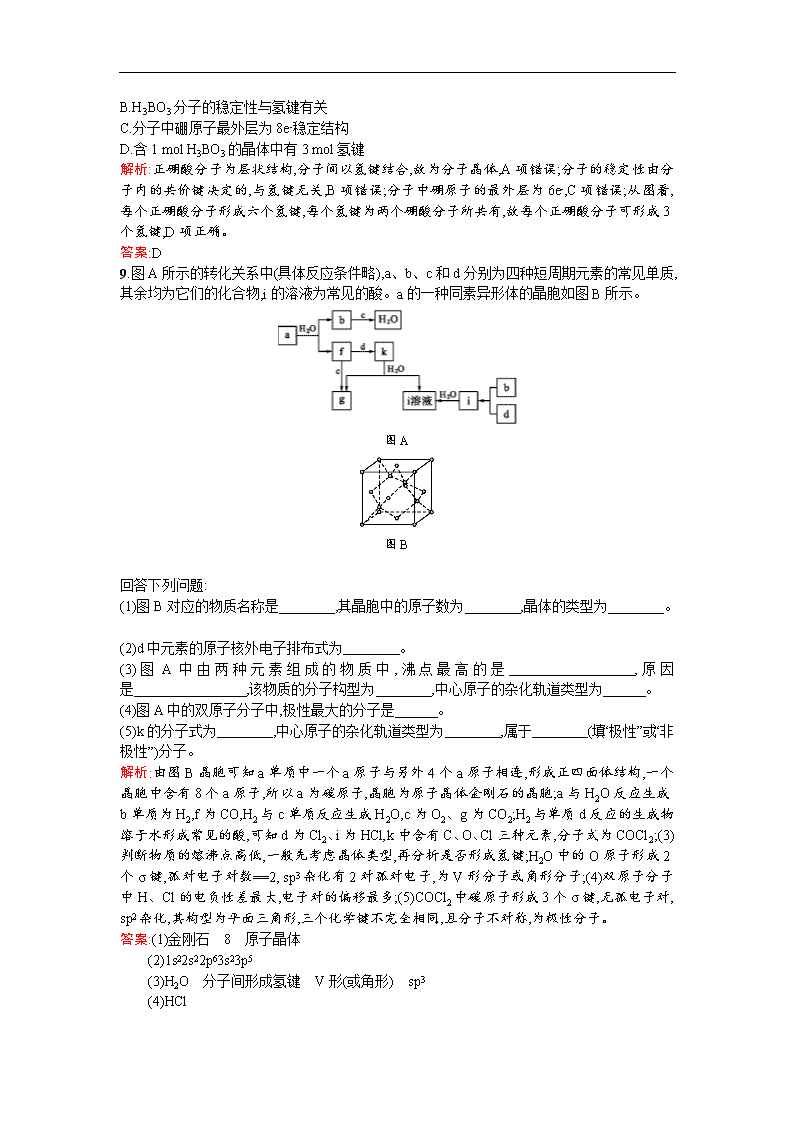
第二节 分子晶体与原子晶体 课时演练·促提升 A组 1.下列各组物质各自形成晶体,均属于分子晶体的化合物是( ) A.NH3、HD、C8H10 B.PCl3、CO2、H2SO4 C.SO2、SO3、C60 D.CCl4、Na2S、H2O2 解析:A项,HD是单质,不是化合物;C项,C60是单质,不是化合物;D项,Na2S是盐,无分子存在,不是分子晶体。 答案:B 2.BeCl2熔点较低,易升华,溶于醇和醚,其化学性质与AlCl3相似。由此可推测BeCl2( ) A.熔融态不导电 B.水溶液呈中性 C.熔点比BeBr2高 D.不与NaOH溶液反应 解析:根据题目提供的信息“BeCl2熔点较低,易升华,溶于醇和醚”,可知BeCl2形成的晶体属于分子晶体,分子晶体是由分子构成的晶体,故熔融状态下不导电,A项正确;根据题目提供的信息“BeCl2化学性质与AlCl3相似”,由于AlCl3溶液中的Al3+能发生水解[Al3++3H2OAl(OH)3+3H+]使溶液显酸性,所以BeCl2水溶液显酸性,B项错误;BeCl2和BeBr2形成的晶体都是分子晶体,且二者结构相似,故随着相对分子质量的增大,熔沸点也逐渐增大,C项错误;由“AlCl3能与NaOH反应”可知BeCl2也能与NaOH反应,D项错误。 答案:A 3.水的沸点是100 ℃,硫化氢的分子结构跟水相似,但它的沸点却很低,是-60.7 ℃,引起这种差异的主要原因是( ) A.范德华力 B.共价键 C.氢键 D.相对分子质量 解析:水分子之间存在氢键,氢键是一种较强的分子间作用力,氢键的存在使水的沸点比硫化氢的高。 答案:C 4.短周期元素X、Y、Z、W、Q在元素周期表中的位置如表所示,其中X元素的原子内层电子数是最外层电子数的一半,则下列说法中正确的是( ) X Y Z W Q A.钠与W可能形成Na2W2化合物 B.由Z与Y组成的物质在熔融时能导电 C.W得电子能力比Q强 D.X有多种同素异形体,而Y不存在同素异形体 解析:由题意知,X、Y属于第二周期元素,Z、W、Q为第三周期元素。X为碳元素,Y为氧元素,Z为硅元素,W为硫元素,Q为氯元素。 A项,钠与硫可形成Na2S2。B项,Z与Y形成SiO2,SiO2为共价化合物,熔融时不导电。C项,硫的非金属性比氯的非金属性弱,故得电子能力差。D项,碳可形成同素异形体,如金刚石、石墨等;氧可形成同素异形体,如O2、O3。 答案:A 5.下列关于原子晶体、分子晶体的叙述中,正确的是( ) A.在SiO2晶体中,1个硅原子和2个氧原子形成2个共价键 B.晶体中分子间作用力越大,分子越稳定 C.C6H5OH既能表示物质的组成,又能表示物质的一个分子 D.分子晶体的熔、沸点低,常温下均呈液态或气态 解析:SiO2晶体中1个硅原子和4个氧原子形成4个共价键,A项错误;晶体中分子间作用力影响的是物质的物理性质,如熔、沸点等,分子的稳定性与分子内化学键的强弱有关,B项错误;虽然分子晶体的熔、沸点很低,但在常温下也有呈固态的,如白磷。 答案:C 6.下列说法中,正确的是( ) A.冰融化时,分子中H—O键发生断裂 B.原子晶体中,共价键越强,熔点越高 C.分子晶体中,共价键键能越大,该分子晶体的熔点一定越高 D.分子晶体中,分子间作用力越大,该物质越稳定 解析:A项,冰为分子晶体,融化时破坏的是分子间作用力,A项错误。B项,原子晶体熔点的高低取决于共价键的强弱,共价键越强,熔点越高,B项正确。分子晶体熔点的高低取决于分子间作用力,而共价键的强弱决定了分子的稳定性,所以C项错误,D项也错误。 答案:B 7.HgCl2稀溶液可作为手术刀的消毒剂,已知HgCl2有如下性质:①HgCl2晶体熔点较低;②HgCl2熔融状态下不导电;③HgCl2在水溶液中可发生微弱电离。下列关于HgCl2的叙述正确的是( ) A.HgCl2晶体属于分子晶体 B.HgCl2属于离子化合物 C.HgCl2属于电解质,且属于强电解质 D.HgCl2属于非电解质 解析:由信息①可知HgCl2晶体属于分子晶体,A项正确;由信息②③可知HgCl2属于共价化合物,且为弱电解质,故B、C、D均错误。 答案:A 8.正硼酸(H3BO3)是一种层状结构白色晶体,层内的H3BO3分子通过氢键相连(如图)。下列有关说法正确的是( ) A.正硼酸晶体属于原子晶体 B.H3BO3分子的稳定性与氢键有关 C.分子中硼原子最外层为8e-稳定结构 D.含1 mol H3BO3的晶体中有3 mol氢键 解析:正硼酸分子为层状结构,分子间以氢键结合,故为分子晶体,A项错误;分子的稳定性由分子内的共价键决定的,与氢键无关,B项错误;分子中硼原子的最外层为6e-,C项错误;从图看,每个正硼酸分子形成六个氢键,每个氢键为两个硼酸分子所共有,故每个正硼酸分子可形成3个氢键,D项正确。 答案:D 9.图A所示的转化关系中(具体反应条件略),a、b、c和d分别为四种短周期元素的常见单质,其余均为它们的化合物,i的溶液为常见的酸。a的一种同素异形体的晶胞如图B所示。 图A 图B 回答下列问题: (1)图B对应的物质名称是 ,其晶胞中的原子数为 ,晶体的类型为 。 (2)d中元素的原子核外电子排布式为 。 (3)图A中由两种元素组成的物质中,沸点最高的是 ,原因是 ,该物质的分子构型为 ,中心原子的杂化轨道类型为 。 (4)图A中的双原子分子中,极性最大的分子是 。 (5)k的分子式为 ,中心原子的杂化轨道类型为 ,属于 (填“极性”或“非极性”)分子。 解析:由图B晶胞可知a单质中一个a原子与另外4个a原子相连,形成正四面体结构,一个晶胞中含有8个a原子,所以a为碳原子,晶胞为原子晶体金刚石的晶胞;a与H2O反应生成b单质为H2,f为CO,H2与c单质反应生成H2O,c为O2、g为CO2;H2与单质d反应的生成物溶于水形成常见的酸,可知d为Cl2、i为HCl,k中含有C、O、Cl三种元素,分子式为COCl2;(3)判断物质的熔沸点高低,一般先考虑晶体类型,再分析是否形成氢键;H2O中的O原子形成2个σ键,孤对电子对数==2, sp3杂化有2对孤对电子,为V形分子或角形分子;(4)双原子分子中H、Cl的电负性差最大,电子对的偏移最多;(5)COCl2中碳原子形成3个σ键,无孤电子对, sp2杂化,其构型为平面三角形,三个化学键不完全相同,且分子不对称,为极性分子。 答案:(1)金刚石 8 原子晶体 (2)1s22s22p63s23p5 (3)H2O 分子间形成氢键 V形(或角形) sp3 (4)HCl (5)COCl2 sp2 极性 10.(2014福建理综)氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂。立方相氮化硼是超硬材料,有优异的耐磨性。它们的晶体结构如图所示。 六方相氮化硼 (1)基态硼原子的电子排布式为 。 (2)关于这两种晶体的说法,正确的是 (填序号)。 a.立方相氮化硼含有σ键和π键,所以硬度大 b.六方相氮化硼层间作用力小,所以质地软 c.两种晶体中的B—N键均为共价键 d.两种晶体均为分子晶体 (3)六方相氮化硼晶体层内一个硼原子与相邻氮原子构成的空间构型为 ,其结构与石墨相似却不导电,原因是 。 (4)立方相氮化硼晶体中,硼原子的杂化轨道类型为 。该晶体的天然矿物在青藏高原地下约300 km的古地壳中被发现。根据这一矿物形成事实,推断实验室由六方相氮化硼合成立方相氮化硼需要的条件应是 。 (5)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一。1 mol NH4BF4含有 mol配位键。 解析:(1)硼原子核外有5个电子,电子排布式为1s22s22p1;(2)六方相氮化硼与石墨相似,层间是分子间作用力;立方相氮化硼中都是单键,无π键,二者均不是分子晶体,b、c正确;(3)六方相氮化硼晶体层内一个硼原子与3个氮原子形成平面三角形结构,最外层电子全部成键,没有自由移动的电子存在,故不能导电;(4)立方相氮化硼晶体中,每个硼原子与4个氮原子形成4个σ键,因此为sp3杂化,根据其存在的环境可知反应条件为高温高压;(5)在1 mol NH4BF4中含有1 mol N→H和1 mol B←F键。 答案:(1)1s22s22p1 (2)bc (3)平面三角形 层状结构中没有自由移动的电子 (4)sp3 高温高压 (5)2 B组 1.下列关于原子晶体和分子晶体的说法不正确的是( ) A.原子晶体硬度通常比分子晶体大 B.原子晶体的熔沸点较高 C.分子晶体中有的水溶液能导电 D.金刚石、水晶和干冰都属于原子晶体 解析:由于原子晶体中粒子间以共价键结合,而分子晶体中分子间以分子间作用力结合,故原子晶体比分子晶体的熔沸点高,硬度大。有些分子晶体溶于水后能电离出自由移动的离子而导电,如H2SO4、HCl。D选项中的干冰(CO2)是分子晶体,错误。 答案:D 2.下列说法中正确的是( ) A.熔点由高到低的顺序是:金刚石>晶体硅>碳化硅 B.PCl3和BCl3分子中所有原子的最外层都达到了8电子稳定结构 C.分子晶体的熔、沸点低,常温下均呈液态或气态 D.原子晶体中的各相邻原子都以共价键相结合 解析:A项,三种物质均为原子晶体,原子晶体的熔点与该晶体中的键长有关,键长越短,熔点越高,则熔点由高到低的顺序是:金刚石>碳化硅>晶体硅,故错误;B项,根据|元素的化合价|+原子的最外层电子数=8,则该原子的最外层达到8个电子的稳定结构,BCl3中B的最外层电子数为3,化合价为+3价,因此B未达到8个电子的稳定结构,故错误;C项,分子晶体的熔、沸点很低,但在常温下也有呈固态的,如白磷,故错误。 答案:D 3.下列晶体性质的比较中,正确的是( ) A.熔点:单质硫>磷>晶体硅 B.沸点:NH3>H2O>HF C.硬度:白磷>冰>二氧化硅 D.熔点:SiI4>SiBr4>SiCl4 解析:硫与磷是分子晶体,晶体硅是原子晶体,其中晶体硅的熔点远高于硫与磷的熔点,A项错误;氟化氢、水、氨都是分子晶体,其沸点高低与分子间作用力大小有关,因为这三种物质之中都存在氢键,且水分子间氢键最强,氨分子间氢键最弱,故水的沸点最高,氨的最低,B项错误;二氧化硅是原子晶体,硬度大,白磷和冰都是分子晶体,硬度较小,C项错误;卤化硅为分子晶体,它们的组成和结构相似,分子间不存在氢键,故相对分子质量越大,熔点越高,D项正确。 答案:D 4.下图为冰晶体的结构模型,大球代表O,小球代表H。下列有关说法正确的是( ) A.冰晶体中每个水分子与另外四个水分子形成四面体 B.冰晶体具有空间网状结构,是原子晶体 C.水分子间通过H—O键形成冰晶体 D.冰融化时,水分子之间空隙增大 解析:冰中的水分子是靠氢键结合在一起,氢键不是化学键,而是一种分子间作用力,故B、C两项均错误。H2O分子形成氢键时沿O的四个sp3杂化轨道形成氢键,可以与4个水分子形成氢键,这4个水分子形成空间四面体构型,A项正确。水分子靠氢键连接后,分子间空隙变大,因此融化时,水的体积缩小,D项错误。 答案:A 5.科学家成功地在高压下将CO2转化为具有类似SiO2结构的原子晶体,下列关于CO2的原子晶体说法正确的是( ) A.CO2的原子晶体和分子晶体互为同素异形体 B.在一定条件下,CO2原子晶体转化为分子晶体是物理变化 C.CO2的原子晶体和CO2的分子晶体具有相同的物理性质 D.在CO2的原子晶体中,每个C原子周围结合4个O,每个O与2个C相结合 解析:同素异形体的研究对象是单质;CO2的晶体类型的转变已生成了新物质,故为化学变化;CO2的不同晶体具有不同的物理性质;CO2晶体类似于SiO2晶体,属原子晶体,每个C结合4个O,每个O结合2个C。 答案:D 6.(2014浙江理综)如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22。下列说法正确的是( ) X Y W Z T A.X、Y、Z三种元素最低价氢化物的沸点依次升高 B.由X、Y和氢三种元素形成的化合物中只有共价键 C.物质WY2、W3X4、WZ4均有熔点高、硬度大的特性 D.T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ4 解析:由于W、X、Y、Z为短周期元素,结合题表不难看出X、Y位于第2周期,W、Z位于第3周期,T位于第4周期。设W最外层电子数为x,则X、Y、Z最外层分别有x+1、x+2、x+3个电子,由题意知x+x+1+x+2+x+3=22,解得x=4。结合所在周期即可判断W、X、Y、Z、T依次为Si、N、O、Cl、Ge。 A项,X、Y、Z对应的最低价氢化物依次为NH3、H2O、HCl,只有HCl不存在氢键,故HCl沸点最低,错误;B项,X、Y和氢形成的化合物NH4NO3中含有离子键,故B错误;C项,WY2、W3X4、WZ4对应物质分别为SiO2、Si3N4、SiCl4,其中SiCl4为分子晶体,其熔点低、硬度小,C错误。 答案:D 7.(2014海南化学)碳元素的单质有多种形式,下图依次是C60、石墨和金刚石的结构图: 回答下列问题: (1)金刚石、石墨、C60、碳纳米管等都是碳元素的单质形式,它们互为 。 (2)金刚石、石墨烯(指单层石墨)中碳原子的杂化形式分别为 、 。 (3)C60属于 晶体,石墨属于 晶体。 (4)石墨晶体中,层内C—C键的键长为142 pm,而金刚石中C—C键的键长为154 pm。其原因是金刚石中只存在C—C间的 共价键,而石墨层内的C—C间不仅存在 共价键,还有 键。 (5)金刚石晶胞含有 个碳原子。若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,则r= a,列式表示碳原子在晶胞中的空间占有率 (不要求计算结果)。 解析:(1)金刚石、石墨、C60、碳纳米管等都是碳元素的单质形式,它们的组成相同,结构不同、性质不同,互称为同素异形体; (2)金刚石中碳原子与四个碳原子形成4个共价单键(即C原子采取sp3杂化方式),构成正四面体,石墨中的碳原子用sp2杂化轨道与相邻的三个碳原子以σ键结合,形成正六角形的平面层状结构; (3)C60中构成微粒是分子,所以属于分子晶体;石墨的层内原子间以共价键结合,层与层之间以分子间作用力结合,所以石墨属于混合晶体; (4)在金刚石中只存在C—C之间的σ键;石墨层内的C—C之间不仅存在σ键,还存在π键; (5)由金刚石的晶胞结构可知,晶胞内部有4个C原子,面心上有6个C原子,顶点有8个C原子,所以金刚石晶胞中C原子数目为4+6×+8×=8;若C原子半径为r,金刚石的边长为a,根据硬球接触模型,则正方体对角线长度的就是C—C键的键长,即a=2r,所以r=a,碳原子在晶胞中的空间占有率= 。 答案:(1)同素异形体 (2)sp3 sp2 (3)分子 混合 (4)σ σ π(或大π或p-pπ) (5)8 8.硅是重要的半导体材料,构成了现代电子工业的基础。回答下列问题: (1)基态Si原子中,电子占据的最高能层符号为 ,该能层具有的原子轨道数为 、电子数为 。 (2)硅主要以硅酸盐、 等化合物的形式存在于地壳中。 (3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以 相结合,其晶胞中共有8个原子,其中在面心位置贡献 个原子。 (4)单质硅可通过甲硅烷(SiH4)分解反应来制备。工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为 。 (5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实: 化学键 C—C C—H C—O Si—Si Si—H Si—O 356 413 336 226 318 452 ①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是 。 ②SiH4的稳定性小于CH4,更易生成氧化物,原因是 。 (6)在硅酸盐中,Si四面体[如下图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为 ,Si与O的原子数之比为 ,化学式为 。 图(a) 图(b) 解析:硅的核外电子排布式为1s22s22p63s23p2,M能层有s、p、d三个能级,共9个原子轨道;(3)立方体共有6个面,面心位置上贡献3个原子;(4)此反应不属于氧化还原反应,产物除SiH4外,还应有MgCl2,另一生成物只能是NH3;(5)由信息可知应从反应物、产物键能的差异角度进行分析;(6)一个硅原子与四个氧原子相连,形成4个σ键,硅原子最外层四个电子全部参与成键,无孤电子对,为sp3杂化;①②两个氧原子有两个结构单元共用,如图,中间的结构单元均摊1,再加上其他2个氧原子,一个结构单元中含有一个硅原子、3个氧原子,依据化合价可知一个结构单元表现的化合价为-2,即化学式为Si或[SiO3。 答案:(1)M 9 4 (2)二氧化硅 (3)共价键 3 (4)Mg2Si+4NH4ClSiH4+4NH3+2MgCl2 (5)①C—C键和C—H键较强,所形成的烷烃稳定。而硅烷中Si—Si键和Si—H键的键能较低,易断裂,导致长链硅烷难以生成 ②C—H键的键能大于C—O键,C—H键比C—O键稳定。而Si—H键的键能却远小于Si—O键,所以Si—H键不稳定而倾向于形成稳定性更强的Si—O键 (6)sp3 1∶3 [SiO3(或Si)查看更多