- 2021-04-20 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020版高中化学 第三章第2节 几种重要的金属化合物 课时1 钠的重要化合物学案 新人教版必修1
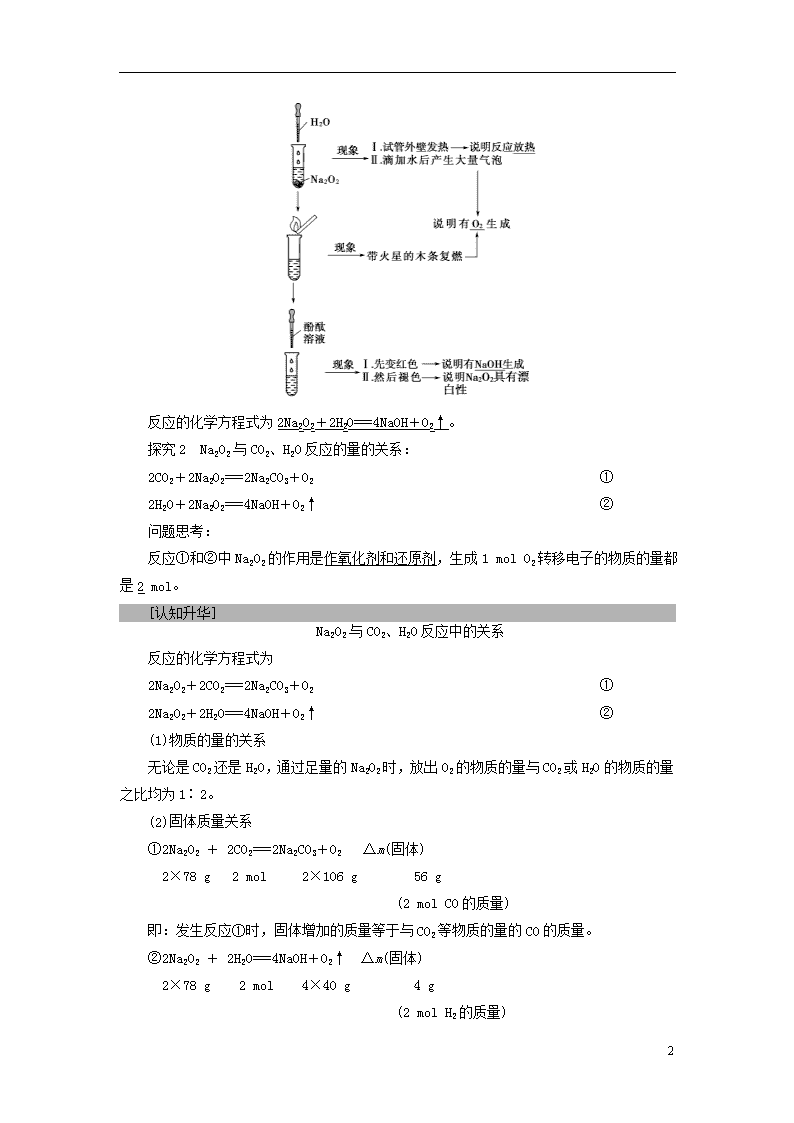
课时1 钠的重要化合物 1.了解氧化钠、过氧化钠的主要性质和用途。(重点) 2.掌握Na2CO3、NaHCO3的主要性质和用途。(重点) 3.了解焰色反应的概念及应用。 钠的氧化物 [基础·初探] 1.氧化钠 (1)物理性质 颜色:白色;状态:固体。 (2)化学性质 氧化钠是碱性氧化物,能与水、酸性氧化物、酸等发生反应。 有关的化学方程式: 2.过氧化钠 (1)物理性质 颜色:淡黄色;状态:固体。 (2)化学性质 ①与水反应的化学方程式为2Na2O2+2H2O===4NaOH+O2↑。 ②与二氧化碳反应的化学方程式为2Na2O2+2CO2===2Na2CO3+O2。 [探究·升华] [思考探究] 探究1 Na2O2与H2O反应的实验探究 9 反应的化学方程式为2Na2O2+2H2O===4NaOH+O2↑。 探究2 Na2O2与CO2、H2O反应的量的关系: 2CO2+2Na2O2===2Na2CO3+O2 ① 2H2O+2Na2O2===4NaOH+O2↑ ② 问题思考: 反应①和②中Na2O2的作用是作氧化剂和还原剂,生成1 mol O2转移电子的物质的量都是2 mol。 [认知升华] Na2O2与CO2、H2O反应中的关系 反应的化学方程式为 2Na2O2+2CO2===2Na2CO3+O2 ① 2Na2O2+2H2O===4NaOH+O2↑ ② (1)物质的量的关系 无论是CO2还是H2O,通过足量的Na2O2时,放出O2的物质的量与CO2或H2O的物质的量之比均为1∶2。 (2)固体质量关系 ①2Na2O2 + 2CO2===2Na2CO3+O2 Δm(固体) 2×78 g 2 mol 2×106 g 56 g (2 mol CO的质量) 即:发生反应①时,固体增加的质量等于与CO2等物质的量的CO的质量。 ②2Na2O2 + 2H2O===4NaOH+O2↑ Δm(固体) 2×78 g 2 mol 4×40 g 4 g (2 mol H2的质量) 9 即:发生反应②时,固体增加的质量等于与H2O等物质的量的H2的质量。 (3)电子转移关系 在Na2O2与CO2或H2O的反应中,Na2O2既是氧化剂又是还原剂,每生成1 mol O2都转移2 mol电子。 [题组·冲关] 题组1 钠的氧化物的性质及其应用 1.下列关于氧化钠和过氧化钠的叙述中,正确的是( ) A.都属于碱性氧化物 B.都能与水发生化合反应 C.水溶液的成分相同 D.与二氧化碳反应生成不同的盐 【解析】 Na2O2不属于碱性氧化物;Na2O2与H2O发生的反应不属于化合反应;Na2O、Na2O2与CO2反应均生成Na2CO3这一种盐。 【答案】 C 2.下列关于Na2O2的叙述中正确的是( ) A.Na2O2是淡黄色固体,久置于空气中变成Na2O B.Na2O2与水的反应中,Na2O2只作氧化剂 C.Na2O2属于碱性氧化物 D.Na2O2与CO2或H2O反应,1 mol Na2O2参加反应,转移1 mol电子 【解析】 Na2O2久置于空气中变成Na2CO3;Na2O2与水反应时,Na2O2既是氧化剂又是还原剂;Na2O2属于过氧化物,而不属于碱性氧化物;Na2O2与CO2反应的电子转移情况为 ,由此可知,D正确。 【答案】 D 题组2 Na2O2与H2O、CO2反应的数量关系及应用 3.把16 g甲烷(CH4)在64 g氧气中完全燃烧后的产物通入足量的过氧化钠后,过氧化钠增加的质量为( ) A.48 g B.16 g C.80 g D.32 g 【解析】 n(CH4)==1 mol,n(O2)==2 mol,甲烷燃烧发生反应:CH4+2O2CO2+2H2O,可知甲烷和氧气完全反应,生成1 mol CO2和2 mol H2O,通入过氧化钠发生反应:2Na2O2+2CO2===2Na2CO3+O2,2Na2O2+2H2O===4NaOH+O2 9 ↑,对生成物变式:Na2CO3~Na2O2·CO,2NaOH~Na2O2·H2,可知固体质量相当于增加CO和H2的质量,由1 mol甲烷可看成n(CO)=1 mol,n(H2)=2 mol,总质量为28 g+4 g=32 g,故过氧化钠增加的质量为32 g。 【答案】 D 4.1 mol过氧化钠与2 mol碳酸氢钠固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体物质是( ) A.Na2CO3 B.Na2O2、Na2CO3 C.NaOH、Na2CO3 D.Na2O2、NaOH、Na2CO3 【解析】 Na2O2与NaHCO3的混合物受热分解时,首先是NaHCO3分解: 2NaHCO3Na2CO3+H2O+CO2↑ 2 mol 1 mol 1 mol 1 mol 产生的CO2与H2O均可与Na2O2反应,由于Na2O2与H2O反应生成NaOH,而NaOH又可与CO2反应生成H2O,故可以认为是CO2先与Na2O2反应,CO2耗尽后H2O才开始反应,而根据2Na2O2+2CO2===2Na2CO3+O2可知,生成的1mol CO2恰好与1 mol Na2O2完全反应生成Na2CO3,H2O不会再与Na2O2反应,故最终固体产物只有Na2CO3。 【答案】 A 【题后归纳】 先后顺序关系 密闭容器中一定量的Na2O2与一定量CO2和H2O(g)的混合物的反应,可视作Na2O2先与CO2反应,待CO2反应完全后,Na2O2再与H2O发生反应(实际情况复杂得多)。 碳酸钠和碳酸氢钠 [基础·初探] 1.物理性质 名称 碳酸钠 碳酸氢钠 化学式 Na2CO3 NaHCO3 俗名 纯碱、苏打 小苏打 色态 白色粉末 细小白色晶体 溶解性 水中易溶 水中易溶,但比Na2CO3溶解度小 2.化学性质 (1)热稳定性 ①Na2CO3较稳定,受热难分解,但碳酸钠晶体(Na2CO3·xH2O)易风化。 9 ②NaHCO3不稳定,受热易分解,反应的化学方程式为2NaHCO3 Na2CO3+CO2↑+H2O。 (2)与酸(足量盐酸)反应(写化学方程式,下同) ①Na2CO3:Na2CO3+2HCl===2NaCl+CO2↑+H2O。 ②NaHCO3:NaHCO3+HCl===NaCl+CO2↑+H2O。 (3)与碱(氢氧化钠)反应 ①Na2CO3与NaOH不反应。 ②NaHCO3:NaHCO3+NaOH===Na2CO3+H2O。 3.用途 (1)碳酸钠:重要的化工原料,在玻璃、肥皂、合成洗涤剂、造纸、纺织、石油等方面有广泛的应用。 (2)碳酸氢钠:是发酵粉的主要成分,可以做治疗胃酸过多的药剂。 [探究·升华] [思考探究] 碳酸钠与碳酸氢钠的性质 实验一、观察碳酸钠和碳酸氢钠的溶解性 ①在两支试管里分别加入少量Na2CO3和NaHCO3(各约1 g),观察二者外观上的细小差别。分别滴入几滴水,振荡试管。 ②继续向试管内加入10 mL水,用力振荡。 ③向试管内滴入1~2滴酚酞溶液。 实验二、观察碳酸钠和碳酸氢钠的热稳定性 如图所示,分别用Na2CO3和NaHCO3做实验,观察现象。这一反应可以用来鉴别Na2CO3和NaHCO3。 鉴别碳酸钠和碳酸氢钠 实验三、观察碳酸钠和碳酸氢钠与盐酸的反应 9 问题思考: (1)Na2CO3与NaHCO3相比,溶解性、热稳定性有何不同?Na2CO3、NaHCO3固体与等浓度等体积足量盐酸反应时现象有何异同? 【提示】 (1)Na2CO3与NaHCO3相比,Na2CO3的溶解性、热稳定性均比NaHCO3的强;二者均可以与盐酸反应生成二氧化碳气体,当二者均与等浓度等体积的盐酸反应时,NaHCO3产生二氧化碳的速率快,反应更剧烈。 (2)能否用石灰水鉴别NaHCO3和Na2CO3溶液?为什么? 【提示】 否,二者均生成沉淀。 (3)Na2CO3与NaHCO3的相互转化条件如何? 【提示】 [认知升华] 升华1 碳酸钠与碳酸氢钠的性质比较 (1)两点相似 ①均能与酸反应生成CO2气体; ②均能与澄清石灰水反应生成CaCO3白色沉淀。 (2)四点不同 ①在水中的溶解度不同:Na2CO3>NaHCO3; ②与酸反应的速率不同:NaHCO3>Na2CO3; ③热稳定性不同:Na2CO3>NaHCO3; ④与CaCl2溶液反应的现象不同:Na2CO3有白色沉淀生成。 升华2 Na2CO3和NaHCO3的鉴别、除杂质 (1)碳酸钠与碳酸氢钠的鉴别方法 (2)除杂质 混合物(括号内为杂质) 除杂质方法及试剂 9 Na2CO3固体(NaHCO3) 加热 NaHCO3溶液(Na2CO3) 通入足量CO2气体 Na2CO3溶液(NaHCO3) 加入适量NaOH溶液 [题组·冲关] 题组1 Na2CO3、NaHCO3的主要性质 1.下列说法不正确的是( ) A.Na2CO3比NaHCO3的溶解度大 B.Na2CO3比NaHCO3稳定 C.Na2CO3和NaHCO3都能跟石灰水反应得到白色沉淀 D.物质的量相等的Na2CO3和NaHCO3分别与足量盐酸反应得CO2的物质的量之比为2∶1 【解析】 D项中生成的CO2的量相同。 【答案】 D 2.关于Na2CO3和NaHCO3的说法正确的是( ) A.向两者的溶液中加入BaCl2均生成白色沉淀 B.向两者的溶液中逐滴加入稀盐酸,反应现象完全相同 C.Na2CO3和NaHCO3两物质之间可以相互转化 D.向饱和的Na2CO3溶液中通入足量的CO2气体,观察不到任何实验现象 【解析】 A项,NaHCO3与BaCl2不反应;B项,Na2CO3溶液中逐滴加入盐酸开始无气体,NaHCO3溶液中滴加盐酸,开始就产生气体;D项,向饱和的Na2CO3溶液中通入足量的CO2气体,反应生成的NaHCO3会以沉淀的形式析出。原因有三:①生成的NaHCO3相对于Na2CO3来说溶解度更小;②反应后生成的NaHCO3质量大于Na2CO3的质量(溶质质量增加);③反应中要消耗一部分水(溶剂减少)。综合以上三点,向饱和的Na2CO3溶液中通入足量的CO2气体的化学方程式是Na2CO3+CO2+H2O===2NaHCO3↓,因此可观察到有晶体析出。 【答案】 C 题组2 Na2CO3和NaHCO3的有关鉴别与除杂 3.纯碱和小苏打都是白色晶体,在日常生活中都可以找到。若要在家中将它们区分开来,下面的方法中可行的是( ) A.分别放在炒锅中加热,观察是否有残留物 B.分别用干净铁丝蘸取样品在煤气炉的火焰上灼烧,观察火焰颜色 C.将样品溶解,分别加入澄清石灰水,观察是否有白色沉淀 D.在水杯中各盛相同质量的样品,分别加入等体积的白醋,观察反应的剧烈程度 【解析】 NaHCO3与酸反应比Na2CO3与酸反应剧烈。 【答案】 D 4.除去NaHCO3溶液中混有的少量Na2CO3可采取的方法是( ) A.通入二氧化碳气体 B.加入氢氧化钡溶液 9 C.加入澄清石灰水 D.加入稀盐酸 【解析】 A项,因为CO2能和Na2CO3溶液发生如下反应:Na2CO3+CO2+H2O===2NaHCO3,故可用来除去NaHCO3溶液中混有的少量Na2CO3。而Ba(OH)2、Ca(OH)2和盐酸都能和NaHCO3、Na2CO3反应。 【答案】 A 【题后归纳】 (1)NaHCO3固体受热易分解,但在溶液中NaHCO3受热不分解。 (2)Na2CO3固体性质稳定,在空气中不与CO2反应,但在溶液中,Na2CO3可以与水、CO2反应生成NaHCO3。 (3)碳酸钠溶液与盐酸反应分两步,第一步:CO+H+===HCO,第二步:HCO+H+===CO2↑+H2O。 (4)不能用氢氧化钙溶液鉴别碳酸钠和碳酸氢钠溶液,因为二者均能与氢氧化钙反应产生白色沉淀。 焰色反应 [基础·初探] 1.焰色反应 很多金属或它们的化合物在灼烧时都会使火焰呈现特殊的颜色。 2.操作步骤 3.几种金属的焰色 钠:黄色,钾:紫色(观察时要透过蓝色钴玻璃)。 4.应用 (1)焰色反应在化学上常用于金属单质或其离子的鉴别。 (2)利用焰色反应制节日烟花。 【特别提醒】 焰色反应的三点提醒 (1)焰色反应没有新物质生成,仅仅是电子能级跃迁的结果,故其为物理变化。 (2)金属丝在使用前用稀盐酸将其表面的氧化物洗净,然后在火焰上灼烧至无焰色,以除去能引起焰色反应的杂质。 9 (3)焰色反应的作用:鉴别钠、钾等金属或其他离子,只能判断是某种元素,而不能进一步确定是单质原子还是离子。 [题组·冲关] 1.绚丽的焰火将上海世博会开幕式推向了高潮。焰火与“焰色反应”知识有关。下列有关“焰色反应”的说法中正确的是( ) A.做焰色反应实验时,用H2SO4清洗铂丝 B.焰色反应是单质特有的性质 C.焰色反应是化学变化 D.透过蓝色钴玻璃观察,KCl与K2SO4灼烧时火焰颜色均为紫色 【解析】 洗涤铂丝应用盐酸而不能用硫酸,因为金属氯化物易挥发,A错;焰色反应是元素的性质,其游离态和化合态焰色反应是相同的,且属于物理变化,B、C项错误,D项正确。 【答案】 D 2.小明同学用洁净的铂丝蘸取某无色溶液,在无色火焰上灼烧,火焰呈黄色,通过该实验现象,下列四位同学对该溶液中存在的金属离子的判断正确的是( ) 【解析】 钠的焰色反应为黄色,钾的焰色反应为紫色,观察钾的焰色时必须透过蓝色钴玻璃以排除钠的黄色光的干扰。题目中只能确定有Na+,而不能确定K+的有无。 【答案】 D 9查看更多