- 2021-04-20 发布 |
- 37.5 KB |
- 3页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高中化学鲁科版选修3课后练习:2-3-2 配位键、金属键
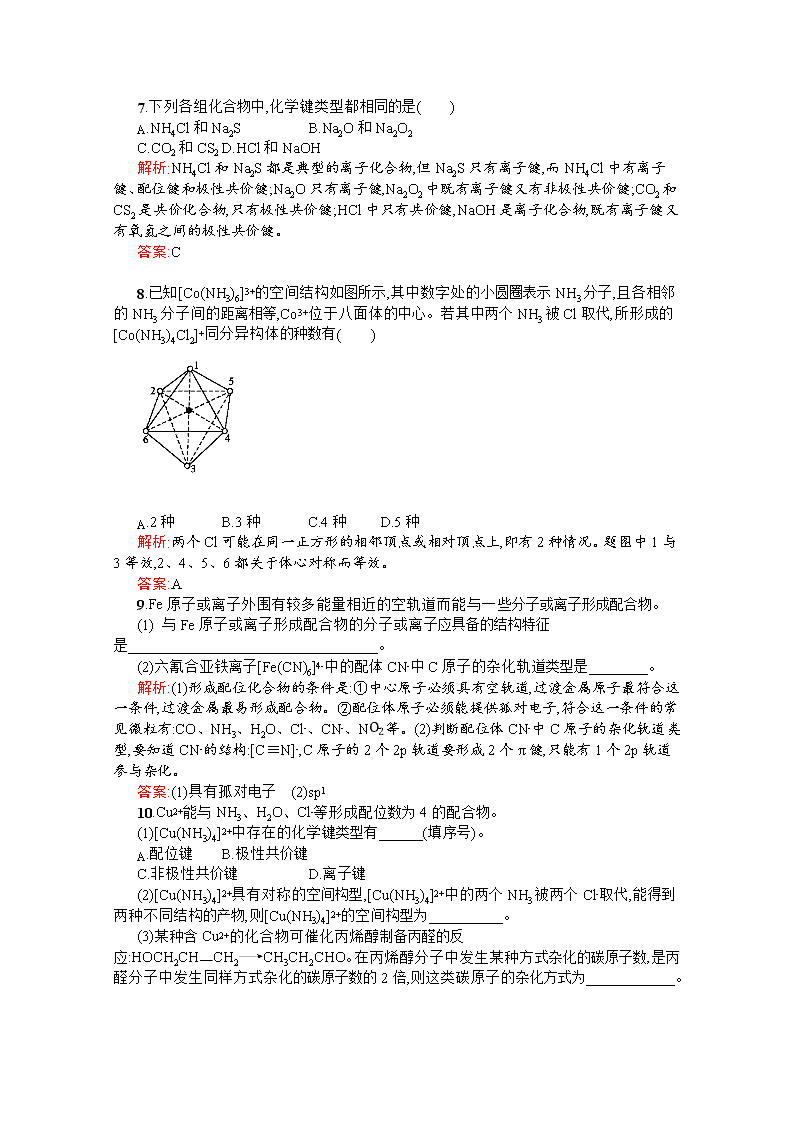
www.ks5u.com 第2课时 配位键、金属键 一、非标准 1.下列关于配位化合物的叙述中不正确的是( ) A.配位化合物中必定存在配位键 B.配位化合物中只有配位键 C.[Cu(H2O)6]2+中的Cu2+提供空轨道,H2O中的氧原子提供孤对电子形成配位键 D.配位化合物在半导体等尖端技术、医学科学、催化反应和材料化学等领域都有着广泛的应用 解析:配位化合物中一定含有配位键,但也可能含有其他化学键;Cu2+有空轨道,H2O中氧原子有孤对电子,可以形成配位键;配位化合物应用领域特别广泛,D选项中提到的几个领域都在其中。 答案:B 2.在[Fe(CN)6]3-配离子中,中心离子的配位数为( ) A.3 B.4 C.5 D.6 解析:配位数是指直接与中心原子(离子)配位的配位原子的数目,配离子[Fe(CN)6]3-的配位数为6。 答案:D 3.下列分子或离子中,能提供孤对电子与某些金属离子形成配位键的是( ) ①H2O ②NH3 ③F- ④CN- ⑤CO A.①② B.①②③ C.④⑤ D.①②③④⑤ 解析:①中的O,②中的N,③中的F,④中的C、N,⑤中的C、O均能提供孤对电子与某些金属离子形成配位键。 答案:D 4.已知Zn2+的4s和4p轨道可以形成sp3型杂化轨道,那么[ZnCl4]2-的空间构型为( ) A.直线形 B.平面正方形 C.正四面体形 D.正八面体形 解析:本题考查杂化轨道类型与配合物的空间构型的关系。Zn2+的4s和4p轨道形成的4个sp3杂化轨道,与4个Cl-形成4个配位键,所以[ZnCl4]2-的空间构型为正四面体形,选C。 答案:C 5.下列生活中的问题,不能用金属键知识解释的是( ) A.用铁制品做炊具 B.用金属铝制成导线 C.用铂金做首饰 D.铁易生锈 解析:铁制品做炊具,是因为金属有延展性、导热性;铝做导线是因为有导电性;铂金制做首饰是利用金属的延展性。以上均与金属键有关。而铁易生锈与铁的性质及周围介质有关。 答案:D 6.金属能导电的原因是( ) A.金属晶体中金属阳离子与自由电子间的相互作用较弱 B.金属晶体中的自由电子在外加电场作用下发生定向移动 C.金属晶体中的金属阳离子在外加电场作用下可发生定向移动 D.金属晶体在外加电场作用下可失去电子 解析:金属晶体中的自由电子,在外加电场作用下,沿导线定向移动而形成电流。 答案:B 7.下列各组化合物中,化学键类型都相同的是( ) A.NH4Cl和Na2S B.Na2O和Na2O2 C.CO2和CS2 D.HCl和NaOH 解析:NH4Cl和Na2S都是典型的离子化合物,但Na2S只有离子键,而NH4Cl中有离子键、配位键和极性共价键;Na2O只有离子键,Na2O2中既有离子键又有非极性共价键;CO2和CS2是共价化合物,只有极性共价键;HCl中只有共价键,NaOH是离子化合物,既有离子键又有氧氢之间的极性共价键。 答案:C 8.已知[Co(NH3)6]3+的空间结构如图所示,其中数字处的小圆圈表示NH3分子,且各相邻的NH3分子间的距离相等,Co3+位于八面体的中心。若其中两个NH3被Cl取代,所形成的[Co(NH3)4Cl2]+同分异构体的种数有( ) A.2种 B.3种 C.4种 D.5种 解析:两个Cl可能在同一正方形的相邻顶点或相对顶点上,即有2种情况。题图中1与3等效,2、4、5、6都关于体心对称而等效。 答案:A 9.Fe原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物。 (1) 与Fe原子或离子形成配合物的分子或离子应具备的结构特征是 。 (2)六氰合亚铁离子[Fe(CN)6]4-中的配体CN-中C原子的杂化轨道类型是 。 解析:(1)形成配位化合物的条件是:①中心原子必须具有空轨道,过渡金属原子最符合这一条件,过渡金属最易形成配合物。②配位体原子必须能提供孤对电子,符合这一条件的常见微粒有:CO、NH3、H2O、Cl-、CN-、NO2-等。(2)判断配位体CN-中C原子的杂化轨道类型,要知道CN-的结构:[C≡N]-,C原子的2个2p轨道要形成2个π键,只能有1个2p轨道参与杂化。 答案:(1)具有孤对电子 (2)sp1 10.Cu2+能与NH3、H2O、Cl-等形成配位数为4的配合物。 (1)[Cu(NH3)4]2+中存在的化学键类型有 (填序号)。 A.配位键 B.极性共价键 C.非极性共价键 D.离子键 (2)[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为 。 (3)某种含Cu2+的化合物可催化丙烯醇制备丙醛的反应:HOCH2CHCH2CH3CH2CHO。在丙烯醇分子中发生某种方式杂化的碳原子数,是丙醛分子中发生同样方式杂化的碳原子数的2倍,则这类碳原子的杂化方式为 。 解析:[Cu(NH3)4]2+中铜离子与氨分子之间的化学键是配位键,氨分子内部的化学键是极性键。[Cu(NH3)4]2+是平面正方形。HOCH2CHCH2中的C原子,有一个采取sp3杂化,两个采取sp2杂化。CH3CH2CHO中的C原子有两个采取sp3杂化,一个采取sp2杂化。 答案:(1)AB (2)平面正方形 (3)sp2 11.A、B、C三种均是中心原子配位数为6的不同配合物,它们的化学式都是CrCl3·6H2O,但结构不同,颜色不同:A呈亮绿色;B呈暗绿色,当B与硝酸银溶液反应时,能沉淀出13的氯元素,而C呈紫色。 (1)试写出B的结构简式。 (2)B配合物配离子的空间形状如何?画出其两种几何异构体的空间结构。 解析:分子式为CrCl3·6H2O,中心原子配位数为6的配合物,与硝酸银溶液反应,能沉淀出13的氯元素,所以只有一个Cl-在配合物的外界。 答案:(1)[Cr(H2O)4Cl2]Cl·2H2O (2)八面体,B的配离子[Cr(H2O)4Cl2]+的几何异构体: 12.已知氯化铝的熔点为190 ℃(2.02×105 Pa)但它在180 ℃即开始升华。 (1)氯化铝是 (填“离子化合物”或“共价化合物”)。 (2)在500 K和1.01×105 Pa时,它的蒸气密度(换算成标准状况时)为11.92 g·L-1,且已知它的结构中还含有配位键,氯化铝的化学式为 ,结构式为 。 (3)无水氯化铝在空气中强烈地“发烟”,其原因是 。 (4)如何通过实验来判别氯化铝是离子化合物还是共价化合物? 解析:(1)由氯化铝的熔点较低,且又易升华,说明氯化铝是共价化合物。 (2)查看更多