- 2021-04-20 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018-2019学年河南省郑州市第一中学高二上学期入学测试化学试题(word)
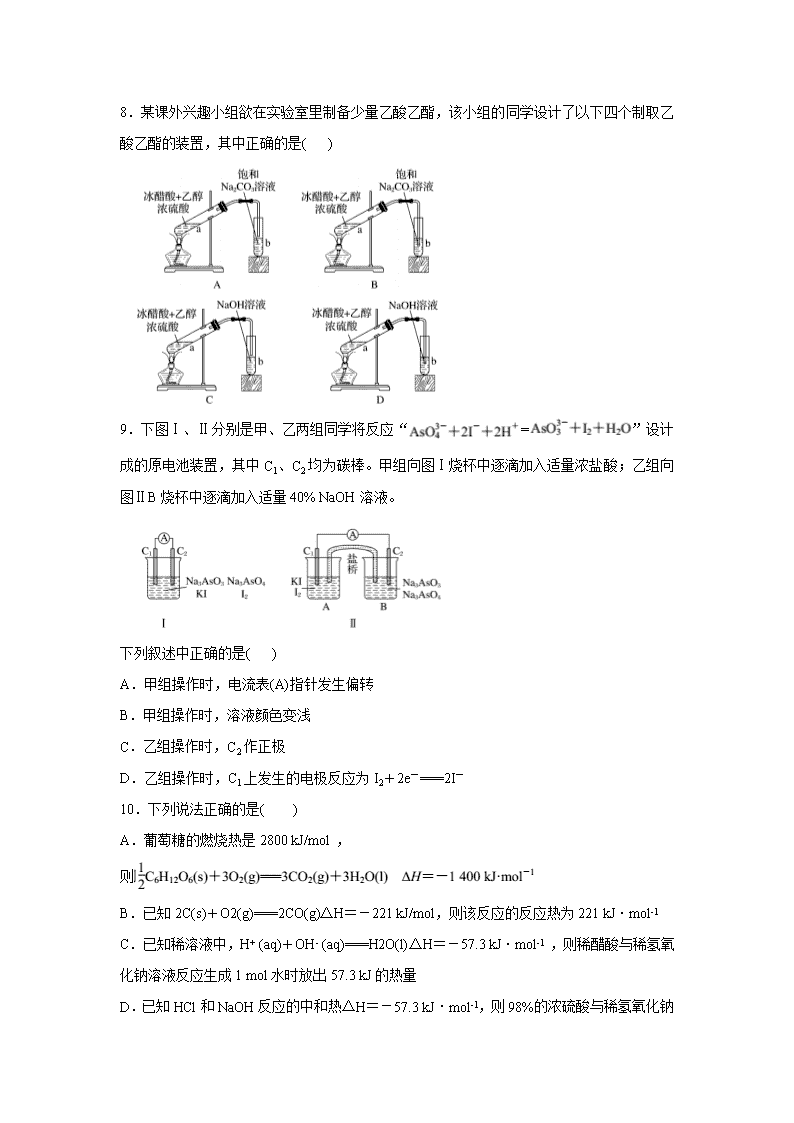
2018-2019学年河南省郑州市第一中学高二上学期入学测试(化学) 可能用到的相对原子量: H1 C12 N14 O16 Na23 Mg24 Al27 S32 Cl35.5 K39Ca40 Mn55 Fe56 Cu64 Ag108 Ba137 一、单选题(每题3分,共48分) 1.下列关于化石燃料的加工说法正确的是( ) A.石油裂化主要得到乙烯 B.石油分馏是化学变化,可得到汽油、煤油 C.煤干馏主要得到焦炭、煤焦油、粗氨水和焦炉气 D.煤制煤气是物理变化,是高效、清洁地利用煤的重要途径 2.对于工业合成氨反应,达到平衡后,以下分析正确的是( ) A.升高温度,对正反应的反应速率影响更大 B.增大压强,对正反应的反应速率影响更大 C.减小反应物浓度,对逆反应的反应速率影响更大 D.加入催化剂,对逆反应的反应速率影响更大 3.某反应由两步反应A→B→C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能)。下列有关叙述正确的是( ) A.两步反应均为吸热反应 B.加入催化剂会改变反应的焓变 C.三种化合物中C最稳定 D.A→C反应中ΔH=E1 - E2 4.在恒容密闭容器中,可以作为2NO2(g) = 2NO(g)+O2(g)达到平衡状态的标志是①单位时间内生成n mol O2的同时生成2n mol NO2;②单位时间内生成n mol O2的同时生成2n molNO;③混合气体的颜色不再改变;④混合气体的密度不再改变的状态;⑤ 混合气体的平均相对分子质量不再改变的状态;⑥混合气体中NO与O2的物质的量之比保持恒定;⑦混合气体中NO与NO2的物质的量之比保持恒定( ) A.①③⑤⑦ B.②④⑤ C.①③④ D.①②③④⑤ 5.阿斯巴甜具有清爽的甜味,其结构简式如图所示。下列关于阿斯巴甜的说法中,不正确的是( ) A.一定条件下可以发生酯化反应和加成反应 B.一定条件下既能与酸反应,又能与碱反应 C.阿斯巴甜属于糖类化合物 D.在酸性条件下可以水解生成两种氨基酸 6.已知:C(s)+O2(g)===CO2(g) ΔH1 CO2(g)+C(s)===2CO(g) ΔH2 2CO(g)+O2(g)===2CO2(g) ΔH3 2Cu(s)+O2(g)===2CuO(s) ΔH4 CO(g)+CuO(s)===CO2(g)+Cu(s) ΔH5 下列关于上述反应焓变的判断正确的是( ) A.ΔH1>0,ΔH3<0 B.ΔH2<0,ΔH4>0 C.ΔH2=ΔH1-ΔH3 D.ΔH3=ΔH4+ΔH1 7.下列与金属腐蚀有关的说法正确的是( ) A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重 B.图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小 C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大 D.图d中,钢铁轮船外壳连接一块金属A(铜块)可以减缓船体外壳腐蚀速度 8.某课外兴趣小组欲在实验室里制备少量乙酸乙酯,该小组的同学设计了以下四个制取乙酸乙酯的装置,其中正确的是( ) 9.下图Ⅰ、Ⅱ分别是甲、乙两组同学将反应“=”设计成的原电池装置,其中C1、C2均为碳棒。甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40% NaOH溶液。 下列叙述中正确的是( ) A.甲组操作时,电流表(A)指针发生偏转 B.甲组操作时,溶液颜色变浅 C.乙组操作时,C2作正极 D.乙组操作时,C1上发生的电极反应为I2+2e-===2I- 10.下列说法正确的是( ) A.葡萄糖的燃烧热是2800 kJ/mol , 则 B.已知2C(s)+O2(g)===2CO(g)ΔH=-221 kJ/mol,则该反应的反应热为221 kJ·mol-1 C.已知稀溶液中,H+ (aq)+OH- (aq)===H2O(l)ΔH=-57.3 kJ·mol-1 ,则稀醋酸与稀氢氧化钠溶液反应生成1 mol水时放出57.3 kJ的热量 D.已知HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则98%的浓硫酸与稀氢氧化钠 溶液反应生成1 mol水的中和热为-57.3 kJ·mol-1 11.下列有关电化学的图示,完全正确的是( ) 12.分子式为C5H10O2并能与饱和NaHCO3溶液反应放出气体的有机物有 ( ) A.3种 B.4种 C.5种 D.6种 13.我国科学家报道了如图所示的水溶液锂离子电池体系。下列叙述错误的是( ) A.a为电池的正极 B.电池充电反应为 C.放电时,a极锂的化合价发生变化 D.放电时,溶液中Li+从b向a迁移 14.如图所示,a、b、c均为非金属单质,d、e均为含有10个电子的共价化合物,且分子中所含原子个数:d>e,f为离子化合物。则下列说法错误的是( ) A.常温下,单质a呈气态 B.单质c具有强氧化性 C.稳定性:d>e D.f受热易分解为d和e 15.可逆反应mA(g)+nB(g) = pC(g)+qD(g)的v-t图像如图甲所示,若其他条件都不变,只是在反应前加入合适的催化剂,则其v-t图像如图乙所示。①a1=a2 ②a1<a2 ③ b1=b2 ④b1<b2 ⑤t1>t2⑥t1=t2 ⑦两图中阴影部分面积相等 ⑧图乙中阴影部分面积更大。以上所述正确的为( ) A.②④⑤⑦ B.②④⑥⑧ C.②③⑤⑦ D.②③⑥⑧ 16.微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是( ) A.正极反应中有CO2生成 B.微生物促进了反应中电子的转移 C.质子通过交换膜从负极区移向正极区 D.电池总反应为C6H12O6+6O2===6CO2+6H2O 二、填空题(共52分) 17.(共6分)A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的原子半径最小;B元素的最高价氧化物对应水化物与其氢化物能生成盐;D与A同主族,且与E同周期;E元素原子的最外层电子数是其次外层电子数的,A、B、D、E这四种元素, 每一种与C元素都能形成原子个数比不相同的若干种化合物。请回答下列问题: (1)B单质的电子式是________。 (2)A、B、C、E可形成两种酸式盐(均由四种元素组成),两种酸式盐相互反应的离子方程式为___________________。 (3)A、C、E间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为______________________。 18.(共6分)氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。完成下列填空: (1)写出电解饱和食盐水的离子方程式________________。 (2)离子交换膜的作用为____________________。 (3)精制饱和食盐水从图中________位置补充,氢氧化钠溶液从图中________位置流出。(选填“a”、“b”、“c”或“d”) 19.(共14分)在一密闭容器中发生反应N2+3H2 = 2NH3,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示。 回答下列问题: (1)处于平衡状态的时间段是________(填选项)。 A.t0~t1 B.t1~t2 C.t2~t3 D.t3~t4 E.t4~t5 F.t5~t6 (2)判断t1、t3、t4时刻分别改变的一个条件。 A.增大压强 B.减小压强 C.升高温度D.降低温度 E.加催化剂 F.充入氮气t1时刻________;t3时刻________;t4时刻________。 (3)依据(2)中的结论,下列时间段中,氨的百分含量最高的是__________。 A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6 (4)如果在t6时刻,从反应体系中分离出部分氨,t7时刻反应达到平衡状态,请在图中画出反应速率的变化曲线。 (5)一定条件下,合成氨反应达到平衡时,测得混合气体中氨气的体积分数为 20%,则反应后与反应前的混合气体体积之比为__________。 20.(共12分)锂锰电池的体积小、性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+ 通过电解质迁移入MnO2 晶格中,生成LiMnO2。 回答下列问题: (1)外电路的电流方向是由________极流向________极。(填字母) (2)电池正极反应式为_______________________________________________。 (3)是否可用水代替电池中的混合有机溶剂?______(填“是”或“否”),原因是________________________________________________________________________。(4)MnO2可与 KOH 和 KClO3在高温下反应,生成 K2MnO4,反应的化学方程式为________________________________。K2MnO4在酸性溶液中歧化,生成KMnO4和MnO2的物质的量之比为________。 21.(共14分)根据要求完成下列实验过程(a、b为弹簧夹,加热及固定装置已略去)。 (1)验证碳、硅非金属性的相对强弱(已知酸性:亚硫酸>碳酸)。 ①连接仪器、________________、加药品后,打开a、关闭b,然后滴入浓硫酸,加热。②铜与浓硫酸反应的化学方程式是________________,装置A中试剂是_______。③能说明碳的非金属性比硅强的实验现象是_______________________。 (2)验证SO2的氧化性、还原性和酸性氧化物的通性。 ①在(1)①操作后打开b,关闭a。 ②H2S溶液中有浅黄色浑浊出现,化学方程式是____________________。 ③BaCl2溶液中无明显现象,将其分成两份,分别滴加下列溶液,将产生的沉淀的化学式填入下表相应的位置。 写出其中SO2显示还原性生成沉淀的离子方程式: ______________________。查看更多