- 2021-04-20 发布 |
- 37.5 KB |
- 4页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020九年级化学下册 第九单元 溶液 课题3 一定溶质质量分数的氯化钠溶液的配制同步练习
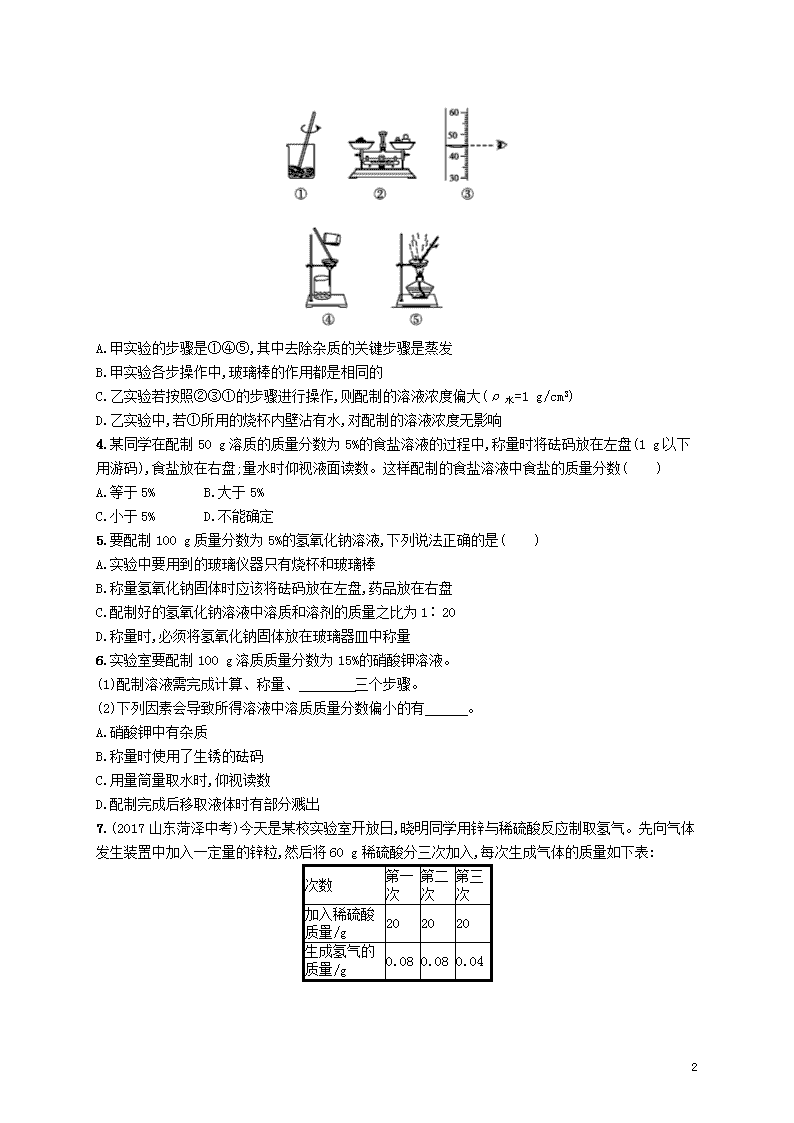
第2课时 一定溶质质量分数的氯化钠溶液的配制 知能演练提升 能力提升 1.小红在配制50 g 5%的氯化钠溶液时,进行了以下操作,其中会导致溶液中氯化钠的质量分数大于5%的是( ) A.用量筒量取水时俯视读数 B.在称量前,指针稍向左偏移便进行称量 C.装瓶时部分溶液洒出 D.溶解时烧杯中已有少量水 ★2.如果所配6%的氯化钠溶液中溶质质量分数偏小,其原因是( ) A.称取的氯化钠固体质量偏大 B.转移称量好的氯化钠固体时,有少量撒落在桌面上 C.量取水的体积偏小 D.转移配制好的溶液时,有少量液体溅出 3.用下列实验操作可完成两个实验。甲实验为粗盐中难溶性杂质的去除,乙实验为配制溶质质量分数为10%的氯化钠溶液。下列说法中正确的是( ) 4 A.甲实验的步骤是①④⑤,其中去除杂质的关键步骤是蒸发 B.甲实验各步操作中,玻璃棒的作用都是相同的 C.乙实验若按照②③①的步骤进行操作,则配制的溶液浓度偏大(ρ水=1 g/cm3) D.乙实验中,若①所用的烧杯内壁沾有水,对配制的溶液浓度无影响 4.某同学在配制50 g溶质的质量分数为5%的食盐溶液的过程中,称量时将砝码放在左盘(1 g以下用游码),食盐放在右盘;量水时仰视液面读数。这样配制的食盐溶液中食盐的质量分数( ) A.等于5% B.大于5% C.小于5% D.不能确定 5.要配制100 g质量分数为5%的氢氧化钠溶液,下列说法正确的是( ) A.实验中要用到的玻璃仪器只有烧杯和玻璃棒 B.称量氢氧化钠固体时应该将砝码放在左盘,药品放在右盘 C.配制好的氢氧化钠溶液中溶质和溶剂的质量之比为1∶20 D.称量时,必须将氢氧化钠固体放在玻璃器皿中称量 6.实验室要配制100 g溶质质量分数为15%的硝酸钾溶液。 (1)配制溶液需完成计算、称量、 三个步骤。 (2)下列因素会导致所得溶液中溶质质量分数偏小的有 。 A.硝酸钾中有杂质 B.称量时使用了生锈的砝码 C.用量筒量取水时,仰视读数 D.配制完成后移取液体时有部分溅出 7.(2017山东菏泽中考)今天是某校实验室开放日,晓明同学用锌与稀硫酸反应制取氢气。先向气体发生装置中加入一定量的锌粒,然后将60 g稀硫酸分三次加入,每次生成气体的质量如下表: 次数 第一次 第二次 第三次 加入稀硫酸质量/g 20 20 20 生成氢气的质量/g 0.08 0.08 0.04 4 试计算: (1)共制得氢气 g。 (2)实验所用稀硫酸中溶质的质量分数。(写出计算过程) 探究创新 8.如图是配制溶质质量分数为10%的NaCl溶液的实验操作示意图: (1)用图中的序号表示配制溶液的正确操作顺序 。 (2)图②中,有一种塑料仪器,其名称是 。 (3)称量NaCl时,托盘天平平衡后的状态如图⑤所示,游码标尺示数见下图,则称取的NaCl质量为 。 (4)需要量取的水的体积为 (水的密度为1 g·mL-1)。读数时,下图视线角度正确的是 (选填字母标号)。 (5)称量NaCl质量完毕放回砝码时,发现有一个砝码缺损了一个小角,若其他操作步骤正确,则所配溶液的溶质质量分数 (填“大于”“小于”或“等于”)10%。 答案:1.A 2.B 3.C 粗盐中难溶性杂质的去除实验中,去除杂质的关键步骤是过滤,A不正确。甲实验各步操作中,玻璃棒的作用都是不同的:溶解时搅拌,加速溶解;过滤时引流;蒸发时搅拌,防止局部过热造成液滴飞溅,B不正确。步骤③中,读数时,视线与液体凹液面的最高处保持水平,量取的液体体积偏小,配制溶液的浓度偏大,C项说法正确。乙实验中,若①所用的烧杯内壁沾有水,相当于增加了溶剂的质量,所配溶液浓度偏小,D不正确。 4.C 配制50 g溶质的质量分数为5%的食盐溶液需要食盐50 g×5%=2.5 g,需要水的质量是47.5 g。在称量时砝码放在左盘,食盐放在右盘,则称得的食盐的实际质量是2 g-0.5 g=1.5 g。量取水时仰视读数,则量取的水的实际体积大于47.5 mL。错误的操作造成了溶剂的质量增加,而溶质的质量减少,因此,配制的食盐溶液中食盐的质量分数要小于5%。 5.D A项,实验中要用到的玻璃仪器有烧杯和玻璃棒,还有量筒、胶头滴管,故A错;B项,称量物质时要遵循“左物右码”原则,故B错;C项,配制好的氢氧化钠溶液中溶质和溶剂的质量之比为5∶95=1∶19,故C错;D项,易潮解,具有腐蚀性的药品必须放在玻璃器皿中称量,因为氢氧化钠既易潮解,又具有腐蚀性,所以称量时,必须将氢氧化钠固体放在玻璃器皿中,故D正确。 4 6.答案 (1)溶解 (2)AC 7.答案 (1)0.2 (2)解:设20 g稀硫酸中所含有的硫酸质量为x。 Zn+H2SO4ZnSO4+H2↑ 98 2 x 0.08 g x=3.92 g 所用稀硫酸的质量分数=×100%=19.6% 答:实验所用稀硫酸中溶质的质量分数为19.6%。 8.解析 (1)配制一定溶质质量分数的溶液的步骤:计算、称量、溶解,计算得到所需NaCl的质量和水的体积后,我们首先称取NaCl,步骤为②⑤①,然后量取水,步骤为④,最后溶解,步骤为③。(2)在图②所示仪器中,药匙为塑料仪器。(3)砝码的质量为15 g,游码的质量为3.2 g,则称取的NaCl的质量为15 g+3.2 g=18.2 g。(4)要将18.2 g NaCl配制成10%的溶液,需要水的体积为=163.8 mL。量取液体时,眼睛的视线要与凹液面的最低处保持水平,故D正确。(5)若砝码缺损了一个小角,则称量的NaCl质量偏小,会导致所配溶液溶质的质量分数小于10%。 答案 (1)②⑤①④③ (2)药匙 (3)18.2 g (4)163.8 mL D (5)小于 4查看更多