- 2021-04-20 发布 |
- 37.5 KB |
- 11页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
化学卷·2019届宁夏吴忠中学高二上学期期末考试(2018
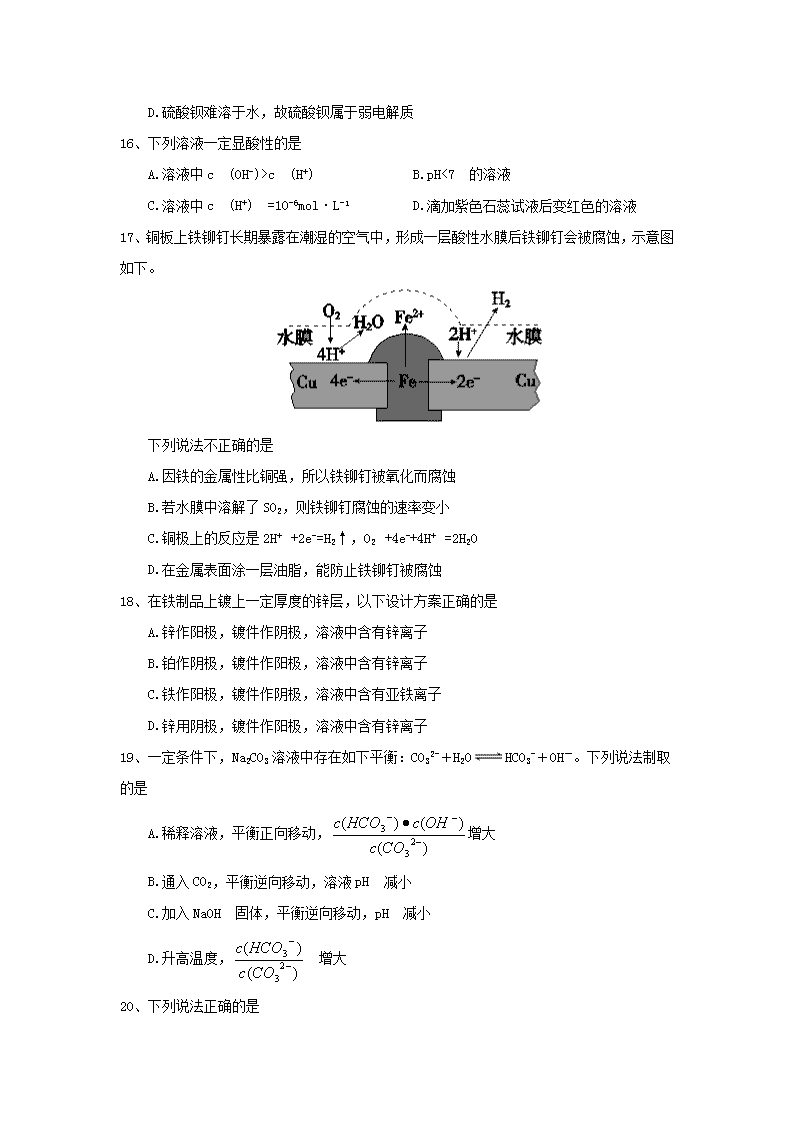
可能用到的相对原子质量: H-1 C-12 N-14 O-16 Na -23 S-32 Cl-35.5 Zn-65 Fe-56 Cu-64 一、单项选择题(每题2分,共60分) 1、下列表示物质结构的化学用语或模型正确的是 A.乙烷的分子式:CH3CH3 B.CH分子的球棍模型: C.乙醛结构简式:CH3COH D.乙烯的结构简式:CH2=CH2 2、下列说法不正确的是 A.有机物分子中一定含有一个或多个碳原子 B.有机物分子中的碳原子可以相互连接成链状或环状 C.有机物分子中的碳原子可以与其它元素的原子连接 D.分子中含有碳原子的化合物一定是有机化合物 3.有机物的分离和提纯是有机化学研究的重要内容,下列物质所用的方法不正确的是 A.酒精和水一一分液 B.淀粉溶液中混有氯化钠一一用半透膜进行渗析 C.汽油和柴油一一分馏 D.三氯甲烷和水一一分液 4、分子式为C5H12O且可与金属钠反应放出氢气的有机物有(不考虑立体异构) A.5 种 B.6 种 C.8种 D.7种 5、下列各对物质,互为同系物的是 A.CH3—CH=CH2与 B. 与 C.CH3COOCH3与CH3CH2COOCH3 D.CH3CH2Cl 与CH3CHCl—CH2Cl 6、下列有机物的命名中,正确的是 A.2,2- 二甲基丁烷 B.3,3- 二甲基丁烷 C.2- 乙基丁烷 D.2,3,3- 三甲基丁烷 7、己知二氯丁烷的同分异构体有9 种,则八氯丁烷的同分异构体有 A.9 种 B.8种 C.7种 D.10种 8、有机物分子中最多有多少个原子共面 A.18 B.19 C.20 D.21 9、在核磁共振氢谱中出现两组峰,其氢原子数之比为3∶2 的化合物是 A. B. C. D. 10、有机物,有多种同分异构体,其中属于酯且含有苯环结构的共有 A.3 B.4 C.5 D.6种 l1、下列说法正确的是 A.乙烷的一氯代物同分异构体有1种,二氯代物的同分异构体有3 种 B.正戊烷的一氯代物同分异构体有3 种,二氯代物的同分异构体有9 种 C.正丁烷的一氯代物同分异构体有2 种,二氯代物的同分异构体有5 种 D.丙烷的一氯代物同分异构体有2 种,二氯代物的同分异构体有5 种 12、某化合物6.4g在氧气中完全燃烧,只生成8.8 gCO2和7.2 gH2O。下列说法中正确的是 ①该化合物仅含碳、氢两种元素 ②该化合物中碳、氢原子个数比为1∶4 ③无法确定该化合物是否含有氧元素 ④该化合物中一定含有氧元素 A.②④ B.①② C.③④ D.②③ 13、某烃中碳和氢的质量比是24∶5,该烃在标准状况下的密度是2.59g·L-1,其分子式为 A.C2H6 B.C4H10 C.C5H8 D.C7H8 14、对于反应A2+3B2=2C来说,以下表示中,反应速率最快的是 A.v (B2)=0.8mo1/ (L·s) B.v (A2)=0.4mo1/ (L·s) C.v (C) =0.6 mol/ (L·s) D.v (B2)=1.8mo1/ (L·s) 15、下列说法中正确的是 A.二氧化硫溶于水能导电,故二氧化硫属于电解质 B.氢氧根离子浓度相同的氢氧化钠溶液和氨水导电能力相同 C.硫酸是强电解质,故纯硫酸能导电 D.硫酸钡难溶于水,故硫酸钡属于弱电解质 16、下列溶液一定显酸性的是 A.溶液中c (OH-)>c (H+) B.pH<7 的溶液 C.溶液中c (H+) =10-6mol·L-1 D.滴加紫色石蕊试液后变红色的溶液 17、铜板上铁铆钉长期暴露在潮湿的空气中,形成一层酸性水膜后铁铆钉会被腐蚀,示意图如下。 下列说法不正确的是 A.因铁的金属性比铜强,所以铁铆钉被氧化而腐蚀 B.若水膜中溶解了SO2,则铁铆钉腐蚀的速率变小 C.铜极上的反应是2H+ +2e-=H2↑,O2 +4e-+4H+ =2H2O D.在金属表面涂一层油脂,能防止铁铆钉被腐蚀 18、在铁制品上镀上一定厚度的锌层,以下设计方案正确的是 A.锌作阳极,镀件作阴极,溶液中含有锌离子 B.铂作阴极,镀件作阳极,溶液中含有锌离子 C.铁作阳极,镀件作阴极,溶液中含有亚铁离子 D.锌用阴极,镀件作阳极,溶液中含有锌离子 19、一定条件下,Na2CO3溶液中存在如下平衡:CO32-+H2OHCO3-+OH-。下列说法制取的是 A.稀释溶液,平衡正向移动,增大 B.通入CO2,平衡逆向移动,溶液pH 减小 C.加入NaOH 固体,平衡逆向移动,pH 减小 D.升高温度, 增大 20、下列说法正确的是 A.将AlCl3溶液和Al2(SO4)3溶液分别加热、蒸干、灼烧,所得固体成分相同 B.配制FeSO4溶液时,将FeSO4固体溶于稀盐酸中,然后稀释至所需浓度 C.用加热的方法可以除去KCl 溶液中的Fe3+ D.洗涤油污常用热的碳酸钠溶液 21、下面提到的问题中,与盐的水解有关的是 ①明矾和FeCl3可作净水剂 ②为保存FeCl3溶液,要在溶液中加少量盐酸 ③用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂 ④在NH4C1溶液中加入金属镁会产生氢气 A. ①③④ B. ②③ C.全部 D. ①②④ 22、物质的量浓度相同的下列溶液中,按pH 由小到大顺序排列的是 A.Na2CO3 NaHCO3 NaCl HCl B.Na2CO3 NaHCO3 HCl NaCl C.(NH4)2SO4 NH4Cl NaNO3 Na2CO3 D.NH4Cl (NH4)2SO4 Na2CO3 NaNO3 23、已知常温下,Ksp (AgCl )=1.8×10-10,Ksp (AgI)=8.3×10-17。下列叙述中正确的是 A .常温下,AgCl 在NaCl溶液中的Ksp比在纯水中的Ksp小 B.将0.001mol·L-1的AgNO3溶液滴入KC1和KI 的混合溶液中,一定先析出AgI 沉淀 C.向AgCl 的悬浊液中加入少量KI 溶液,沉淀由白色转化为黄色 D.向AgCl 饱和溶液中加入NaCl 晶体,有AgC1析出且溶液中c (Ag+)=c (C1-) 24、化学上常认为残留在溶液中的离子浓度小于1× 10-5 mol·L-1时,沉淀就达完全。已知; 常温下Ksp[M (OH)2]=1×10-21。则溶液中M2+沉淀完全时的pH 为 A.7 B.6 C.5 D.4 25、室温条件下,现有四种溶液:① pH=2 的CH3COOH 溶液;②pH=2 的HCl溶液;③pH= 12的氨水;④pH 12 的NaOH 溶液。下列有关说法正确的是 A.由水电离出的c (H+ ):①=②=③=④ B.将②、③溶液混合后,pH 7,消耗溶液的体积:③=② C.等体积的①、②、④溶液分别与足量铝粉反应,②生成的H2的物质的量最大 D.向溶液中加入100mL水后,溶液的pH: ③>④>①>② 26、常温下:某NaHSO3溶液的pH=5,则在NaHSO3溶液中微粒的物质的量浓度关系一定正确的是 A.c (Na+) >c(HSO3-)>c(OH-) >c (H+)>(SO32- ) B.c (Na+)+c(H+)=C (OH-)+c (HSO3-)+c (H2SO3) C.c (Na+)=c (SO32-)+c (HSO3-)+c (H2SO3) D.c(OH-)=c (H+)+c(HSO3-)+c (H2SO3) 27、下列有关电解质溶液中粒子浓度关系正确的是 A.pH=a 的醋酸溶液,稀释10 倍后, 其pH=b,则a=b-1 B.含等物质的量的NaHSO3和Na2SO3的溶液: 2c (Na+)=3[c (HSO3-)+c (SO32- )+c(H2SO3) ] C.0.1mol·L-1盐酸与0.2mol·L-1氨水等体积混合:c(NH3·H2O)>c(Cl-)>c(NH4+)>c (OH-) D.含有AgCl 和AgI 固体的悬独液: c (Ag+) >c (Cl-)=C (I-) 28、下列热化学方程式书写正确的是(△H的绝对值均正确) A.s (s)+O2 (g)=SO2 (g) ; △H=- 296.8 kJ·mol-1 (反应热) B.NaOH (aq)+HCl (aq) =NaCl (aq) +H2O (l) ; △H=+57.3 kJ·mol-1(中和热) C.C2H5OH (1)+3O2 (g)=2CO2 (g)-+3H2O(g) ; △H=- 1367.0 kJ·mol-1 (燃烧热) D.2NO2= O2+2NO ; △H =+116 kJ·mol-1(反应热) 29、25 ℃时纯水的电离度为a1,pH=2 的醋酸溶液的电离度为a2,pH=12 的氢氧化钠溶液中水的电离度为a3。 若将上述醋酸与氢氧化钠溶液等体积混合,所得溶液中水的电离度为a4。下列关系式中正确的是 A.a3 =a2查看更多
相关文章
- 当前文档收益归属上传用户
- 下载本文档