- 2021-04-20 发布 |
- 37.5 KB |
- 10页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
化学卷·2019届湖南省浏阳一中、醴陵一中、南方中学高二12月联考(2017
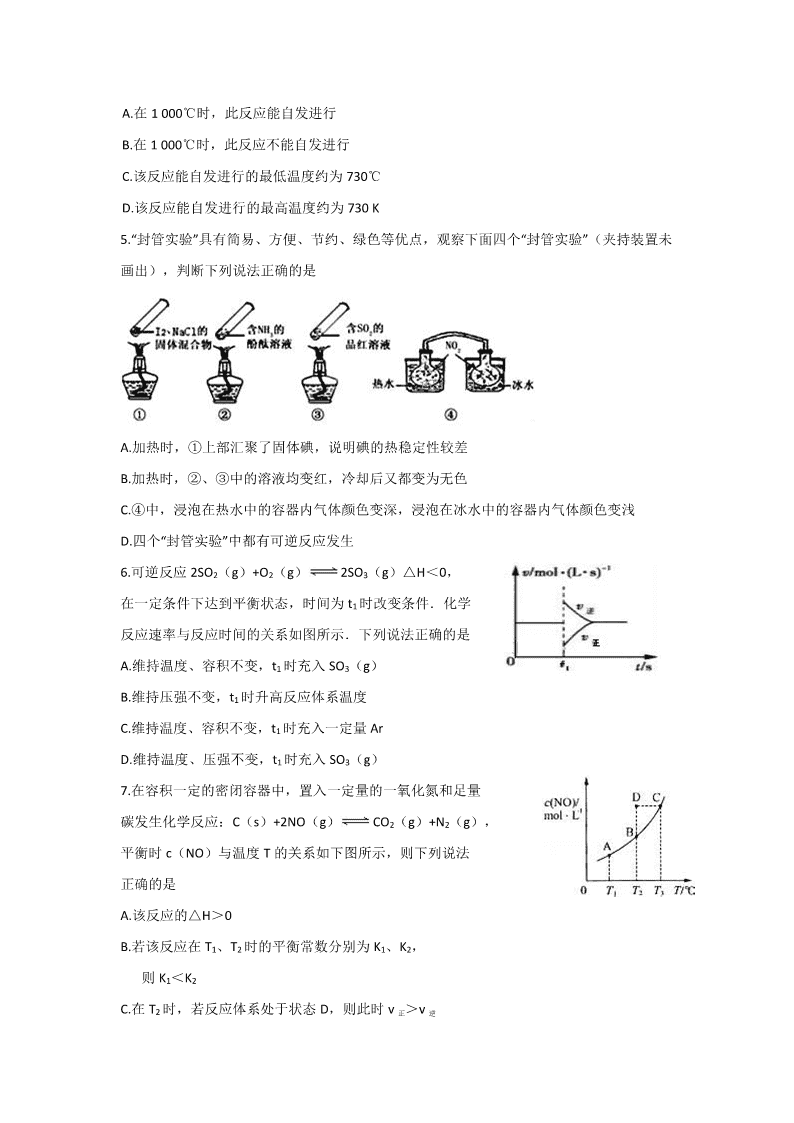
湖南省浏阳一中、醴陵一中、南方中学 2017-2018 学年高二 12 月联考化学试卷 总分:100 分 时量:90 分钟 考试时间 2017 年 12 月 12 日 命题人: 审题人: 相对原子质量;H-1 C-12 N-14 O-16 Na-23 S-32 Cl-35.5 K-39 Fe-56 Cu-64 Ba-137 第Ⅰ卷(选择题(共 42 分) 一、选择题(每小题只有..1.个.选项符合题意,每小题 2 分,共 42 分) 1.化学与科技、社会、生产、生活密切相关。下列有关说法不正确的是 A.以地沟油为原料加工制成的生物柴油的成分与从石油分馏得到的柴油成分不同 B.在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质 C.绿色化学的核心是应用化学原理对环境污染进行治理 D.天然气、沼气和水煤气分别属于化石能源、可再生能源和二次能源 2.下列实验装置正确且能完成实验目的是 A.测定一定时间内生成 H2 的反应速率 B.提取海带中的碘 C.检验火柴燃烧产生的 SO2 D.证明非金属性:Cl>C>Si 3.下列说法正确的是 A.在 25℃、101KPa,1mol S(s)和 2molS(s) 的燃烧热相等 B.1mol H2SO4 (浓)与 1mol Ba(OH)2 完全中和所放出的热量为中和热 C.CO 是不稳定的氧化物,它能继续和氧气反应生成稳定的 CO2 ,所以 CO 的燃烧反应一定是 吸热反应 D.101KPa 时,1mol H2 燃烧所放出的热量为氢气的燃烧热 4.闪电时空气中的 N2 和 O2 会发生反应:N2(g)+O2(g)═2NO(g) △H=+180.50kJ/mol,△S=+247.3J/(mol•K),若不考虑温度对该反应焓变的影响,则下列 说法中正确的是 A.在 1 000℃时,此反应能自发进行 B.在 1 000℃时,此反应不能自发进行 C.该反应能自发进行的最低温度约为 730℃ D.该反应能自发进行的最高温度约为 730 K 5.“封管实验”具有简易、方便、节约、绿色等优点,观察下面四个“封管实验”(夹持装置未 画出),判断下列说法正确的是 A.加热时,①上部汇聚了固体碘,说明碘的热稳定性较差 B.加热时,②、③中的溶液均变红,冷却后又都变为无色 C.④中,浸泡在热水中的容器内气体颜色变深,浸泡在冰水中的容器内气体颜色变浅 D.四个“封管实验”中都有可逆反应发生 6.可逆反应 2SO2(g)+O2(g) 2SO3(g)△H<0, 在一定条件下达到平衡状态,时间为 t1 时改变条件.化学 反应速率与反应时间的关系如图所示.下列说法正确的是 A.维持温度、容积不变,t1 时充入 SO3(g) B.维持压强不变,t1 时升高反应体系温度 C.维持温度、容积不变,t1 时充入一定量 Ar D.维持温度、压强不变,t1 时充入 SO3(g) 7.在容积一定的密闭容器中,置入一定量的一氧化氮和足量 碳发生化学反应:C(s)+2NO(g) CO2(g)+N2(g), 平衡时 c(NO)与温度 T 的关系如下图所示,则下列说法 正确的是 A.该反应的△H>0 B.若该反应在 T1、T2 时的平衡常数分别为 K1、K2, 则 K1<K2 C.在 T2 时,若反应体系处于状态 D,则此时 v 正>v 逆 D.若状态 B、C、D 的压强分别为 PB、PC、PD,则 PC=PD>PB 8.以 MnO2 为原料制得的 MnCl2 溶液中常含有 Cu2+、Pb2+、Cd2+等金属离子,通过添加过量难 溶电解质 MnS,可使这些金属离子形成硫化物沉淀,经过滤除去包括 MnS 在内的沉淀,再 经蒸发、结晶,可得纯净的 MnCl2。根据上述实验事实,可推知 MnS 具有的相关性质是 A.具有吸附性 B.溶解度与 CuS、PbS、CdS 等相同 C.溶解度大于 CuS、PbS、CdS D.溶解度小于 CuS、PbS、CdS 9.用 NA 表示阿伏加德罗常数的值,下列叙述正确的是 A.含 0.2mol H2SO4 溶质的浓硫酸和足量铜加热反应,转移的电子数为 0.2NA B.常温常压下,22.4L NH3 分子的电子数、质子数均为 10NA C.1mol N2 与 3mol H2 混合,充分反应后形成的 N-H 键数目为 6NA D.4.6gNO2 和 N2O4 的混合气体中氧原子数为 0.2NA 10. 25 ℃时,下列各组离子在指定溶液中一定能大量共存的是 A.滴入石蕊试液显蓝色的溶液中:K+、Na+、HSO- 3 、ClO- B.0.1 mol/L 的 Fe(NO3)3 溶液中:Na+、H+、Cl-、I- C.0.1 mol/L 的 NaAlO2 溶液中:K+、H+、NO- 3 、SO2- 4 D.由水电离产生的 c(H+)=1×10-13mol/L 的溶液中:Na+、Ba2+、NO- 3 、Cl- 11.用电解氧化法可以在铝制品表面形成致密、耐腐蚀的氧化膜,电解质溶液一般为 H2SO4-H2C2O4 混合溶液。下列叙述错误的是 A.待加工铝质工件为阳极 B.可选用不锈钢作为阴极 C.阴极的电极反应式为: 3Al 3e Al D.硫酸根离子在电解过程中向阳极移动 12.一种光化学电池的结构如图所示,电池总反应为: AgCl(s)+Cu+(aq)===Ag(s)+Cu2+(aq)+Cl-(aq) 下列关于该电池在工作时的说法中正确的是 A.生成 108 g 银,转移电子个数为 1 mol B.Cu+在负极发生氧化反应 C.Ag 电极活泼,Ag 失电子发生氧化反应 D.Cl-由负极迁移到正极 13.利用表中提供的仪器和药品,能达到相应实验目的的是 选项 仪器 药品 实验目的 A 烧杯、玻璃棒、胶头滴 管 FeCl3 溶液、NaOH 溶液 制 Fe(OH)3 胶体 B 圆底烧瓶、导气管、烧 杯、铁架台 干燥的二氧化碳气体、蒸馏 水 模拟喷泉实验 C 酸式滴定管、锥形瓶、 铁架台(带铁夹) 已知浓度的盐酸、待测 NaOH 溶液 测定NaOH 溶液的物质的 量浓度 D 酒精灯、玻璃棒、蒸发 皿、三脚架 NaCl 溶液 蒸发溶液得到晶体 14.K2Cr2O7 溶液中存在平衡:Cr2O72-(橙色)+H2O 2CrO42-(黄色)+2H+。用 K2Cr2O7 溶液 进行下列实验: 结合实验,下列说法不正确的是 A.①中溶液橙色加深,③中溶液变黄 B.②中 Cr2O72-被 C2H5OH 还原 C.对比②和④可知 K2Cr2O7 酸性溶液氧化性强 D.若向④中加入 70%H2SO4 溶液至过量,溶液变为橙色 15.某科学家利用二氧化铈(CeO2)在太阳能作用下将 H2O、CO2 转变成 H2、CO。 其过程如下: 下列说法不正确的是 A.该过程中 CeO2 没有消耗 B.该过程实现了太阳能向化学能的转化 C.右图中△H1=△H2+△H3 D.以 CO 和 O2 构成的碱性燃料电池的负极反应式为 CO+4OH—- 2e-=CO32-+2H2O 16.已知:Ksp[Al(OH)3]=1×10-33,Ksp[Fe(OH)3]=3×10-39,pH=7.1 时 Mn(OH)2 开始沉淀。 室温下,除去 MnSO4 溶液中的 Fe3+、Al3+(使其浓度小于 1×10-6mol·L-1),需调节溶液 pH 范围为 A. (3.5 , 5.0) B.(3.5 , 7.1) C.(5.0 , 7.1) D. ( 4.0 , 7.1) 17.常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g) Ni(CO)4(g)。230℃时,该反应的平衡 常数 K=2×10−5。已知:Ni(CO)4 的沸点为 42.2℃,固体杂质不参与反应。 第一阶段:将粗镍与 CO 反应转化成气态 Ni(CO)4; 第二阶段:将第一阶段反应后的气体分离出来,加热至 230℃制得高纯镍。 下列判断正确的是 A.增加 c(CO),平衡向正向移动,反应的平衡常数增大 B.第一阶段,在 30℃和 50℃两者之间选择反应温度,选 50℃ C.第二阶段,Ni(CO)4 分解率较低 D.该反应达到平衡时,v 生成[Ni(CO)4]=4v 生成(CO) 18. 25 ℃时,在 10 mL 浓度均为 0.1 mol·L-1NaOH 和 NH3·H2O 混合溶液中滴加 0.1 mol/L 的盐 酸,下列有关溶液中粒子浓度关系正确的是 A.未加盐酸时:c(OH-)>c(Na+)=c(NH3·H2O) B.加入 10 mL 盐酸时:c(NH4+)+c(H+)=c(OH-) C.加入盐酸至溶液 pH=7 时:c(Cl-)=c(Na+) D.加入 20 mL 盐酸时:c(Cl-)=c(NH4+)+c(Na+) 19.下列事实不能用勒夏特列原理解释的是 A.溴水中有下列平衡 Br2+H2O HBr+HBrO,当加入 AgNO3 溶液后,溶液颜色变浅 B.合成氨反应,为提高氨的产率,理论上应采取降低温度的措施 C.反应 CO(g)+NO2(g) CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色 变深 D.对于反应 2HI(g) H2(g)+I2 (g),达平衡后,缩小容器体积可使体系颜色变深 20.①c(H+)=0.01mol/L 的 CH3COOH 溶液; ②c(H+)=0.01mol/L 的 H2SO4 溶液; ③c(OH—)=0.01mol/L 的氨水; ④c(OH—)=0.01mol/L 的 NaOH 溶液。室温条件下, 有关上述溶液的比较中,正确的是 A.水电离的 c(H+):①=②=③=④ B.将②、④溶液混合后,pH=7,消耗溶液的体积:②<④ C.等体积的①、②、④溶液分别与足量铝粉反应,生成 H2 的量:②最大 D.向 10 mL 上述四溶液中各加入 90 mL 水后,溶液的 pH:③>④>①>② 21.织物漂白剂亚氯酸钠(NaClO2)在溶液中可生成 ClO2、HClO2、ClO- 2 、Cl-等,其中 HClO2 和 ClO2 都具有漂白作用,但 ClO2 是有毒气体。25 ℃时,各组分含量随 pH 变化情况如图所 示(Cl-没有画出)。下列说法错误的是 A.25 ℃时,HClO2 的电离平衡常数的数值 Ka=10-6 B.使用该漂白剂的最佳 pH 为 3.0 C.25 ℃时,等浓度的 HClO2 溶液和 NaClO2 溶液等体积混合后, 混合溶液中:c(HClO2)+2c(H+)=c(ClO- 2 )+2c(OH-) D.该温度下的 NaClO2 溶液中 c(Na+)>c(ClO- 2 )>c(OH-)>c(H+) 第Ⅱ卷(共五个大题,总计 58 分) 二、填空题 22.(10 分)2015 年 8 月 12 日,天津滨海新区爆炸事故确认有氰化钠(NaCN)、亚硝酸钠等, 氰化钠毒性很强,遇水、酸会产生有毒易燃氰化氢气体。氰化氢的沸点只有 26 ℃,因此相 当容易挥发进入空气,这就大大增加了中毒的风险。同时氰化钠遇到亚硝酸钠会发生爆炸。 回答下列问题: (1)写出氰化钠遇水产生氰化氢的离子方程式_________________________________ (2)爆炸现场约 700 吨的氰化钠大约需要 900 吨的双氧水来处理。氰化钠与双氧水相遇后, 会释放出氨气同时析出白色晶体,使得氰化钠的毒性大大降低,写出氰化钠与双氧水反应的 化学方程式_________________________________ (3)爆炸残留在废水中的 CN-可以用 Cr2O 2- 7 处理,拟定下列流程进行废水处理, 1)上述处理废水流程中主要使用的方法是 ______ a.混凝法 b.中和法 c.沉淀法 d.氧化还原法 2)②中反应后无气体放出,该反应的离子方程式为_________________________________ 3)步骤③中,每处理 0.4 mol Cr2O 2- 7 时转移电子 2.4 mol,该反应的离子方程式_____________ 23.(10 分)某学生为测定未知浓度的硫酸溶液,进行如下实验:用 1.00mL 待测硫酸溶液配 制 100mL 稀 H2SO4 溶液;以 0.14mol•L-1 的 NaOH 溶液滴定上述稀 H2SO4 25.00mL,滴定终止 时消耗 NaOH 溶液 15.00mL. (1)该学生用 0.14mol•L-1NaOH 标准溶液滴定硫酸的实验操作如下: A.用酸式滴定管取稀 H2SO4 25.00mL,注入锥形瓶中,加入指示剂. B.用待测定的溶液润洗酸式滴定管 C.用蒸馏水洗干净滴定管 D.取下碱式滴定管用标准的 NaOH 溶液润洗后,将标准液注入碱式滴定管刻度“0”以上 2-3cm 处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下 E.检查滴定管是否漏水 F.另取锥形瓶,再重复操作一次 G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下 滴定管液面所在刻度 ①滴定操作的正确顺序是(用序号填写) ( )→( )→D→( ) →A→( ) →( ) ②配制准确浓度的稀 H2SO4 溶液,必须使用的主要容器是 ______ ③观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则结果会导致测得的稀 H2SO4 溶液浓度测定值 ______ (选填“偏高”“偏低”或“无影响”) ④计算待测硫酸(稀释前的硫酸)溶液的物质的量浓度(计算结果到小数点后二位)_____ ⑤已知:含 CH3COOH 1mol 的醋酸溶液与 NaOH(aq)反应的ΔH=-12.1 kJ·mol-1;含 HCl1mol 的 盐酸与 NaOH(aq)反应的ΔH=-55.6 kJ·mol-1。则 CH3COOH 在水溶液中电离的ΔH 等于 ______ 24.(12 分)氨在国民经济中占有重要地位。 I.合成氨工业中,初始时氮气、氢气的体枳比为 1:3 时,每反应 1mol N2,放出 92.2kJ 热量。 如图为合成氨反应在不同温度和压强、使用相同催化剂条件下,平衡混合物中氨的体积分数。 1 由图可知:p1、p2、p3 的大小关系为________, 理由是_____________________________ ②A、B 点生成氨气的速率大小关系为_____________, C 点,N2 的转化率为_____。 ③下列关于合成氨的说法正确是_________ (填序号)。 A.断开 1 个 N≡N 键的同时有 6 个 N—H 键形成,反应一定达到平衡状态 B.混合气体的平均相对分子质量不再改变状态,反应一定达到平衡状态 C.由于△H<0、△S>0,故合成氨反应一定能自发进行 D.增大 n(N2):n(H2)的比值,有利用提离 H2 的转化率 II.最近美国 Simons 等科学家发明了不必使氨先裂化为氢就可直接用于燃料电池的方法。其 电池反应为 4NH3+3O2==2N2+6H2O,写出负极的电极反应式:__________________ 25.(14 分) 为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮 氧化物、碳氧化物含量显得尤为重要。 Ⅰ.氮氧化物研究 (1)一定条件下,将 2molNO 与 2molO2 置于恒容密闭容器中发生反应 2NO(g)+O2(g) 2NO2(g),下列各项能说明反应达到平衡状态的是 。 a.体系压强保持不变 b.混合气体密度保持不变 c.NO 和 O2 的物质的量之比保持不变 d.每消耗 2molNO 同时生成 2 molNO2 (2)汽车内燃机工作时会引起 N2 和 O2 的反应: N2 + O2 2NO,是导致汽车尾气中含有 NO 的原因之一。 在 T1、T2 温度下,一定量的 NO 发生分解反应时 N2 的体积 分数随时间变化如右图所示,根据图像判断反应 N2(g)+ O2(g) 2NO(g)的△H___0(填“>”或“<”)。 (3)NOx 是汽车尾气中的主要污染物之一。汽车发动机工作时会引发 N2 和 O2 反应, 其能量变化如图所示: 写出该反应的热化学方程式:________________________________。 Ⅱ.二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物。综合治理其污染 是坏境化学当前的重要研究内容之一。 (1)硫酸生产中,SO2 催化氧化生成 SO3:2SO2(s)+O2(g) 2SO3(g). 某温度下,SO2 的平衡转化率(α)与体系总压强(P)的关系如下图 所示。根据图示回答下列问题: ①将 2.0 molSO2 和 1.0molO2 置于 10 L 密闭容器 中,反应达平衡后,体系总压强为 0.10MPa。该 反应的平衡常数等于__________。 ②平衡状态由 A 变到 B 时,平衡常数 K(A) _______K(B)(填“>”、“<”或“=”)。 (2)用 CH4 催化还原 NOx 可以消除氮氧化物的污染。例如: CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol-1 CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ·mol-1 若用标准状况下 4.48 L CH4 还原 NO2 至 N2,整个过程中转移的电子总数为__________(阿伏 加德罗常数的值用 NA 表示),放出的热量为___________kJ。 26.(12 分) (1) 常温下,在 200 mL 氢氧化钡溶液中含有 1×10-3mol 的钡离子,将此溶液与 pH=3 的盐酸 混合,使其混合溶液的 pH=7,应取氢氧化钡溶液和盐酸的体积之比是 。 (2) 25℃时,利用 pH 试纸测得 0.1mol•L-1 醋酸溶液的 pH 约为 3,则可以估算出醋酸的电离 常数约为 ;向 10mL 此溶液中加入少量冰醋酸,忽略溶解过程中溶液温度和体积的 微小变化,溶液中 c(H+)/c(CH3COOH)的值将 (填“增大”、“减小”或“无法确定”)。 (3) 25 ℃时,PH=3 的 NH4Al(SO4)2 中 2c(SO42-)-c(NH4+)-3c(Al3+)= (取近似值) (4)室温时,向 100mL0.1mol·L-1NH4HSO4 溶液中滴加 0.1mol·L-1NaOH 溶液,溶液 pH 与 NaOH 溶液体积的关系曲线如图所示:试分析图中 a、b、c、d 四个点,水的电离程度最大的是________点;在 b 点,溶液中各离子浓度由大 到小的排列顺序是__________________________ 化学试卷参考答案 1-21 CAAAC DCCDD CBDDC CBBDA B 22.(10 分) CN-+H2O===HCN↑+OH- NaCN+H2O2+H2O===NaHCO3+NH3↑ d CN-+ClO-===CNO-+Cl- 3S2O 2- 3 +4Cr2O 2- 7 +26H+===6SO 2- 4 +8Cr3++13H2O 23. (10 分) (1)E C B G F; (2)100mL 容量瓶;(3)偏低;(4) 4.20mol/L (5) +43.5 kJ·mol-1 24.(12 分) p1>p2>p3 相同温度下,p1 到 p3 氨的体积分数降低,说明平衡左移,压强减小 vA查看更多