- 2021-04-19 发布 |
- 37.5 KB |
- 35页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届二轮复习新型电源、电解的应用与金属腐蚀学案(全国通用)
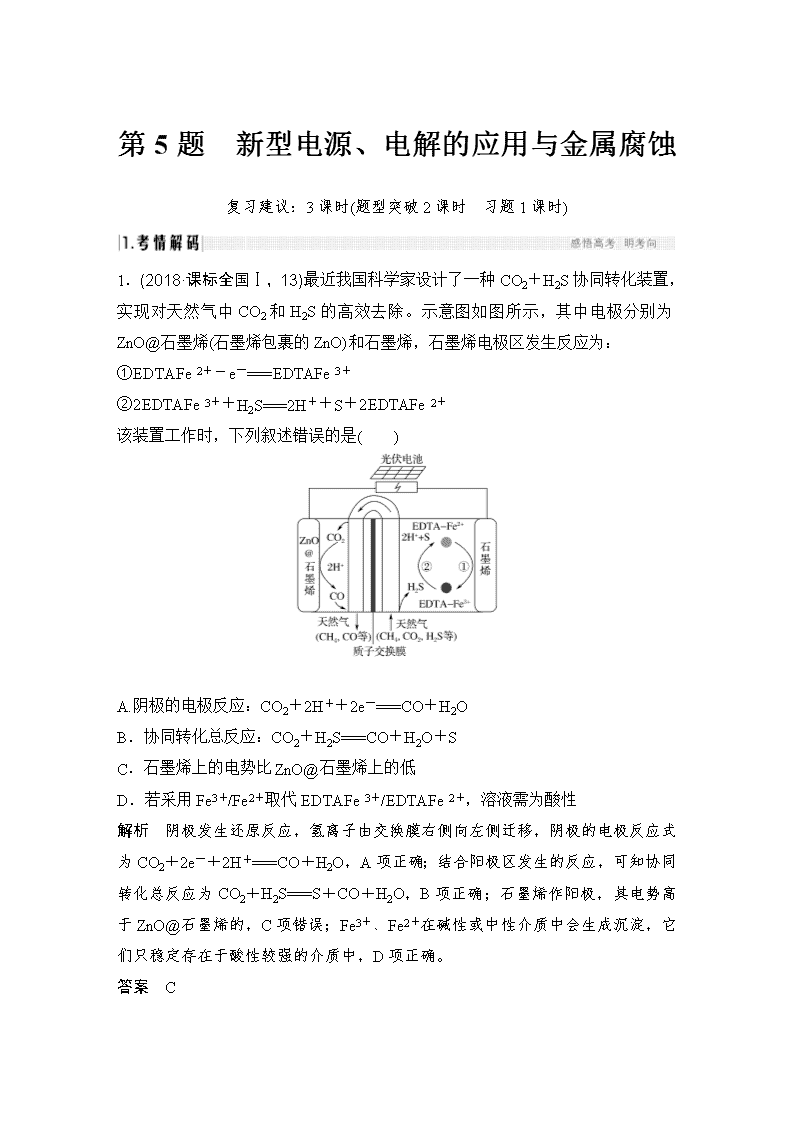
第5题 新型电源、电解的应用与金属腐蚀 复习建议:3课时(题型突破2课时 习题1课时) 1.(2018·课标全国Ⅰ,13)最近我国科学家设计了一种CO2+H2S协同转化装置,实现对天然气中CO2和H2S的高效去除。示意图如图所示,其中电极分别为ZnO@石墨烯(石墨烯包裹的ZnO)和石墨烯,石墨烯电极区发生反应为: ①EDTAFe2+-e-===EDTAFe3+ ②2EDTAFe3++H2S===2H++S+2EDTAFe2+ 该装置工作时,下列叙述错误的是( ) A.阴极的电极反应:CO2+2H++2e-===CO+H2O B.协同转化总反应:CO2+H2S===CO+H2O+S C.石墨烯上的电势比ZnO@石墨烯上的低 D.若采用Fe3+/Fe2+取代EDTAFe3+/EDTAFe2+,溶液需为酸性 解析 阴极发生还原反应,氢离子由交换膜右侧向左侧迁移,阴极的电极反应式为CO2+2e-+2H+===CO+H2O,A项正确;结合阳极区发生的反应,可知协同转化总反应为CO2+H2S===S+CO+H2O,B项正确;石墨烯作阳极,其电势高于ZnO@石墨烯的,C项错误;Fe3+、Fe2+在碱性或中性介质中会生成沉淀,它们只稳定存在于酸性较强的介质中,D项正确。 答案 C 2.(2018·课标全国Ⅱ,12)我国科学家研发了一种室温下“可呼吸”的NaCO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na2Na2CO3+C。下列说法错误的是( ) A.放电时,ClO向负极移动 B.充电时释放CO2,放电时吸收CO2 C.放电时,正极反应为:3CO2+4e-===2CO+C D.充电时,正极反应为:Na++e-===Na 解析 电池放电时,ClO向负极移动,A项正确;结合总反应可知放电时需吸收CO2,而充电时释放出CO2,B项正确;放电时,正极CO2得电子被还原生成单质C,即电极反应式为3CO2+4e-===2CO+C,C项正确;充电时阳极发生氧化反应,即C被氧化生成CO2,D项错误。 答案 D 3.(2018·课标全国Ⅲ,11)一种可充电锂空气电池如图所示。当电池放电时,O2与Li+在多孔碳材料电极处生成Li2O2-x(x=0或1)。下列说法正确的是( ) A.放电时,多孔碳材料电极为负极 B.放电时,外电路电子由多孔碳材料电极流向锂电极 C.充电时,电解质溶液中Li+向多孔碳材料区迁移 D.充电时,电池总反应为Li2O2-x===2Li+O2 解析 根据电池工作原理,多孔碳材料吸附O2,O2在此获得电子,所以多孔碳材料电极为电池的正极,A项错误;放电时电子从负极(锂电极)流出,通过外电路流向正极(多孔碳材料电极),B项错误;Li+带正电荷,充电时,应该向电解池的阴极(锂电极)迁移,C项错误;充电时,电池总反应为Li2O2-x===2Li+O2,D项正确。 答案 D 4.(2017·课标全国Ⅰ,11)支撑海港码头基础的防腐技术,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是( ) A.通入保护电流使钢管桩表面腐蚀电流接近于零 B.通电后外电路电子被强制从高硅铸铁流向钢管桩 C.高硅铸铁的作用是作为损耗阳极材料和传递电流 D.通入的保护电流应该根据环境条件变化进行调整 解析 钢管桩接电源的负极,高硅铸铁接电源的正极,通电后,外电路中的电子从高硅铸铁(阳极)流向正极,从负极流向钢管桩(阴极),A、B正确;C项,题给信息高硅铸铁为“惰性辅助阳极”不损耗,错误。 答案 C 5.(2017·课标全国Ⅱ,11)用电解氧化法可以在铝制品表面形成致密、耐腐蚀的氧化膜,电解质溶液一般为H2SO4-H2C2O4混合溶液。下列叙述错误的是( ) A.待加工铝质工件为阳极 B.可选用不锈钢网作为阴极 C.阴极的电极反应式为:Al3++3e-===Al D.硫酸根离子在电解过程中向阳极移动 解析 A项,根据原理可知,Al要形成氧化膜,化合价升高失电子,因此铝为阳极,正确;B项,阴极仅作导体,可选用不锈钢网,且不锈钢网接触面积大,能增加电解效率,正确;C项,阴极应为氢离子得电子生成氢气,错误;D项,电解时,阴离子移向阳极,正确。 答案 C 6.(2017·课标全国Ⅲ,11)全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8===8Li2Sx(2≤x≤8)。下列说法错误的是( ) A.电池工作时,正极可发生反应:2Li2S6+2Li++2e-===3Li2S4 B.电池工作时,外电路中流过0.02 mol电子,负极材料减重0.14 g C.石墨烯的作用主要是提高电极a的导电性 D.电池充电时间越长,电池中Li2S2的量越多 解析 A项,原电池电解质中阳离子移向正极,根据全固态锂硫电池工作原理图示中Li+移动方向可知,电极a为正极,正极发生还原反应,由总反应可知正极依次发生S8→Li2S8→Li2S6→Li2S4→Li2S2的还原反应,正确;B项,电池工作时负极电极方程式为:Li-e-===Li+,当外电路中流过0.02 mol电子时,负极消耗的Li的物质的量为0.02 mol,其质量为0.14 g,正确;C项,石墨烯具有良好的导电性,故可以提高电极a的导电能力,正确;D项,电池充电时为电解池,此时电解总反应为8Li2Sx16Li+xS8(2≤x≤8),故Li2S2的量会越来越少,错误。 答案 D 7.(2016·课标全国Ⅰ,11)三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。 下列叙述正确的是( ) A.通电后中间隔室的SO离子向正极迁移,正极区溶液pH增大 B.该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品 C.负极反应为2H2O-4e-===O2+4H+,负极区溶液pH降低 D.当电路中通过1 mol电子的电量时,会有0.5 mol的O2生成 解析 电解池中阴离子向正极移动,阳离子向负极移动,即SO离子向正极区移动,Na+ 向负极区移动,正极区水电离的OH-发生氧化反应生成氧气,H+留在正极区,该极得到H2SO4产品,溶液pH减小,负极区水电离的H+发生还原反应生成氢气,OH-留在负极区,该极得到NaOH产品,溶液pH增大,故A、C项错误,B正确;该电解池相当于电解水,根据电解水的方程式可计算出当电路中通过1 mol电子的电量时,会有0.25 mol的O2生成,错误。 答案 B 8.(2016·课标全国Ⅱ,11)MgAgCl电池是一种以海水为电解质溶液的水激活电池。下列叙述错误的是( ) A.负极反应式为Mg-2e-===Mg2+ B.正极反应式为Ag++e-===Ag C.电池放电时Cl-由正极向负极迁移 D.负极会发生副反应Mg+2H2O===Mg(OH)2+H2↑ 解析 根据题意,Mg海水AgCl电池总反应式为Mg+2AgCl===MgCl2+2Ag。A项,负极反应式为Mg-2e-===Mg2+,正确;B项,正极反应式为2AgCl+2e-===2Cl-+ 2Ag,错误;C项,对原电池来说,阴离子由正极移向负极,正确;D项,由于镁是活泼金属,则负极会发生副反应Mg+2H2O===Mg(OH)2+H2↑,正确。 答案 B 9.(2015·全国卷Ⅰ,11)微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是( ) A.正极反应中有CO2生成 B.微生物促进了反应中电子的转移 C.质子通过交换膜从负极区移向正极区 D.电池总反应为C6H12O6+6O2===6CO2+6H2O 解析 由题意可知,微生物电池的原理是在微生物作用下O2与C6H12O6发生氧化还原反应,将化学能转化为电能,B正确;氧气在正极反应,由于质子交换膜只允许H+通过,则正极反应为O2+4e-+4H+===2H2O,没有CO2生成,A项错误;负极发生反应:C6H12O6-24e-+6H2O===6CO2+24H+,H+在负极区生成,移向正极区,在正极被消耗,C项正确;总反应为C6H12O6+6O2===6CO2+6H2O,D项正确。 答案 A 命题调研(2014~2018五年大数据) 命题角度 设项方向 频数 难度 1.新型化学电源 正、负极判断 5 0.43 离子移动方向 电极反应式、总原电池方程式的正误判断 电极及电解液转移电子计算 2.电解原理在工、农业生产中的应用 阴、阳极的判断 3 0.51 离子交换膜的作用 副反应分析及溶液酸碱性的改变 电极方程式的正误判断 电化学腐蚀的原因分析 1 0.60 3.金属的腐蚀与防护 防止金属腐蚀的措施 在2019年高考中,对于电化学的考查将继续坚持以新型电池及电解应用装置为背景材料,以题干(装置图)提供电极构成材料、交换膜等基本信息,基于电化学原理广泛设问,综合考查电化学基础知识及其相关领域的基本技能,包括电极与离子移动方向判断、电极反应式书写、溶液的酸碱性和pH变化、有关计算及其与相关学科的综合考查等。预测以二次电池以及含有离子交换膜的电解池为背景的命题将成为热点题型,因为二次电池不仅实现电极材料循环使用,符合“低耗高效”的时代需求,而且命题角度丰富,便于同时考查原电池和电解池工作原理;含有离子交换膜的电解池设问空间大,便于考查考生的探究能力。 判断 依据 电极 材料 电极 反应 电子 流向 离子 移向 电极现象 原电池 负 极 活泼金属 氧化 反应 流出 阴离子 移向 电极质量 减小 正 极 不活泼 金属 或非金属 还原 反应 流入 阳离子 移向 电极增 重或质 量不变 电解池 阳 极 与电源正 极相连 氧化 反应 流出 阴离子 移向 电极溶解 或pH 减小 阴 极 与电源负 极相连 还原 反应 流入 阳离子 移向 电极增重 或pH 增大 (1)燃料电池电极反应式的书写(以氢氧燃料电池为例) ①注意介质环境 ②掌握书写程序 (2)其他新型一次电池 钠硫电池 总反应:2Na+xS===Na2Sx 正极:xS+2e-===S 负极:2Na-2e-===2Na+ 全钒液 流电池 总反应:VO+2H++V2+V3++VO2++H2O 正极:VO+2H++e-===VO2++H2O 负极:V2+-e-===V3+ 锂铜电池 总反应:2Li+Cu2O+H2O===2Cu+2Li++2OH- 正极:Cu2O+H2O+2e-===2Cu+2OH- 负极:Li-e-===Li+ MgH2O2电池 总反应:H2O2+2H++Mg===Mg2++2H2O 正极:H2O2+2H++2e-===2H2O 负极:Mg-2e-===Mg2+ MgAgCl电池 总反应:Mg+2AgCl===2Ag+MgCl2 正极:2AgCl+2e-===2Cl-+2Ag 负极:Mg-2e-===Mg2+ (3)充电(可逆)电池 锌银电池 总反应:Ag2O+Zn+H2O 2Ag+Zn(OH)2 正极:Ag2O+H2O+2e-===2Ag+2OH- 负极:Zn+2OH--2e-===Zn(OH)2 阳极:2Ag+2OH--2e-===Ag2O+H2O 阴极:Zn(OH)2+2e-===Zn+2OH- 镍铁电池 总反应:NiO2+Fe+2H2OFe(OH)2+Ni(OH)2 正极:NiO2+2e-+2H2O===Ni(OH)2+2OH- 负极:Fe-2e-+2OH-===Fe(OH)2 阳极:Ni(OH)2+2OH--2e-===NiO2+2H2O 阴极:Fe(OH)2+2e-===Fe+2OH- 镍镉电池 总反应:Cd+2NiOOH+2H2OCd(OH)2+2Ni(OH)2 正极:NiOOH+H2O+e-===Ni(OH)2+OH- 负极:Cd-2e-+2OH-===Cd(OH)2 阳极:Ni(OH)2+OH--e-===NiOOH+H2O 阴极:Cd(OH)2+2e-===Cd+2OH- 高铁电池 总反应:3Zn+2K2FeO4+8H2O3Zn(OH)2+2Fe(OH)3+4KOH 正极:FeO+3e-+4H2O===Fe(OH)3+5OH- 负极:Zn-2e-+2OH-===Zn(OH)2 阳极:Fe(OH)3+5OH--3e-===FeO+4H2O 阴极:Zn(OH)2+2e-===Zn+2OH- 锂离子 电池 总反应:Li1-xCoO2+LixC6LiCoO2+C6(x<1) 正极:Li1-xCoO2+xe-+xLi+===LiCoO2 负极:LixC6-xe-===xLi++C6 阳极:LiCoO2-xe-===Li1-xCoO2+xLi+ 阴极:xLi++xe-+C6===LixC6 【题型建模】 镁及其化合物一般无毒(或低毒)、无污染,镁电池放电时电压高且平稳,因此成为人们研制绿色电池所关注的重点。有一种镁二次电池的反应为xMg+Mo3S4MgxMo3S4。下列说法错误的是( ) A.放电时Mg2+向正极移动 B.放电时正极的电极反应式为Mo3S4+2xe-===Mo3S C.放电时Mo3S4发生氧化反应 D.充电时阴极的电极反应为xMg2++2xe-===xMg [解题模型] [模型解题] 答案 C (1)常见的离子交换膜 种类 允许通过的离子及移动方向 说明 阳离子交换膜 阳离子→移向电解池的阴极或原电池的正极 阴离子和气体不能通过 阴离子交换膜 阴离子→移向电解池的阳极或原电池的负极 阳离子和气体不能通过 质子交换膜 质子→移向电解池的阴极或原电池的正极 只允许H+通过 (2)[解题模型] 如:三室式电渗析法处理含Na2SO4废水的原理如下图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。判断ab、cd是什么交换膜;判断离子的迁移方向;书写电极反应式;判断电极产物。 [模型解题] ①弄清是原电池还是电解池,判断电极 有外接电源→电解池;n→阳极,m→阴极 ②根据电极判断离子的移动方向和交换膜的种类 Na+→通过ab→阴极⇒ab是阳离子交换膜 SO→通过cd→阳极⇒cd是阴离子交换膜 ③根据放电顺序写出电极反应式 阴极,阳离子竞争放电,放电顺序:H+>Na+,阴极的电极反应式为2H2O+2e-===H2↑+2OH-; 阳极,阴离子竞争放电,放电顺序:OH->SO,阳极的电极反应式为2H2O-4e-===O2↑+4H+。 (4)根据电极反应式和离子移动方向确定电极反应物 阴极H+放电生成H2,剩余OH-与迁移过来的Na+生成NaOH; 阳极OH-放电生成O2,剩余H+与迁移过来的SO生成H2SO4。 [典例演示1] 世界某著名学术刊物介绍了一种新型中温全瓷铁空气电池,其结构如图所示。 下列有关该电池放电时的说法正确的是( ) A.a极发生氧化反应 B.正极的电极反应式为FeOx+2xe-===Fe+xO2- C.若有22.4 L(标准状况)空气参与反应,则电路中有4 mol电子转移 D.铁表面发生的反应为xH2O(g)+Fe===FeOx+xH2 解析 a极通入空气,O2在该电极发生得电子的还原反应,A错误;O2在正极发生反应,电极反应式为O2+4e-===2O2-,B错误;由B项分析可知,电路中有4 mol电子转移时正极上消耗1 mol O2,在标准状况下的体积为22.4 L,则通入空气的体积约为22.4 L×5=112 L,C错误;由图可知,铁表面H2 O(g)参与反应生成H2,则发生的反应为xH2O(g)+Fe===FeOx+xH2,D正确。 答案 D [题型训练1] 我国科研人员以Zn和尖晶石型锰酸锌(ZnMn2O4)为电极材料,研制出一种水系锌离子电池,该电池的总反应式为xZn+Zn1-xMn2O4ZnMn2O4(0查看更多