- 2021-04-19 发布 |
- 37.5 KB |
- 18页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届高考化学二轮复习专题二十弱电解质电离1含解析
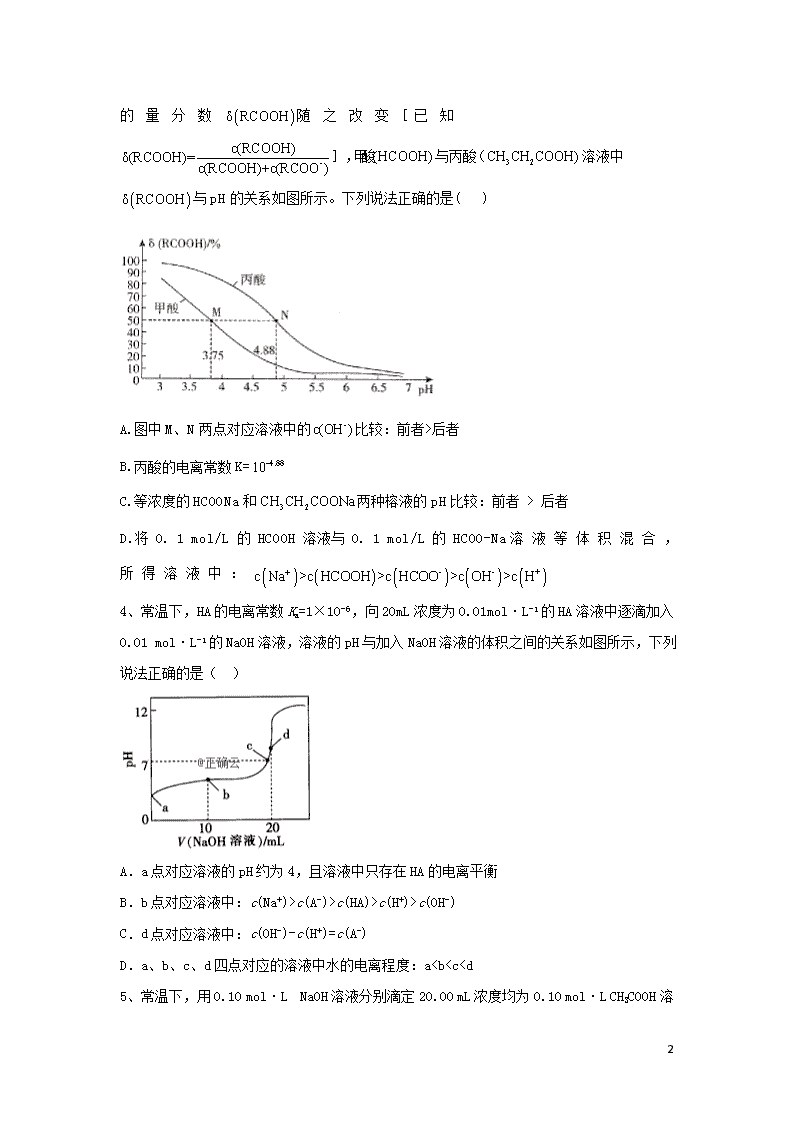
专题二十 弱电解质电离 1、已知是一种三元中强酸。25 °C时,向某浓度溶液中逐滴加入NaOH溶液,滴加过程中各种含磷微粒的物质的量分数随溶液pH的变化曲 线如右图所示。下列说法正确的是( ) A.曲线2和曲线4分别表示和s变化 B.25 ℃时, 的电离常数 C.pH = 7. 2 时,浴液屮由水电离出的mol/L D.PH = 12. 3 时, 2、25℃ 时,向体积均为20mL、浓度均为0.1000mol·L-1的三种酸HX、HY、HZ溶液中分别逐滴加入0.1000mol·L-1,的NaOH溶液,所得溶液的pH与加入NaOH溶液的体积关系如图所示。下列说法正确的是( ) A.当V(NaOH溶液)=0mL时,三种溶液相比较c(X-)>c(Y-)>c(Z-) B.当三种溶液pH均等于7时,反应消耗的n(HX)>n(HY)>n(HZ) C.当V(NaOH溶液)=10mL时,反应后溶液中各离子浓度由大到小的顺序为c(X-)>c(Y-)>c(Z-)>c(Na+) D.HY与HZ混合溶液中:c(H+)=c(Y-)+c(Z-)+ 3、25 °C时,改变0. 1 mol/L弱酸RCOOH溶液的pH,溶液中RCOOH 18 分子的物质的量分数随之改变[已知],甲酸与丙酸溶液中与pH的关系如图所示。下列说法正确的是( ) A.图中M、N两点对应溶液中的比较:前者>后者 B.丙酸的电离常数K= C.等浓度的HCOONa和两种榕液的pH比较:前者 > 后者 D.将 0. 1 mol/L 的 HCOOH 溶液与 0. 1 mol/L 的 HCOO-Na溶液等体积混合,所得溶液中: 4、常温下,HA的电离常数Ka=1×10-6,向20 mL浓度为0.01mol·L-1的HA溶液中逐滴加入0.01 mol·L-1的NaOH溶液,溶液的pH与加入NaOH溶液的体积之间的关系如图所示,下列说法正确的是( ) A.a点对应溶液的pH约为4,且溶液中只存在HA的电离平衡 B.b点对应溶液中:c(Na+)>c(A-)>c(HA)>c(H+)>c(OH-) C.d点对应溶液中:c(OH-)-c(H+)=c(A -) D.a、b、c、d四点对应的溶液中水的电离程度:a查看更多