- 2021-04-19 发布 |
- 37.5 KB |
- 8页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
化学卷·2018届安徽省全椒中学高二上学期期末考试(2017
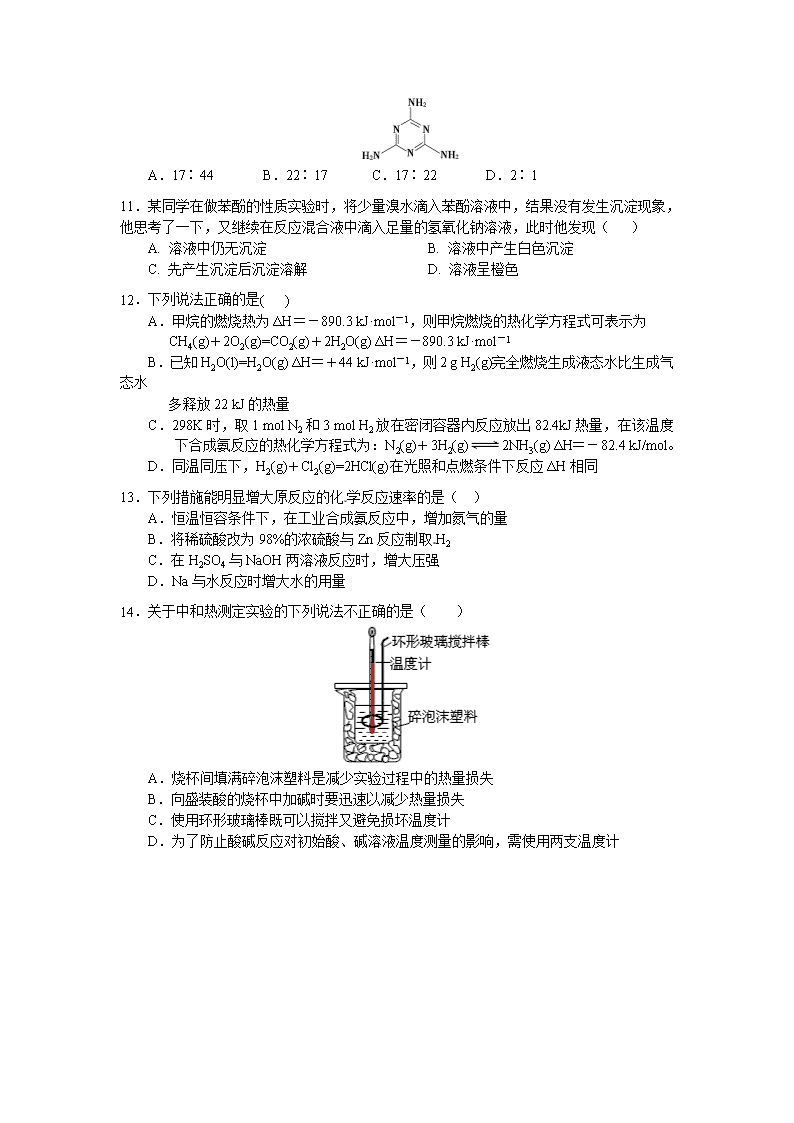
全椒中学2016—2017学年度第一学期期末考试 高二年级化学试卷 命题人:刘正龙 审核人:蔡超 可能用到的相对原子质量:H 1 C 12 O 16 N 14 一、单项选择题(本题包括15小题,每小题3分,共45分) 1.化学与生活密切相关,下列有关说法错误的是( ) A.医用消毒酒精中乙醇的浓度为95% B.食用油反复加热会产生稠环芳香烃等有害物质 C.加热能杀死流感病毒是因为蛋白质受热变性 D.用灼烧的方法可以区分蚕丝和人造纤维 2.下列项目判断,结论正确的是( ) 选项 项目 结论 A 三种有机化合物:乙烷、氯乙烯、苯 分子内所有原子均在同一平面上 B C4H9Cl的同分异构体数目(不考虑立体异构) 共有5种 C 乙烯和苯都能使溴水褪色 褪色的原理相同 D 由乙酸和乙醇制乙酸乙酯,油脂水解 均属于取代反应 3.已知某有机物的分子式为C3HaOb(a、b均是不为0的正整数),关于C3HaOb的下列说法不正确的是( ) A.无论b为多少,a都不可能为奇数 B.当a=8时,该物质不可能发生加成反应 C.当a=6、b=2时,该物质不可能含有两种官能团 D.1个C3HaOb不可能含有3个醛基 4.已知某氨基酸的相对分子质量小于200,且氧的质量分数约为0.5,则其分子中碳的个数最多为( ) A.5个 B.6个 C.7个 D.8个 5.以氯乙烷为原料制取乙二酸(HOOC—COOH)的过程中要依次经过下列步骤中的( ) ①与NaOH的水溶液共热 ②与NaOH的醇溶液共热 ③与浓硫酸共热到170℃ ④在催化剂存在情况下与氯气加成 ⑤在Cu或Ag存在的情况下与氧气共热 ⑥与新制的Cu(OH)2共热 A.②④①⑤⑥ B.①③④②⑤ C.①③④②⑥ D.②④①⑥⑤ 6.脲醛塑料(UF),俗称“电玉”,可制得多种制品,如日用品、电器元件等, 在一定条件下合成脲醛塑料的反应如下,下列说法中正确的是( ) 尿素 电玉 A.合成脲醛塑料的反应为加聚反应 B.尿素与氰酸铵 ( NH4CNO ) 互为同系物 C.能发生水解反应 D.脲醛塑料平均相对分子质量为10000,平均聚合度为111 7.Y是一种皮肤病用药,它可以由原料X经过多步反应合成。 下列说法不正确的是( ) A.X与Y互为同分异构体 B.1 mol X最多可以与4 mol H2发生加成反应 C.产物Y能发生氧化、加成、取代反应 D.1 mol Y最多能与2 mol NaOH发生反应 8.下列实验操作与预期实验目的或所得实验结论一致的是( ) 选项 实验操作 实验目的或结论 A 将氯乙烷与氢氧化钠溶液共热一段时间,再向冷却后的混合液中滴加硝酸银溶液 检验水解产物中的氯离子 B 乙醇与浓硫酸加热170℃,将所产生的气体通入溴水中 确定是否有乙烯生成 C 工业酒精中加入无水硫酸铜 确定工业酒精中是否含有水 D 电石与水反应,制得的气体直接通入酸性KMnO4溶液 检验制得的气体是否为乙炔 9.两个醛分子在NaOH溶液作用下可以发生加成反应,生成一种羟基醛: 若两种不同的醛,例如乙醛(CH3CHO)与丙醛(CH3CH2CHO)在NaOH溶液中最多可以形成羟基醛有( ) A.1种 B.2种 C.3种 D.4种 10.密胺是重要的工业原料,结构简式如图。工业上用液氨和二氧化碳为原料,硅胶为催化剂,在一定条件下,通过系列反应生成密胺。若原料完全反应生成密胺,则NH3和CO2的质量之比应为( ) A.17∶44 B.22∶17 C.17∶22 D.2∶1 11.某同学在做苯酚的性质实验时,将少量溴水滴入苯酚溶液中,结果没有发生沉淀现象,他思考了一下,又继续在反应混合液中滴入足量的氢氧化钠溶液,此时他发现( ) A. 溶液中仍无沉淀 B. 溶液中产生白色沉淀 C. 先产生沉淀后沉淀溶解 D. 溶液呈橙色 12.下列说法正确的是( ) A.甲烷的燃烧热为ΔH=-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为 CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1 B.已知H2O(l)=H2O(g) ΔH=+44 kJ·mol-1,则2 g H2(g)完全燃烧生成液态水比生成气态水 多释放22 kJ的热量 C.298K时,取1 mol N2和3 mol H2放在密闭容器内反应放出82.4kJ热量,在该温度下合成氨反应的热化学方程式为:N2(g)+3H2(g)2NH3(g) ΔH=-82.4 kJ/mol。 D.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下反应ΔH相同 13.下列措施能明显增大原反应的化学反应速率的是( ) A.恒温恒容条件下,在工业合成氨反应中,增加氮气的量 B.将稀硫酸改为98%的浓硫酸与Zn反应制取H2 C.在H2SO4与NaOH两溶液反应时,增大压强 D.Na与水反应时增大水的用量 14.关于中和热测定实验的下列说法不正确的是( ) A.烧杯间填满碎泡沫塑料是减少实验过程中的热量损失 B.向盛装酸的烧杯中加碱时要迅速以减少热量损失 C.使用环形玻璃棒既可以搅拌又避免损坏温度计 D.为了防止酸碱反应对初始酸、碱溶液温度测量的影响,需使用两支温度计 15.据报道,科学家开发出了利用太阳能分解水的新型催化剂。下列有关水分解过程的能量变化示意图正确的是( ) 二、非选择题(本题包括4小题,共55分) 16.(12分)甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,燃烧热为1455 kJ·mol-1,甲醚可作燃料电池的燃料。 (1) 写出甲醚燃烧的热化学方程式___________________ ; (2)已知H2(g)和C(s)的燃烧热分别是285.8 kJ·mol-1、393.5 kJ·mol-1; 计算反应:4C(s)+ 6H2(g)+ O2(g) = 2CH3OCH3(g)的反应热△H为___________ (3)工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g) Si(s)+4HCl(g), 硅的结构如右图所示。 化学键 Si—O Si—Cl H—H H—Cl Si—Si Si—C 键能/(kJ∙mol-1) 460 360 436 431 176 347 该反应的反应热△H为 (4)哈伯因证实N2、H2在固体催化剂(Fe)表面吸附和解吸以合成氨的过程而获诺贝尔奖。若用分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用下图表示: ①吸附后,能量状态最低的是 (填字母序号)。 ②由上述原理,在铁表面进行NH3的分解实验,发现分解速率与浓度关系如图。 从吸附和解吸过程分析,c0前速率增加的原因可能是 ;c0后速率降低的原因可能是 。 17. (12分)有文献记载:在强碱条件下,加热银氨溶液可能析出银镜。某同学进行如下验证和对比实验。 装置 实验序号 试管中的药品 现象 实验Ⅰ[来 2mL银氨溶液和数滴较浓NaOH溶液 有气泡产生,一段时间后,溶液逐渐变黑,试管壁附着银镜 实验Ⅱ 2mL银氨溶液和数滴浓氨水 有气泡产生,一段时间后,溶液无明显变化 该同学欲分析实验Ⅰ和实验Ⅱ的差异,查阅资料: a.Ag(NH3)2 + + 2H2O Ag++ 2NH3·H2O b. AgOH不稳定,极易分解为黑色Ag2O ⑴下列有关制备银镜过程的说法正确的是____________。 a.边振荡盛有2%的AgNO3溶液的试管,边滴入2%的氨水,至最初的沉淀恰好溶解为止 b.将几滴银氨溶液滴入2mL乙醛中 c.制备银镜时,用酒精灯的外焰给试管底部加热 d.银氨溶液具有较弱的氧化性 e.在银氨溶液配制过程中,溶液的pH增大 (2)经检验,实验Ⅰ的气体中有NH3,黑色物质中有Ag2O。产生Ag2O的原因是 。 (3)该同学对产生银镜的原因提出假设:可能是NaOH还原Ag2O。 实验及现象:向AgNO3溶液中加入 ,出现黑色沉淀;水浴加热,未出现银镜。 (4)重新假设:在NaOH存在下可能是NH3还原Ag2O。用下图所示装置进行实验现象:出现银镜。在虚线框内画出用生石灰和浓氨水制取NH3的装置简图(夹持仪器略)。 18.(15分)I.下列有机物的命名错误的是( ) II.芳香族化合物A可进行如下转化: C A(C11H12O5) D E B.(C2H3O2Na) NaOH溶液 Δ 对苯二甲酸 H+ 涤纶 催化剂 回答下列问题: (1)B的化学名称为 。 (2)由C合成涤纶的化学方程式为 。 (3)E的苯环上一氯代物仅有两种,E的结构简式为 。 (4)写出A所有可能的结构简式 。 (5)写出符合下列条件的E的同分异构体的结构简式 。 ①核磁共振氢谱显示苯环上仅有两种氢②可发生银镜反应和水解反应 19.(16分)顺丁橡胶,制备醇酸树脂的原料M以及杀菌剂N的合成路线如下: 已知:i. ii. (R,R’代表烃基或氢) (1)CH2=CH-CH=CH2的名称是____________________ (2)反应Ⅰ的反应类型是(选填字母) a.加聚反应 b.缩聚反应 (3)顺式聚合物P的结构简式是(选填字母) a. b. c. (4)A的相对分子质量为108. ①写出A的结构简式 ②1molB完全转化成M所消耗的H2的物质的量是 mol (5)反应Ⅲ的化学方程式是 (6)A的某些同分异构体在相同的反应条件下也能生成B和C,写出其中一种同分异构体的结构简式 。 全椒中学期末考试高二化学试卷参考答案 一、选择题答案(15x3=45分) 1、A 2、D 3、C 4、B 5、A 6、C 7、D 8、C 9、D 10、C 11、A 12、D 13、A 14、D 15、B 二、非选择题答案(共55分) 16、(1)CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l) △H=-1455kJ/mol (2)△H=-378.8kJ/mol (3)+236kJ/mol (4)C;氨的浓度增加,催化剂表面吸附的氨分子增多,速率增大; 达到一定浓度后,氨分子浓度太大阻碍N2和H2的解吸。 17、(1)ADE; (2)在NaOH存在下,加热促进NH3.H2O的分解,逸出NH3,促使Ag(NH3)2++2H2OAg++2NH3.H2O平衡正向移动,c(Ag+)增大,Ag+和OH-反应立即转化为Ag2O:2Ag++2OH-=Ag2O↓+H2O; (3)过量NaOH溶液; (4) 18、Ⅰ C; Ⅱ (1)醋酸钠。 (2); (3)HO—。 (4)或; (5)HCOO—。 19、(1) 1,3-丁二烯 (2) a (3) b (4) ①; ②3mol (5) (6) 或查看更多