- 2021-04-19 发布 |
- 37.5 KB |
- 7页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届一轮复习全国非新高考地区版第六章微考点47新型化学电源--锂电池等作业
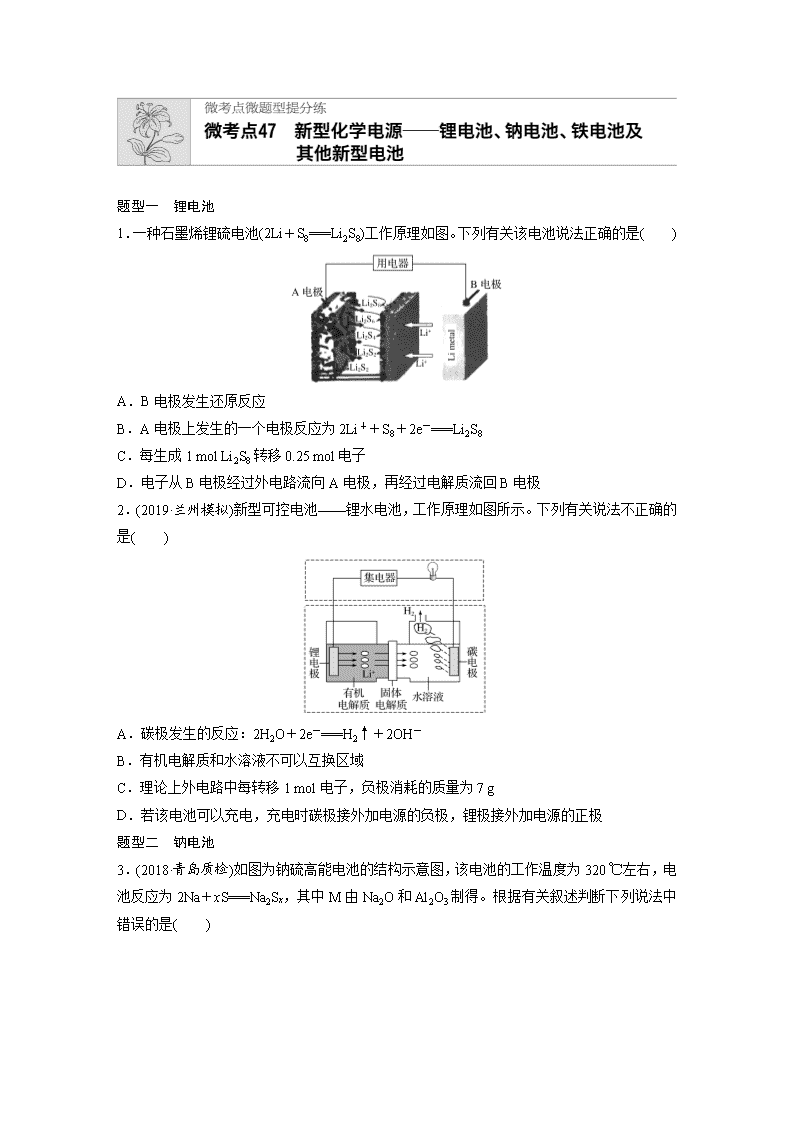
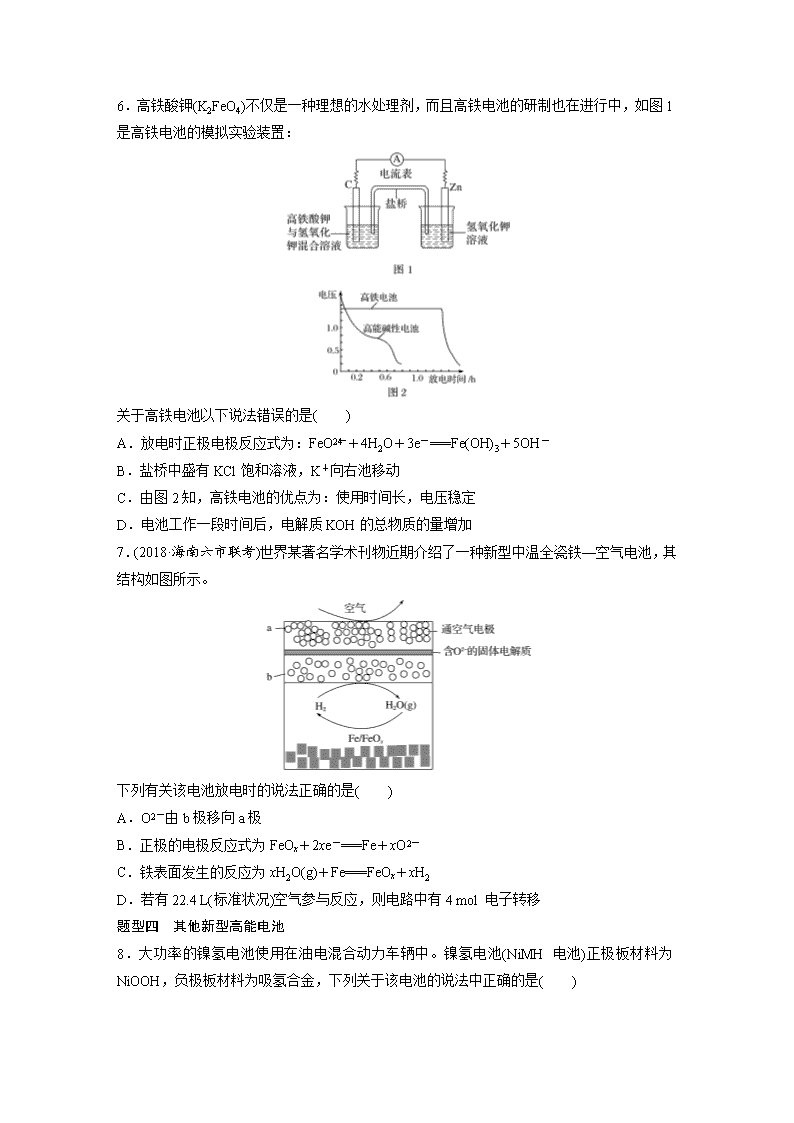
题型一 锂电池 1.一种石墨烯锂硫电池(2Li+S8===Li2S8)工作原理如图。下列有关该电池说法正确的是( ) A.B电极发生还原反应 B.A电极上发生的一个电极反应为2Li++S8+2e-===Li2S8 C.每生成1 mol Li2S8转移0.25 mol电子 D.电子从B电极经过外电路流向A电极,再经过电解质流回B电极 2.(2019·兰州模拟)新型可控电池——锂水电池,工作原理如图所示。下列有关说法不正确的是( ) A.碳极发生的反应:2H2O+2e-===H2↑+2OH- B.有机电解质和水溶液不可以互换区域 C.理论上外电路中每转移1 mol电子,负极消耗的质量为7 g D.若该电池可以充电,充电时碳极接外加电源的负极,锂极接外加电源的正极 题型二 钠电池 3.(2018·青岛质检)如图为钠硫高能电池的结构示意图,该电池的工作温度为320 ℃左右,电池反应为2Na+xS===Na2Sx,其中M由Na2O和Al2O3制得。根据有关叙述判断下列说法中错误的是( ) A.M有两个作用:一是导电,二是隔离钠与硫,防止二者化合 B.该电池的正极反应式为xS+2e-===S C.该电池的负极发生还原反应 D.消耗相同质量的负极活性物质时,钠硫电池的理论放电量是铅蓄电池的4.5倍 4.(2018·石家庄模拟)如图所示装置Ⅰ是一种可充电电池,装置Ⅱ为电解池。交换膜只允许Na+通过,充放电的化学方程式为2Na2S2+NaBr3Na2S4+3NaBr。闭合开关K时,b极附近先变红色。下列说法正确的是( ) A.负极反应为4Na-4e-===4Na+ B.闭合K后,b电极附近的pH变小 C.当有0.01 mol Na+通过离子交换膜时,b电极上析出的气体在标准状况体积为112 mL D.闭合K后,a电极上产生的气体具有漂白性 题型三 铁电池及应用 5.(2018·沧州模拟)某蓄电池反应式为Fe+Ni2O3+3H2OFe(OH)2+2Ni(OH)2。下列推断中正确的是( ) ①放电时,Fe为正极,Ni2O3为负极 ②充电时,阴极上的电极反应式是Fe(OH)2+2e-===Fe+2OH- ③充电时,Ni(OH)2为阳极 ④蓄电池的电极必须是浸在某碱性溶液中 A.①②③ B.①②④ C.①③④ D.②③④ 6.高铁酸钾(K2FeO4)不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中,如图1是高铁电池的模拟实验装置: 关于高铁电池以下说法错误的是( ) A.放电时正极电极反应式为:FeO+4H2O+3e-===Fe(OH)3+5OH- B.盐桥中盛有KCl饱和溶液,K+向右池移动 C.由图2知,高铁电池的优点为:使用时间长,电压稳定 D.电池工作一段时间后,电解质KOH的总物质的量增加 7.(2018·海南六市联考)世界某著名学术刊物近期介绍了一种新型中温全瓷铁—空气电池,其结构如图所示。 下列有关该电池放电时的说法正确的是( ) A.O2-由b极移向a极 B.正极的电极反应式为FeOx+2xe-===Fe+xO2- C.铁表面发生的反应为xH2O(g)+Fe===FeOx+xH2 D.若有22.4 L(标准状况)空气参与反应,则电路中有4 mol 电子转移 题型四 其他新型高能电池 8.大功率的镍氢电池使用在油电混合动力车辆中。镍氢电池(NiMH电池)正极板材料为NiOOH,负极板材料为吸氢合金,下列关于该电池的说法中正确的是( ) A.放电时电池内部H+向负极移动 B.充电时,将电池的负极与外接电源的正极相连 C.充电时阳极反应式为Ni(OH)2+OH--e-===NiOOH+H2O D.放电时负极的电极反应式为MHn-ne-===M+nH+ 9.(2018·黑龙江五校联考)斯坦福大学华人化学家戴宏杰的团队发明了一种“一分钟充满电”的新型铝离子电池。该电池的电极材料为铝和Cn[AlCl4](Cn为石墨),有机物阳离子和[AlCl4]-组成离子液体,电池放电时,在负极附近形成[Al2Cl7]-。充电和放电过程中离子液体中的阳离子浓度不变。下列说法不正确的是( ) A.放电时,铝为电池负极,电极反应式为Al-3e-===Al3+ B.放电时,负极材料和正极材料质量均减少 C.充电和放电过程中,有机物阳离子移动方向相反 D.充电时,阳极的电极反应式为[AlCl4]-+Cn-e-===Cn[AlCl4] 10.我国预计在2020年前后建成自己的载人空间站。为了实现空间站的零排放,循环利用人体呼出的CO2并提供O2,我国科学家设计了一种装置(如下图),实现了“太阳能—电能—化学能”转化,总反应方程式为2CO2===2CO+O2。下列关于该装置的说法中正确的是( ) A.图中N型半导体为正极,P型半导体为负极 B.图中离子交换膜为阳离子交换膜 C.反应完毕,该装置中电解质溶液的碱性增强 D.人体呼出的气体参与X电极的反应:CO2+2e-+H2O===CO+2OH- 答案精析 1.B 2.D 3.C [由于原电池内部要靠离子的定向移动导电,同时钠和硫极易化合,所以必须把二者隔离开,因此M(由Na2O和Al2O3制得)的作用是导电和隔离钠与硫;由电池反应可看出金属钠失去电子作为负极,发生氧化反应,单质硫得电子被还原成S,所以正极反应式为xS+2e-===S;在铅蓄电池中铅作负极,电极反应式为Pb(s)+SO(aq)-2e-===PbSO4(s),因此当消耗1 mol即207 g铅时转移2 mol电子,而207 g钠可失去的电子为=9 mol,所以钠硫电池的理论放电量是铅蓄电池的=4.5倍。综上所述A、B、D正确,C错误。] 4.C [当闭合开关K时,b附近溶液先变红,即b附近有OH-生成,在b极析出氢气,b极是阴极,a极是阳极,与阴极连接的是原电池的负极,所以B极是负极,A极是正极。闭合K时,负极发生氧化反应,电极反应为2Na2S2-2e-===2Na++Na2S4,A项错误;闭合开关K时,b极附近先变红色,该极上生成H2和OH-,pH增大,B项错误;闭合K时,有0.01 mol Na+通过离子交换膜,说明有0.01 mol电子转移,阴极上生成0.005 mol H2,标准状况下体积为0.005 mol×22.4 L·mol-1=0.112 L=112 mL,C项正确;闭合开关K时,a极是阳极,该极上金属铜被氧化,电极反应为Cu-2e-===Cu2+,没有气体产生,D项错误。] 5.D [由放电时的反应可知,Fe发生氧化反应,Ni2O3发生还原反应,即正极为Ni2O3,负极为Fe,①错误;充电可以看作是放电的逆过程,即阴极为原来的负极,放电时负极反应式为Fe+2OH--2e-===Fe(OH)2,充电过程中阴极反应式为Fe(OH)2+2e-===Fe+2OH-,②正确;充电是放电的逆过程,即阴极为原来的负极,阳极为原来的正极,因此充电时,Ni(OH)2为阳极,③正确;Fe(OH)2、Ni(OH)2只能存在于碱性溶液中,在酸性条件下与H+反应,④正确。] 6.B [根据电池装置,Zn为负极,C为正极,正极上K2FeO4发生还原反应生成Fe(OH)3,电极反应式为:FeO+4H2O+3e-===Fe(OH)3+5OH-,A项正确;盐桥中阳离子向正极移动,即K+向左移动,B项错误;由图2知,高铁电池和高能碱性电池相比,使用时间长,工作电压稳定,C项正确;Zn电极电极反应式为Zn-2e-+2OH-===Zn(OH)2和正极组合,电池总方程式为:2K2FeO4+3Zn+8H2O===2Fe(OH)3+3Zn(OH)2+4KOH,故KOH总物质的量应增加。] 7.C [a极空气中氧气得电子发生还原反应,为正极,铁与水反应生成氢气,氢气在b极失电子发生氧化反应,为负极。在原电池中,阴离子向负极移动,O2-由a极移向b极,A项错误;a极空气中氧气得电子发生还原反应为正极,电极反应式为O2+4e-===2O2-,B项错误;由新型中温全瓷铁—空气电池的装置图可知,铁表面发生的反应为xH2O(g)+Fe===FeOx +xH2,C项正确;有22.4 L(标准状况)空气参与反应,则氧气约为0.2 mol,电路中约转移0.8 mol电子,D项错误。] 8.C [A项,根据原电池工作原理,阳离子向正极移动,错误;B项,充电时电池的负极要接电源的负极,电池的正极要接电源的正极,错误;C项,根据电池工作原理图,电池正极的电极反应式:NiOOH+H2O+e-===Ni(OH)2+OH-,充电是电解池,发生的电极反应式与原电池的电极反应式是相反的,即阳极电极反应式:Ni(OH)2+OH--e-===NiOOH+H2O,正确;D项,该电池的环境是碱性环境,不能有大量H+存在,电极反应式:MHn+nOH--ne-===M+nH2O,错误。] 9.A 10.D查看更多