- 2021-04-19 发布 |
- 37.5 KB |
- 10页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2017-2018学年辽宁省大石桥市第二高级中学高二上学期期初考试化学试题
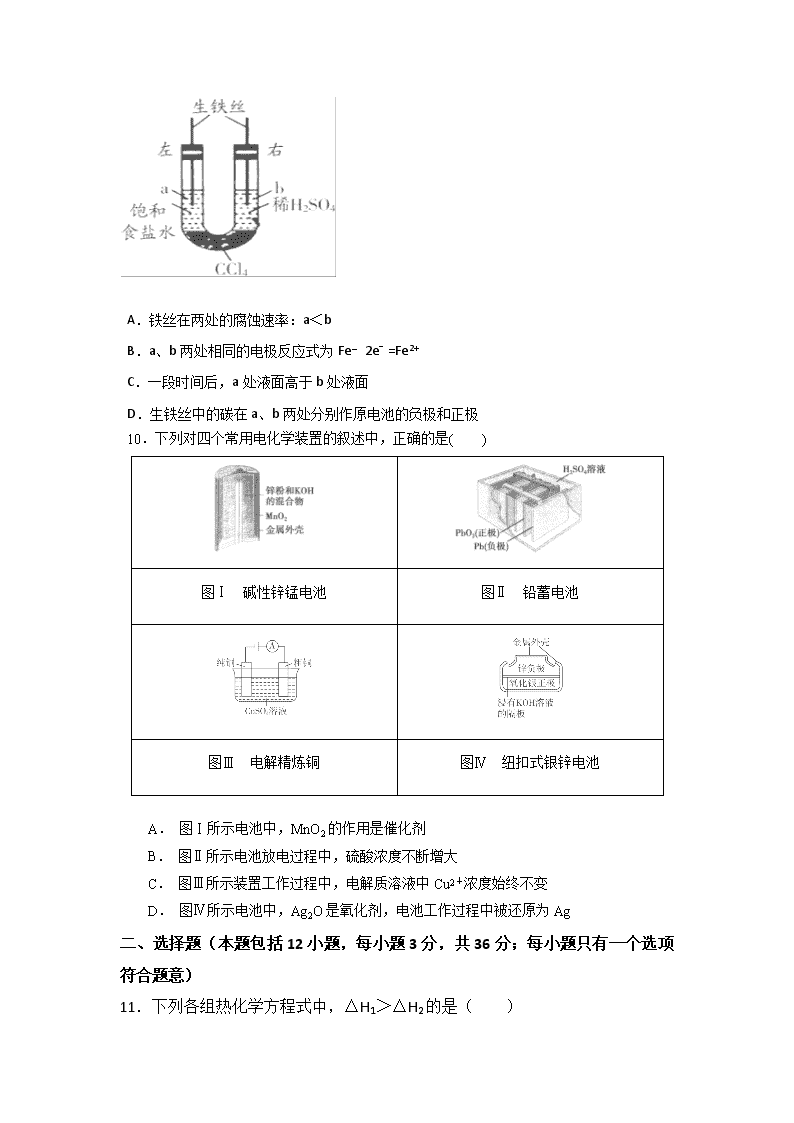
大石桥二高中2017-2018学年度上学期期初考试 高二年级化学科试卷 时间:90分钟 满分:100分 命题人:张晓丹 第I卷 相对原子质量:H 1 C 12 N 14 O 16 Na 23 S 32 Fe 56 Cu 64 Ag108 一、选择题(本题包括10小题,每小题2分,共20分;每小题只有一个选项符合题意) 1.化学与生活、社会密切相关。下列说法不正确的是 ( ) A.利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境 B.凡含有食品添加剂的食物对人体健康均有害,不可食用 C.为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术 D.提倡人们购物时不用塑料袋,是为了防止白色污染 2.下列说法正确的是 ( ) A.石油是混合物,汽油是纯净物 B.沸点:汽油>煤油>柴油>重油 C.直馏汽油和裂化汽油成分相同 D.蒸馏汽油的实验装置也可用来制取蒸馏水 3.设C+CO2⇌2CO △H>0 反应速率为υ1,N2+3H2⇌2NH3 △H<0 反应速率为υ2,对于上述反应,当温度升高时,υ1和υ2的变化情况为( ) A.同时增大 B.同时减小 C.增大,减小 D.减小,增大 4.在101kPa,任何温度下,都不可能自发进行的反应是( ) A.N2 (g) + 3H2 (g)2NH3 (g) ΔH <0 B.CaCO3(g)CaO (s) + CO2 (g) ΔH >0 C.2CO (g)2C (s) + O2 (g) ΔH >0 D.4NH3 (g) + 5O2 (g)4NO (g) + 6H2O (g) ΔH <0 5· 已知:HCN(aq)与NaOH(aq)反应的ΔH=-12.1kJ·mol﹣1 ;HCl(aq)与NaOH(aq)反应的ΔH=-55.6 kJ·mol﹣1kJ,则HCN在水溶液中电离的ΔH等于( ) A. +43.5kJ·mol﹣1 B.-43.5kJ·mol﹣1 C.-67.7 kJ·mol﹣1 D.+67.7 kJ·mol﹣1 6.下列各性质中不符合图示关系的是( ) A.还原性 B.与水反应的剧烈程度 C.熔点 D.原子半径 7.“绿色化学”是当今社会提出的一个新概念。在“绿色化学”工艺中,理想状态是反应中原子全部转化为欲制的产物,即原子利用率为100%。以下反应最符合绿色化学原子经济性要求的是 ( ) A.乙烯发生加聚反应制得聚乙烯高分子材料 B.用甲烷与氯气制备一氯甲烷 C.用苯和液溴为原料制取溴苯 D.用石灰石和稀盐酸反应制得二氧化碳 8·可逆反应:2NO2(g) 2NO(g) + O2(g),在体积不变的密闭容器中反应,一定达到平衡状态的标志是:①单位时间内生成n mol O2的同时生成2n mol NO2 ②单位时间内生成n mol O2的同时生成2n mol NO ③ν正(NO2)︰ν正(NO) ︰ν正(O2) =2︰2︰1的状态 ④混合气体的颜色不再改变的状态 ⑤混合气体的密度不再改变的状态 ⑥混合气体的平均相对分子质量不再改变的状态( ) A.①④ B.②③⑤ C.①④⑥ D.①④⑤ 9.如图装置中,在U形管底部盛有CCl4,分别在U形管两端小心倒入饱和食盐水和稀硫酸溶液,并使a、b两处液面相平,然后分别塞上插有生铁丝的塞子,密封好,放置一段时间后,下列有关叙述中错误的是( ) A.铁丝在两处的腐蚀速率:a<b B.a、b两处相同的电极反应式为Fe﹣2e﹣=Fe2+ C.一段时间后,a处液面高于b处液面 D.生铁丝中的碳在a、b两处分别作原电池的负极和正极 10.下列对四个常用电化学装置的叙述中,正确的是( ) 图Ⅰ 碱性锌锰电池 图Ⅱ 铅蓄电池 图Ⅲ 电解精炼铜 图Ⅳ 纽扣式银锌电池 A. 图Ⅰ所示电池中,MnO2的作用是催化剂 B. 图Ⅱ所示电池放电过程中,硫酸浓度不断增大 C. 图Ⅲ所示装置工作过程中,电解质溶液中Cu2+浓度始终不变 D. 图Ⅳ所示电池中,Ag2O是氧化剂,电池工作过程中被还原为Ag 二、选择题(本题包括12小题,每小题3分,共36分;每小题只有一个选项符合题意) 11.下列各组热化学方程式中,△H1>△H2的是( ) ①C(s)+O2(g)═CO2(g)△H1 C(s)+O2(g)═CO(g)△H2 ②S(g)+O2(g)═SO2(g)△H1 S(s)+O2(g)═SO2(g)△H2 ③H2(g)+O2(g)═H2O(l)△H1 2H2(g)+O2(g)═2H2O(l)△H2 ④CaCO3(s)═CaO(s)+CO2(g)△H1 CaO(s)+H2O(l)═Ca(OH)2(s)△H2. A.① B.②③④ C.③④ D.①②③ 12.下列说法中不正确的是( ) ①质子数相同的粒子一定属于同种元素 ②同位素的性质几乎完全相同 ③质子数相同,电子数也相同的两种粒子,不可能一种为分子,另一种为离子 ④电子数相同的粒子不一定是同一种元素 ⑤一种元素只能有一种质量数 ⑥某种元素的相对原子质量取整数,就是其质量数 A.①②④⑤ B.③④⑤⑥ C.②③⑤⑥ D.①②⑤⑥ 13.在密闭容器中进行反应:X(g)+3Y(g)⇌2Z(g),有关下列图象的说法正确的是( ) A.依据图a可判断正反应为吸热反应 B.在图b中,虚线可表示压强增大 C.若正反应的△H<0,图c可表示升高温度使平衡向逆反应方向移动 D.由图d中气体平均相对分子质量随温度的变化情况,可推知正反应的△H>0 14.某同学为了使反应2HCl+2Ag===2AgCl+H2↑能进行,设计了如下所示的四个实验方案,你认为可行的方案是( ) 15·俄罗斯用“质子﹣M”号运载火箭成功将“光线”号卫星送入预定轨道。发射用的运载火箭使用的是以液氢为燃烧剂,液氧为氧化剂的高能低温推进剂,已知: (1)H2(g)=H2(l)△H1=﹣0.92kJ·mol﹣1 (2)O2(g)=O2(l)△H2=﹣6.84kJ·mol﹣1 (3)能量变化如图: 下列说法正确的是( ) A.2mol H2(g)与1mol O2(g)所具有的总能量 比2molH2O(g)所具有的总能量低 B.氢气的燃烧热为△H=﹣241.8 kJ·mol﹣1 C.火箭液氢燃烧的热化学方程式 2H2(l)+O2(l)═2H2O(g)△H=﹣474.92kJ·mol﹣1 D.H2O(g)变成H2O(l)的过程中,断键吸收的能量小于成键放出的能量 16.锂空气电池是一种新型的二次电池,其放电时的工作原理如图所示,下列说法正确的是( ) A.该电池放电时,正极的电极反应为O2+4H++4e-===2H2O B.该电池充电时,阴极发生了氧化反应:Li++e-===Li C.电池中的有机电解液可以用稀盐酸代替 D.正极区产生的LiOH可回收利用 17.某温度下,E (g)+F(g)R(g)+N(g)的平衡常数K=4/9。该温度下在A、B、C三个恒容密闭容器中,投入E(g)、F(g),其起始浓度如下表,下列判断正确的是 ( ) 起始浓度 A B C c (E)/ mol•L-1 0.010 0.020 0.020 c (F)/ mol•L-1 0.010 0.010 0.020 A.平衡时,B中E的转化率为大于40% B.平衡时,A中和C中F的转化率均为40% C.平衡时,C中c(R)是A中的2倍,为0.012mol•L-1 D.反应开始时A和C中反应速率相等 18.下表为周期表中部分结构,下列判断正确的是( ) A.C元素位于周期表中第四周期ⅧB族 B.元素气态氢化物稳定性:D>E C.工业上制备D单质的氧化产物为CO D.E元素与氢元素形成H2E2的电子式为 H+[]2-H+ 19.在一密闭容器中,反应aA(g)⇌bB(g)达到平衡后,保持温度不变,将容器体积扩大到原体积的2倍,达到新的平衡后,B的浓度是原来的0.6倍,则下列叙述不正确( ) A.平衡向正反应方向移动 B.物质A的转化率增大 C.物质B的质量分数增加 D.a>b 20.如图为电解精炼粗银(含Al、Zn、Pt、Au等杂质)的示意图,其中b极有少量无色气体生成,该气体遇空气变红棕色,下列说法不正确的是( ) A.在电解过程中,含有杂质的粗银应是电极a B.b极生成气体的电极反应式为NO+3e-+4H+===NO↑+2H2O C.当纯银片增重2.16 g时,电路中通过0.02 mol电子 D.电解后Pt、Au以单质的形式沉积在a极下方 第II卷 三.非选择题(共50分) 21·(8分)全球海水中的溴的储量丰富,约占地球溴总储量的99%,故溴有“海洋元素”之称,海水中溴含量为65mg·L-1。其工业提取法有: ⑴空气吹出纯碱吸收法。方法是将氯气通入到富含溴离子的海水中,使溴置换出来,再用空气将溴吹出,用纯碱溶液吸收,最后用硫酸酸化,即可得到单质溴。该方法涉及的反应有: ①_________________(写出离子反应方程式) ②3Br2+3CO32-=BrO3- +5Br-+3CO2↑; ③BrO3- +5Br-+6H+=3Br2+3H2O。 其中反应②中氧化剂是____________,③还原产物是___________ ⑵空气吹出SO2吸收法。该方法基本同⑴,只是将吹出的溴用SO2来吸收,使溴转化为氢溴酸,然后再用氯气氧化氢溴酸即得单质溴。写出溴与二氧化硫反应的化学方程式 ____________________ 。 ⑶溶剂萃取法。该法是利用单质溴在水中和萃取剂中溶解度的不同的原理来进行的。实验室中萃取用到的实验仪器名称是 ___________。下列可以用于海水中溴的萃取的试剂是 __________。(填序号)①乙醇(俗名酒精),②四氯化碳,③硝酸 22.(12分) 已知A、B、C、D都是短周期元素,原子半径D>C>A>B。已知A、B同周期, A、C同主族,C原子核内的质子数等于A、B原子核内的质子数之和,C原子最外层电子数是D原子最外层电子数的3倍。请回答下列问题: (1)A元素在周期表中的位置: ;B、D两元素形成的化合物的电子式: (2)元素B、C、D的简单离子半径的大小顺序: (用离子符号回答) (3)C、D两元素最高价氧化物对应水化物的碱性强弱关系: > (用化学式表示) (4)B、C形成的化合物与D的最高价氧化物对应水化物反应的化学方程式: (5)C的单质在D的最高价氧化物对应水化物的溶液中反应的离子方程式: 23 ·(16分)Ⅰ 一定温度下将6 mol A及6 mol B混合于2 L的密闭容 器中,发生如下反应:3A(g)+B(g)xC(g)+2D(g),经过5分钟后反应达到平衡,测得A的转化率为60%,C的平均反应速率是0.36 mol/(L·min)。求: (1)平衡时D的浓度=___________________。 (2)B的平均反应速率υ(B)= ___________________________。 (3)x=_________。 (4)开始时容器中的压强与平衡时的压强之比为______________(化为最简整数比)。 温度/℃ 400 500 830 平衡常数K 10 9 1 Ⅱ、在一个恒容反应器中发生反应:CO(g)+H2O(g)H2(g)+CO2(g),该反应的平衡常数随温度的变化如下表: 温度/℃ 400 500 830 平衡常数K 10 9 1 (1)该反应的正反应为 反应。(填“吸热”或“放热”) (2)830℃时,向反应器中投入1 mol CO(g)、2 mol H2O(g)、x mol H2(g)和0.5 mol CO2(g)发生上述反应,要使反应开始时向逆反应方向进行,x的取值范围是 。 (3)若反应器绝热,判断该反应达到平衡状态的标志是 (填序号) ①体系的压强不再发生变化 ②混合气体的密度不变 ③混合气体的平均相对分子质量不变 ④各组分的物质的量浓度不再改变 ⑤消耗1 mol H2O(g)的同时,生成1 molCO2 (g) (4)下图表示该反应在t1时刻达到平衡,在t2时刻因改变某个条件浓度变化的情况,图中t2时刻发生改变的条件可能是 (写出两种) 24.(14分)如下图装置所示,是用氢氧燃料电池B进行的某电解实验: A B (1)若电池B使用了亚氨基锂(Li2NH)固体作为储氢材料,其储氢原理是: Li2NH+H2===LiNH2+LiH ,则下列说法中正确的是________。 A.Li2NH中N的化合价是-1 B.该反应中H2既是氧化剂又是还原剂 C.Li+和H-的离子半径相等 D.此法储氢和钢瓶储氢的原理相同 (2)在电池B工作时: ①若用固体Ca(HSO4)2为电解质传递H+,则电子由________极流出,H+向______极移动 (填“a”或“b ”) 。 ②b极上的电极反应式为__________________________。 ③外电路中,每转移0.1 mol电子,在a极消耗________ L的H2(标准状况下)。 (3)若A中X、Y都是惰性电极,电解液W是滴有酚酞的饱和NaCl溶液,则B工作时: ①电解池中X极上的电极反应式是______________。在X极这边观察到的现象是____________。 ②检验Y电极上反应产物的方法是______________。 化 学 答 卷 一、选择题(每小题均只有一个选项符合题意,,共50分) 题号 1 2 3 4 5 6 7 8 9 10 答案 B D A C A C A C D D 题号 11 12 13 14 15 16 17 18 19 20 答案 C D C C C D B C D C 21.(8分)(1)2Br- +Cl2==2Cl- +Br2 溴单质 (1分) 溴单质(1分) (2)SO2+ Br2+2H2O ==HBr + H2SO4 (3)分液漏斗 (1分) ②(1分) Na+ [ : O : O : ]2- Na+ Na+ [ O ]2- Na+ : : 22.(12分) (1) 第2周期 ⅢA族 或、 (2) O2- > Na+ >Al3+ (3) NaOH >Al(OH)3 (4) Al2O3+2NaOH=2NaAlO2 + H2O (5) 2Al+2OH- +2H2O=2AlO2- + 3H2↑ 23. (16分 每空2分) Ⅰ.(1)1.2 mol·L–1 (2)0.12 mol·L–1·min–1 (3)3 (4)10:11 Ⅱ、(1)放热 (2)x >4 (3)①④ (4)降温、增加H2O(g)的量、减少H2(g)的量(任写两个即可) 24.(14分) (1)B (2)①a b(各1分) ②O2+4H++4e-===2H2O ③1.12 (3)①2H++2e-===H2↑ 溶液变红 ②用润湿的KI淀粉试纸接近Y极气体产物,变蓝,证明产生Cl2气查看更多