- 2021-04-19 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届新课标Ⅲ卷冲刺高考考前预热卷(五)化学试题卷
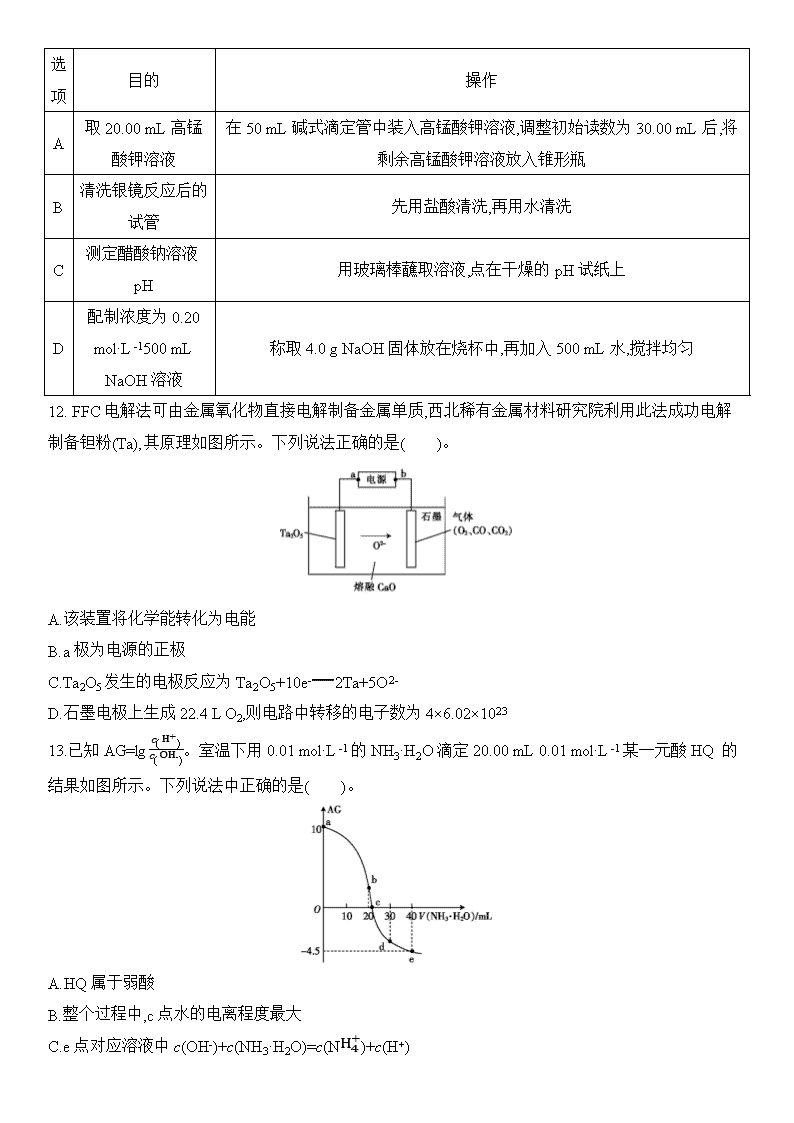
2020届新课标Ⅲ卷冲刺高考考前预热卷(五) 化学试题卷 考生注意: 1.本卷共100分,考试时间50分钟。 2. 答卷前,考生务必将自己的姓名、考生号、考场号和座位号填写在答题卡上。 3. 不得在本卷上答题,请将答案填写在答题卡指定区域。 可能用到的相对原子质量:H 1 C 12 N 14 O 16 P 31 S 32 Cl 35.5 Cu 64 Zn 65 一、选择题:本大题共7小题,每小题6分。在每小题给出的四个选项中,只有一项是符合题目要求的。 7. 2018年世界环境日主题为“塑战速决”。下列做法不应该提倡的是( )。 A.使用布袋替代一次性塑料袋购物 B.焚烧废旧塑料以防止“白色污染” C.用CO2合成聚碳酸酯可降解塑料 D.回收利用废旧塑料 8.下列关于有机化合物的说法错误的是( )。 A.纤维素属于天然高分子化合物 B.可用溴水来鉴别乙苯和苯乙烯 C.苯只能发生氧化反应和取代反应 D.葡萄糖和果糖互为同分异构体 9.设NA为阿伏加德罗常数的值。下列叙述正确的是( )。 A.4.0 g由CO2和SO2组成的混合物中含有的质子数为2NA B.2.24 L Cl2与CH4在光照下反应生成的HCl分子数为0.1NA C.常温下,0.1 mol环氧乙烷()中含有的共价键数为0.3NA D.4.2 g CaH2与水完全反应,转移的电子数为0.1NA 10. W、X、Y、Z为原子序数依次增大的四种短周期主族元素,W的简单氢化物与其最高价氧化物对应的水化物反应可生成一种离子化合物,Y的原子半径是所有短周期主族元素原子中最大的。由X、Y和Z三种元素形成的一种盐溶于水后,加入稀盐酸,有黄色沉淀析出,同时有刺激性气味的气体产生。下列说法不正确的是( )。 A.X的单质可以与W的氢化物发生置换反应生成W的单质 B.X与W、Y、Z都能形成两种或两种以上的化合物 C.Y与Z形成化合物的水溶液可使红色石蕊试纸变蓝 D.W的简单氢化物的热稳定性比X的强 11.下列实验操作规范且能达到目的的是( )。 选项 目的 操作 A 取20.00 mL高锰酸钾溶液 在50 mL碱式滴定管中装入高锰酸钾溶液,调整初始读数为30.00 mL后,将剩余高锰酸钾溶液放入锥形瓶 B 清洗银镜反应后的试管 先用盐酸清洗,再用水清洗 C 测定醋酸钠溶液pH 用玻璃棒蘸取溶液,点在干燥的pH试纸上 D 配制浓度为0.20 mol·L-1500 mL NaOH溶液 称取4.0 g NaOH固体放在烧杯中,再加入500 mL水,搅拌均匀 12. FFC电解法可由金属氧化物直接电解制备金属单质,西北稀有金属材料研究院利用此法成功电解制备钽粉(Ta),其原理如图所示。下列说法正确的是( )。 A.该装置将化学能转化为电能 B.a极为电源的正极 C.Ta2O5发生的电极反应为Ta2O5+10e-2Ta+5O2- D.石墨电极上生成22.4 L O2,则电路中转移的电子数为4×6.02×1023 13.已知AG=lgc(H+)c(OH-)。室温下用0.01 mol·L-1的NH3·H2O滴定20.00 mL 0.01 mol·L-1某一元酸HQ 的结果如图所示。下列说法中正确的是( )。 A.HQ属于弱酸 B.整个过程中,c点水的电离程度最大 C.e点对应溶液中c(OH-)+c(NH3·H2O)=c(NH4+)+c(H+) D.Kb(NH3·H2O)的数量级为10-5 二、非选择题:包括必考题和选考题两部分。第26~28题为必考题,每道题考生都必须作答。第35、36题为选考题,考生根据要求作答。 (一)必考题:共43分。 26.用硼镁矿(Mg2B2O5·H2O,含Fe2O3杂质)制取硼酸(H3BO3)晶体的流程如下。 回答下列问题: (1)沉淀的主要成分为 (填化学式)。 (2)写出生成Na2B4O5(OH)4·8H2O的化学方程式: 。 (3)检验H3BO3晶体洗涤干净的操作是 。 (4)已知: +H3BO3+2H2O, +NaOH+H2O 实验室利用此原理测定硼酸样品中硼酸的质量分数。准确称取0.3000 g样品于锥形瓶中,加入过量甘油,加热使其充分溶解并冷却,滴入1~2滴酚酞试液,然后用0.2000 mol·L-1NaOH标准溶液滴定至终点,消耗NaOH溶液22.00 mL。 ①滴定终点的标志为 。 ②该硼酸样品的纯度为 %(保留1位小数)。 (5)电解NaB(OH)4溶液制备H3BO3的工作原理如图。 ①b膜为 (填“阴离子”或“阳离子”)交换膜。理论上每生成1 mol H3BO3,两极室共生成 L气体(标准状况)。 ②N室中,进口和出口NaOH溶液的浓度:x% (填“>”或“<”)y%。 27.以SO2、软锰矿(主要成分为MnO2,少量Fe、Al、Ca及Pb的化合物等)、氨水及净化剂等为原料可制备MnSO4溶液和Mn3O4,主要实验步骤如下: 步骤Ⅰ:如图所示装置,将SO2通入B中的软锰矿浆液中(MnO2+SO2MnSO4)。 步骤Ⅱ:充分反应后,在不断搅拌下依次向仪器R 中加入适量纯净的MnO2、MnCO3,最后加入适量Na2S沉铅。 步骤Ⅲ:过滤得MnSO4溶液。 (1)仪器R的名称是 。 (2)装置A用于制取SO2,反应的化学方程式为 。 (3)装置B中的反应应控制在90~100 ℃,适宜的加热方式是 。 (4)装置C的作用是 。 (5)“步骤Ⅱ”中加入纯净MnO2的目的是 ,用MnCO3调节溶液pH时,需调节溶液pH的范围为 (该实验条件下,部分金属离子开始沉淀和沉淀完全的pH如下表)。 金属离子 Fe2+ Fe3+ Al3+ Mn2+ 开始沉淀的pH 7.04 1.87 3.32 7.56 沉淀完全的pH 9.18 3.27 4.9 10.2 (6)已知:①用空气氧化Mn(OH)2浊液可制备Mn3O4,主要副产物为MnOOH;反应温度和溶液pH对产品中Mn的质量分数的影响分别如图所示: ②反应温度超过80 ℃时,Mn3O4的产率开始降低,Mn(OH)2是白色沉淀,Mn3O4呈黑色;Mn3O4、MnOOH中锰的质量分数的理论值依次为72.05%、62.5%。请补充完整由步骤Ⅲ得到MnSO4溶液,并用氨水等制备较纯净的Mn3O4的实验方案: ,真空干燥6 h得产品Mn3O4。 28.元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4-(绿色)、Cr2O72-(橙红色)、CrO42-(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题: (1)Cr3+与Al3+的化学性质相似。在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是 。 (2)CrO42-和Cr2O72-在溶液中可相互转化。室温下,初始浓度为1.0 mol·L-1的Na2CrO4溶液中c(Cr2O72-)随c(H+)的变化如图所示。 ①用离子方程式表示Na2CrO4溶液中的转化反应 。 ②由图可知,溶液酸性增大,CrO42-的平衡转化率 (填“增大”“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为 。 ③升高温度,溶液中CrO42-的平衡转化率减小,则该反应的ΔH 0(填“大于”“小于”或“等于”)。 (3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl-,利用Ag+与CrO42-生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好沉淀完全(浓度等于1.0×10-5 mol·L-1)时,溶液中c(Ag+)为 mol·L-1,此时溶液中c(CrO42-)等于 mol·L-1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×10-12和2.0×10-10) (4)+6价铬的化合物毒性较大,常用NaHSO3将废液中的Cr2O72-还原成Cr3+,该反应的离子方程式为 。 (二)选考题:共15分。请考生从给出的2道化学题中任选一题作答。如果多做,则按第一题计分。 35.[化学——选修3:物质结构与性质](15分) 已知X、Y、Z、R都是周期表中前四周期的元素,它们的核电荷数依次增大。X是空气中含量最高的元素,Z的基态原子核外K、L、M三层电子数之比为1∶4∶2,R的基态原子的3d原子轨道上的电子数是4s原子轨道上的4倍,Y的基态原子的最外层电子数等于Z、R基态原子的最外层电子数之和。(答题时,X、Y、Z、R用所对应的元素符号表示) (1)X、Y、Z的第一电离能由小到大的顺序为 。 (2)R3+基态核外电子排布式为 。 (3)化合物Z3X4熔点在1900 ℃以上,硬度很大。该物质的晶体类型是 。 (4)Y、Z形成的某晶体的晶胞结构如图所示,则该化合物的化学式为 。 (5)R2+与过量的氨水形成的配离子的化学式为[R(NH3)6]2+,1 mol [R(NH3)6]2+中含有σ键的数目为 。 36.[化学——选修5:有机化学基础](15分) 吡贝地尔()是多巴胺能激动剂,合成路线如下: 已知:①;; ②D的结构简式为。 (1)A的名称是 。 (2)E→F的反应类型是 。 (3)G的结构简式为 ;1 mol B最多消耗NaOH或Na的物质的量之比为 。 (4)D+H→吡贝地尔反应的化学方程式为 。 (5)D的同分异构体中满足下列条件的有 种(碳碳双键上的碳原子不能连羟基),其中核磁共振氢谱有5种峰且峰面积之比为2∶2∶1∶1∶1的结构简式为 (写出一种即可)。 ①与FeCl3溶液发生显色反应; ②苯环上有3个取代基; ③1 mol该同分异构体最多消耗3 mol NaOH。 (6)已知:。参照上述合成路线,以苯和硝基苯为原料(无机试剂任选)合成,设计制备的合成路线: 。 参考答案 7 8 9 10 11 12 13 B C A D C C D 26(1)Mg(OH)2、Fe2O3 (2)4NaB(OH)4+2CO2+3H2ONa2B4O5(OH)4·8H2O↓+2NaHCO3 (3)取少许最后一次洗涤液于试管中,滴加硝酸酸化的硝酸银溶液,若无明显现象,说明洗涤干净 (4)①溶液由无色变为浅红色,且半分钟内不褪色 ②90.9 (5)①阴离子 16.8 ②< 27 (1)三颈烧瓶 (2)Na2SO3+H2SO4Na2SO4+SO2↑+H2O (3)水浴加热 (4)吸收未反应的SO2,防止污染环境 (5)将Fe2+氧化为Fe3+ 4.9≤pH<7.56 (6)将滤液加热并保温在60~80 ℃,用氨水调节溶液pH并维持在8~9;在不断搅拌下,边通空气边滴加氨水,直至有大量黑色沉淀产生,静置,在上层清液中再滴加氨水至无沉淀产生;过滤,洗涤沉淀直至滤液中检测不出SO42- 28 (1)蓝紫色溶液变浅,同时有灰蓝色沉淀生成,然后沉淀逐渐溶解形成绿色溶液 (2)①2CrO42-+2H+Cr2O72-+H2O ②增大 1.0×1014 ③小于 (3)2.0×10-5 5.0×10-3 (4)Cr2O72-+3HSO3-+5H+2Cr3++3SO42-+4H2O 35 (1)Si查看更多
相关文章
- 当前文档收益归属上传用户
- 下载本文档