2019届高考化学二轮复习物质结构与性质学案
专题十四 物质结构与性质
命题热点提炼
三年考情汇总
核心素养链接
1.原子结构与性质
2018·Ⅰ卷T35(1)(2),Ⅱ卷T35(1),Ⅲ卷T35(1)(2)
2017·Ⅰ卷T35(1)(2),Ⅱ卷T35(1)(2),Ⅲ卷T35(1)
2016·Ⅰ卷T37(1)(4),Ⅱ卷T37(1)(3),Ⅲ卷T37(1)(2)
1.模型认知——能运用原子结构和分子结构模型(构造原理、杂化、价电子对互斥)、晶体结构模型来描述和解释化学现象,预测物质及其变化的可能结果等。
2.微观探析——能从原子、分子层面理解物质组成、结构和性质的联系;能根据物质的微观结构预测物质在特定条件下可能具有的性质和可能发生的变化。
3.证据推理——能从有关数据推导物质结构中有关性质的变化规律。
2.分子结构与性质
2018·Ⅰ卷T35(3)(4),Ⅱ卷T35(2)(3)(4),Ⅲ卷T35(3)(4)
2017·Ⅰ卷T35(3),Ⅱ卷T35(3),Ⅲ卷T37(3)(4)
2016·Ⅰ卷T37(3)(5),Ⅱ卷T37(2),Ⅲ卷T37(3)
3.晶体结构与性质
2018·Ⅰ卷T35(5),Ⅱ卷T35(5),Ⅲ卷T35(5)
2017·Ⅰ卷T35(2)(4)(5),Ⅱ卷T35(4),Ⅲ卷T37(5)
2016·Ⅰ卷T37(3)(6),Ⅱ卷T37(4),Ⅲ卷T37(4)(5)
■真题再做——感悟考法考向
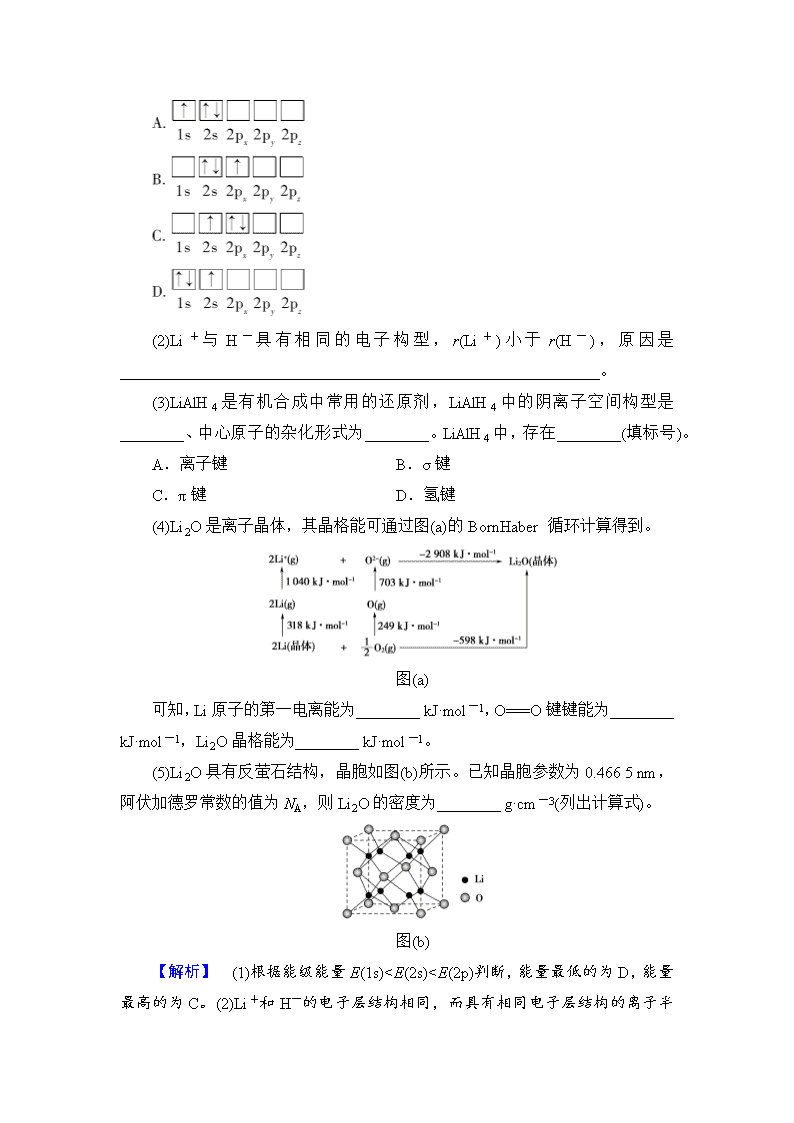
1.(2018·全国卷Ⅰ)Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻、能量密度大等优良性能,得到广泛应用。回答下列问题:
(1)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为________、________(填标号)。
(2)Li+与H-具有相同的电子构型,r(Li+)小于r(H-),原因是____________________________________________________________。
(3)LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子空间构型是________、中心原子的杂化形式为________。LiAlH4中,存在________(填标号)。
A.离子键 B.σ键
C.π键 D.氢键
(4)Li2O是离子晶体,其晶格能可通过图(a)的BornHaber循环计算得到。
图(a)
可知,Li原子的第一电离能为________ kJ·mol-1,O===O键键能为________ kJ·mol-1,Li2O晶格能为________ kJ·mol-1。
(5)Li2O具有反萤石结构,晶胞如图(b)所示。已知晶胞参数为0.466 5 nm,阿伏加德罗常数的值为NA,则Li2O的密度为________ g·cm-3(列出计算式)。
图(b)
【解析】 (1)根据能级能量E(1s)
Ge>Zn
(5)sp3 共价键
(6)① ②×107
6.(2016·全国卷Ⅲ)
砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。回答下列问题:
(1)写出基态As原子的核外电子排布式__________________________。
(2)根据元素周期律,原子半径Ga________As,第一电离能Ga________As。(填“大于”或“小于”)
(3)AsCl3分子的立体构型为________,其中As的杂化轨道类型为________。
(4)GaF3的熔点高于1 000 ℃,GaCl3的熔点为77.9 ℃,其原因是____________________________________________________________。
(5)GaAs的熔点为1 238 ℃,密度为ρ g·cm-3,其晶胞结构如图所示。该晶体的类型为________,Ga与As以________键键合。Ga和As的摩尔质量分别为MGa g·mol-1和MAs g·mol-1,原子半径分别为rGa pm和rAs pm,阿伏加德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为________。
【解析】 (1)As元素在周期表中处于第ⅤA族,位于P元素的下一周期,则基态As原子核外有33个电子,根据核外电子排布规律写出其核外电子排布式:1s22s22p63s23p63d104s24p3或[Ar]3d104s24p3。(2)同周期主族元素的原子半径随原子序数的递增而逐渐减小,Ga与As在周期表中同位于第四周期,Ga位于第ⅢA族,则原子半径:Ga>As。Ga、As原子的价电子排布式分别为4s24p1、4s24p3,其中As原子的4p轨道处于半充满的稳定状态,其第一电离能较大,则第一电离能:Ga离子晶体>分子晶体。
金属晶体的熔、沸点差别很大,如钨、铂等熔点很高,汞、铯等熔点很低。
(2)同类型晶体的熔、沸点高低一般规律
①原子晶体
由共价键形成的原子晶体中,原子半径小的键长短,键能大,晶体的熔、沸点高。如熔点:金刚石>碳化硅>硅。
②离子晶体
一般地说,阴、阳离子的电荷数越多,离子半径越小,则离子间的作用力就越强,其晶体的熔、沸点就越高,如熔点:MgO>NaCl>CsCl。
③分子晶体
a.分子间作用力越大,物质的熔、沸点越高;具有氢键的分子晶体熔、沸点反常地高。如H2O>H2Te>H2Se>H2S。
b.组成和结构相似的分子晶体,相对分子质量越大,熔、沸点越高。SnH4>GeH4>SiH4>CH4。
c.组成和结构不相似的分子晶体(相对分子质量接近),分子的极性越大,其熔、沸点越高。如CO>N2,CH3OH>CH3CH3。
④金属晶体
金属离子半径越小,离子电荷数越多,金属键越强,金属熔、沸点就越高。如熔、沸点:Al>Mg>Na。
2.晶胞计算的思维方法
(1)“均摊法”原理
(2)立方体晶胞中各线段之间的关系
(3)晶体微粒与M、ρ之间的关系
若1个晶胞中含有x个微粒,则1 mol晶胞中含有x mol微粒,其质量为xM g(M为微粒的相对“分子”质量);1个晶胞的质量为ρV g(V为晶胞的体积),则1 mol晶胞的质量为ρVNA g,因此有xM=ρVNA。注意计算V时要注意晶胞的立体形状灵活计算。
(4)晶胞中原子空间利用率=×100%。
■模拟尝鲜——高考类题集训
1.(2018·各地模拟题精选)(1)PrO2的晶胞结构与CaF2相似,晶胞中Pr原子位于面心和顶点。则PrO2晶胞中有________个氧原子。Ce单质为面心立方最密堆积,其晶胞参数为a=516
pm。晶胞中Ce原子的配位数为______,Ce单质的密度为________g·cm-3(列式即可)。
(2)Cu单质的晶胞结构如图a所示,
图a
原子采取面心立方最密堆积。若已知Cu原子半径为d,NA表示阿伏加德罗常数的值,摩尔质量为M。
①该原子的配位数为________;
②该晶体的密度为________(用相应的字母表示);
③该晶胞的空间利用率为________。
(3)图b为碳化钨晶体结构的一部分,碳原子嵌入金属钨的晶格的间隙,并不破坏原有金属的晶格,形成填隙固溶体。①在此结构中,1个钨原子周围距离该钨原子最近的碳原子有________个,该晶体的化学式为________。
图b
②该部分晶体的体积为V cm3,则碳化钨的密度为______g·cm-3(用NA表示阿伏加德罗常数的值)。
【解析】 (1)在如图所示晶胞中,Y为镨原子,X为氧原子,氧原子在晶胞的内部,故此晶胞中应有8个氧原子。Ce单质为面心立方最密堆积,以晶胞顶点的Ce原子为例,与之距离最近且相等的Ce原子有12个,晶胞中Ce原子位于顶点和面心,1个晶胞中含Ce原子的数目为8×+6×=4,该晶胞体为a3,该晶胞的质量为,根据ρ=可知,ρ==
g·cm-3。
(2)①由题图a可知,以顶点的Cu原子进行分析,位于面心的原子与之距离最近,故其配位数为12;②Cu原子半径为d,其面对角线长度为4d,立方体的棱长为×4d=2d,则晶胞体积为(2d)3=16d3,晶胞中含Cu原子的数目=8×+6×=4,故晶体的密度==;③晶胞为面心立方最密堆积,该晶胞的空间利用率==×100%=×100%。
(3)①根据图b,距离一个钨原子最近的碳原子的个数为6,钨原子位于顶点、棱上、面上、内部,属于该晶胞的个数为12×+6×+2×+1=6,6个碳原子位于内部,即化学式为WC。②晶胞的质量为 g,根据密度的定义可知,WC的密度为 g·cm-3。
【答案】 (1)8 12
(2)①12 ② ③×100%
(3)①6 WC ②
2.(2018·各地模拟精选)(1)Mn与Re属于同一族,研究发现,Mn的熔点明显高于Re的熔点,原因可能是________________________。
(2)CuSO4的熔点为560 ℃,Cu(NO3)2的熔点为115 ℃,CuSO4熔点更高的原因是______________。
(3)根据下表提供的数据判断,熔点最高、硬度最大的是________(填化学式)。
离子晶体
NaF
MgF2
AlF3
晶格能/(kJ·mol-1)
923
2 957
5 492
(4)已知金刚石结构中C—C比石墨结构中C—C的键长长,则金刚石的熔点________石墨的熔点(填“高于”或“低于”或“等于”)理由是____________________________________________________________。
【答案】 (1)Mn的金属键比Re的金属键强
(2)CuSO4和Cu(NO3)2均为离子晶体,SO所带电荷比NO大,故CuSO4晶格能较大,熔点较高
(3)AlF3
(4)低于 键长越长,键能越小,键越不稳定,熔点越低
3.利用新制的Cu(OH)2检验醛基时,生成红色的Cu2O,其晶胞结构如下图所示。
(1)该晶胞原子坐标参数A为(0,0,0);B为(1,0,0);C为。则D原子的坐标参数为________,它代表__________________原子。
(2)若Cu2O晶体的密度为d g·cm-3,Cu和O的原子半径分别为rCu pm和rO pm,阿伏加德罗常数值为NA,列式表示Cu2O晶胞中原子的空间利用率为____________________________________________________________
____________________________________________________________。
【解析】 (1)根据晶胞的结构,D在A和C中间,因此D的坐标是,白色的原子位于顶点和体心,个数为8×+1=2,D原子位于晶胞内,全部属于晶胞,个数为4,根据化学式,推出D为Cu。(2)空间利用率是晶胞中球的体积与晶胞体积的比值,晶胞中球的体积为(4×πr+2×πr)×10-30cm3,晶胞的体积可以采用晶胞的密度进行计算,即晶胞的体积为 cm3
,因此空间利用率为×100%。
【答案】 ① Cu
②×100%(答案合理即可)