- 2021-04-19 发布 |
- 37.5 KB |
- 14页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学基于阶段目标达成的电化学基础单元复习
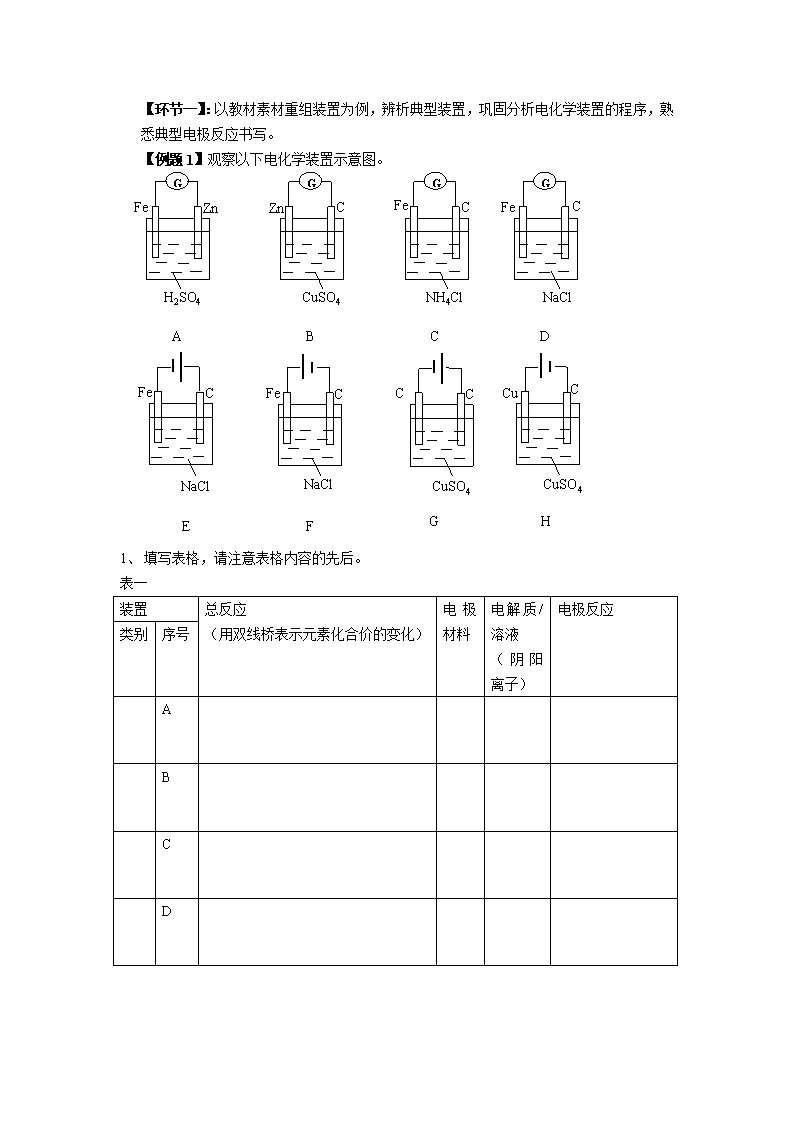
高考化学基于阶段目标达成的电化学基础单元复习 以“电化学复习”为关键词在“中国知网”搜索结果有50条记录,其中23篇的题目中含有“电化学”,研究的都是“高三备考复习的策略”,虽然对学生的困难分析深入,解决问题的策略独特,但是重点都是研究如何提高学生对知识的综合运用能力和解题技巧,与现在单元复习的目标不同。 根据《化学课程标准》和“学业评价标准” 对本章的要求和说明,考虑到该板块的复习基本有四次:单元复习、模块复习、高三第一轮复习、高三专题复习,每阶段复习的目标定位要准确,逐层递进,螺旋式上升,引领学生巩固基础,深化理解,学会应用。通过练习、测试的反馈,还有与学生的讨论,发现学生的思维障碍点主要是: 1、 对氧化还原反应的基本概念遗忘或不熟练,影响对电极反应本质的判断(出错或慢) 2、 原电池、电解池的概念相似性高,区分不清造成混乱。 3、 不能从物质的氧化性、还原性强弱判断电极反应物。 4、 对双液原电池的盐桥理解不准确,与原电池、电解池串联装置中连接电极的导线混淆 5、 电极反应书写中出现表示得失电子、得失电子数值、电荷守恒配平、电解质与电极反应产物反应的考虑等错误 6、 电化学装置中微粒(电子、离子)的移动方向的判断,装置中离子浓度变化的判断和计算。 7、 对陌生的原电池装置找不到“自发的氧化还原反应”,影响对装置工作原理的理解。 8、 对分析电化学装置的思路不清楚或不熟练。 第一阶段——例题,小结:先理清化学概念、原理、用语、实验等陈述性知识,这是解决问题的基础;然后明确解决问题的程序。解决同一类问题往往有固定的程序。这个程序告诉你“怎么做、怎么想”,它告诉你如何从已知状态向目标状态转化。第二阶段——精练:通过强化练习促使陈述性知识向程序性知识转化。教师要多留时间给学生思考,多听学生的思考,多让学生分析。“产生式”不仅靠教师总结,更需要学生概括、领悟。 在本单元复习中,主要目标是梳理知识、认识典型、巩固基础,深化理解、熟练思路,学会应用。 【环节一】:以教材素材重组装置为例,辨析典型装置,巩固分析电化学装置的程序,熟悉典型电极反应书写。 【例题1】观察以下电化学装置示意图。 A G Zn Fe H2SO4 D G Fe C NaCl G C Fe C NH4Cl B G Zn C CuSO4 E Fe C NaCl F Fe C NaCl H C Cu CuSO4 G C C CuSO4 1、 填写表格,请注意表格内容的先后。 表一 装置 总反应 (用双线桥表示元素化合价的变化) 电极材料 电解质/溶液 (阴阳离子) 电极反应 类别 序号 A B C D 表二 装置 电源与电极的关系 电极材料 电解质/溶液 (阴阳离子) 电极区物质的氧化性、还原性顺序 电极反应 总反应 类别 序号 E F G H 2、填空 (1)装置C中石墨电极(C)上的现象 ,结合平衡移动原理解析和电极方程式解析产生该现象的原因: 。 (2)装置D是铁合金的 腐蚀,电化学反应后在溶液中继续发生的反应是: 。以上装置中对于铁能实现“牺牲阳极的阴极保护”的是: ,属于“外加电流的阴极保护法”的是 。 (3)装置E工作一段时间后分别在两电极附近滴加1~2滴酚酞溶液,现象是: ,结合平衡移动原理解析和电极方程式解析产生该现象的原因: , 总反应的离子方程式是 。 (4)装置G工作一段是间后的现象是: ,溶液的pH (变大、变小、不变、不能确定)。 (5)装置H的作用是: ;若把装置更改为实现“粗铜精炼”(粗铜中含有少量Zn、Fe、Ag和石墨),则阳极反应 ,阴极反应 ,溶液中c(Cu2+) 。 (6)冶炼金属钠可以在装置E中把 改为 ,反应方程式是: 。 【小结】1、熟练的典型电化学模型 2、根据表格内容,形成分析电化学装置的基本流程 3、原电池是基于“自发的氧化还原反应”而设计的把化学能转化为电能的装置,所以正反应物是氧化性较明显的物质(如Ag+ 、Fe3+ 、Cu2+、 H+ 、氧气、氯气、MnO2等)负极都是还原性比较强的物质(如金属、氢气、一氧化碳、甲烷、乙醇等)。 4、电解池的电源是强大的氧化剂和还原剂,使“非自发的氧化还原反应”得以发生,实现电能转化为化学能的装置。所以阴、阳极的反应物可以是氧化性不强的物质(如Na+ 、Al3+)和还原性不强的物质(如Cl-、OH-) 5、无论是原电池还是电解池,在电极上放电的顺序都是“先强后弱” 【精练】 1.某同学为了使反应2HCl + 2Ag2AgCl + H2↑能进行,设计了下列四个实验,如下图所示,你认为可行的方案是 2.下列图示中关于铜电极的连接错误的是 : 【环节二】以铅蓄电池为例复习二次电池的分析方法。 【例题2】铅蓄电池的典型的二次电池,电池反应为: 放电 充电 PbO2 + Pb + 2H2SO42PbSO4 + 2H2O (1) 在反应方程式上用双线桥 表示放电过程得失电子、氧化反应、还原反应的情况。 (2) 放电过程是 (原电池/电解池)装置, 还原剂是 ,氧化剂是 , 负极反应: 正极反应: , 溶液的pH变化是 。 (3) 在铅蓄电池工作原理示意图中,请在方框内补充充电时所需用品的示意图。 分别表示放电、充电时,电子、阴阳离子的移动方向; (4) 充电过程的阳极反应: ,若通电一段时间,蓄电负极质量 减少9.6g,则在导线上通过的电子为 mol。 【小结】1、氧化还原反应的基本概念:失升氧还原剂,得降还氧化剂 2、原电池(放电): 负极氧化,电子流出,阴离子靠近;(正极还原,电子流入,阳离子靠近) 3、电解池(充电) 阳极氧化,电子流出,阴离子靠近;(阴极还原,电子流入,阳离子靠近) 4、用“画圈”的方法帮助学生掌握电子、电流、离子的流动方向 【精练】 1.(2011广东高考6改) 某小组为研究电化学原理,设计如图装置。 (1)a和b不连接时,可观察的现象是 , 反应的离子方程式是 ; (2)a和b用导线连接时,形成 装置, 铁是 极,电极反应是 ;铜的作用是 , 电极反应是 。导线中电子移动的方向是: ,溶液中离子移动的方向是: 。 (3)a和b分别连接直流电源正、负极,形成 装置,铜是 极,电极反应是 ,铁是 极,电极反应是 。溶液中离子移动的方向是 。 (4)若在(3)装置中外电路通过0.1mol电子,则铁电极的质量 增加 g。 2.LiFePO4电池具有稳定性高、安全、对环境友好等优点,可用于电动汽车。电池反应 放电 充电 为FePO4+Li LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含Li+ 导电固体为电解质。下列有关LiFePO4电池说法正确的是 A.可加入硫酸以提高电解液的导电性 B.放电时电池内部Li+向负极移动 C.充电过程中,电池正极材料的质量增加 D.放电时电池正极反应为FePO4+Li++e-===LiFePO4 放电 充电 ★3.高铁电池的总反应为:3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH 放电时正极反应为: 。 【环节三】:以原电池电解池串联装置为例进一步巩固分析电化学装置的程序,掌握电极方程式书写的基本方法。 【例题3】如图所示,回答问题ZnSO4 溶液 隔膜 (只允许SO42 -通过) CuSO4 溶液 滤纸 (滴加了Na2SO4、酚酞溶液) 表面皿 Y Zn Cu 铜丝 X (1)下列叙述正确的是: A.Y为阴极,发生还原反应 B.X为正极,发生氧化反应 C.Y与滤纸接触处有氧气生成 D.X与滤纸接触处变红 (2)SO42-离子通过隔膜的方向是 。 (3)铜丝X的电极反应 ,铜丝Y的电极反应 ,表面皿中的总反应 。 【小结】电极方程式书写的常见错误和纠错方法 1、 电极反应物出错,(如:铁合金的吸氧腐蚀中的正极反应物错认为是H+,电解池中的活泼电极做阳极 ) 纠错方法:有些什么物质(电极材料、电极区域的物质、阴阳离子移动),先排序(氧化性、还原性)后写反应 2、 电极反应中“+”,“-”用错。 纠错方法:负氧失减,阳氧失减 3、 电极反应不完整(如:燃料电池中溶液的酸碱性在电极反应中的体现) 纠错方法:先电极上反应后电解质中反应,先电荷守恒后质量守恒(考虑溶液酸碱性) 4、 总反应出错或用总反应减去一个半反应得出另一个半反应出错 纠错方法:先得失电子相等后加、减反应 【精练】 1.用铅蓄电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极)。下列说法中正确的是__________。 A.铅蓄电池负极的反应式为:Pb-2e-=Pb2+ B.铅蓄电池放电时,B极质量减轻,A极质量增加 C.铅蓄电池充电时,A极应与外电源负极相连 D.电解苦卤水时,a电极首先放电的是Br- 2.下图是一个化学过程的示意图。已知甲池的总反应式为:2CH3OH+3O2+4KOH===2K2CO3+6H2O (1)请完成图中甲、乙两池的名称。甲池是________装置,乙池是________装置。 (2)请完成下列电极的名称: 通入CH3OH的电极名称是________,B(石墨)电极的名称是________。 (3)写出下列电极反应式: 通入O2的电极的电极反应式是_____________________。 A(Fe)电极的电极反应式为_________________________。 (4)乙池中反应的化学方程式为______________________。 (5)当乙池中A(Fe)极的质量增加5.40 g时,甲池中理论上消耗O2________mL(标准状况下)。 3.Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如下。该电池工作时,下列说法正确的是 A.Mg 电极是该电池的正极 B.H2O2 在石墨电极上发生氧化反应 C.石墨电极附近溶液的pH 增大 D.溶液中Cl-向负极移动 【环节四】:以Zn/ZnSO4‖KCl盐桥‖Cu/CuSO4电池为例,掌握电化学装置的设计及表达 【例题3】(2010广东)23. 铜锌原电池(如图9)工作时,下列叙述正确的是 A.正极反应为:Zn-2e-=Zn2+ B.电池反应为:Zn+Cu2+=Zn2++Cu C.在外电路中,电子从负极流向正极 D.盐桥中的K+移向ZnSO4溶液 【小结】1、双液原电池的优点:分隔氧化剂与还原剂,避免电池“内耗” 2、盐桥的意义:正负极区电解质以外的电解质,保证内电路上有阴阳离子的定向移动而形成闭合回路,保持两电极区溶液的电中性,是电池能够持续工作。 3、负极(区):还原剂+ 电解质/溶液(不与电极材料反应) 正极(区):导体(还原性比负极弱)+ 氧化剂 盐桥:电解质溶液(不与正负极区电解质反应)+载体(琼胶、滤纸、棉线等) 【精练】 盐桥 X Y A CuSO4溶液 电流计 Ag 1.依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s) 设计的原电池如图所示。请回答下列问题: (1)电极X的材料是 ;电解质 溶液Y是 ; (2)银电极为电池的 极,发生的 电极反应为 ; X电极上发生的电极反应为 ; (3)外电路中的电子是从 电极流向 电极。盐桥中的阳离子从 电极流向 电极。 2.单液原电池效率不高,电流在短时间内就会衰减。请将反应2FeCl3+Cu===2FeCl2+CuCl 设计一个双液原电池装置。请在下面右边方框中画出该原电池装置,标明电极材料和电解 质溶液。 选修4第四章《电化学基础》 《化学课程标准》对本章的要求: 1.体验化学能与电能相互转化的探究过程,了解原电池和电解池的工作原理,能写出电极反应和电池反应方程式。 2.通过查阅资料了解常见化学电源的种类及其工作原理,认识化学能与电能相互转化的实际意义及其重要应用。 3.能解释金属发生电化学腐蚀的原因,认识金属腐蚀的危害,通过实验探究防止金属腐蚀的措施。 第一节 原电池 1、通过观察 “Cu-Zn(CuSO4溶液)”原电池装置产生电流过程中的系列现象(如:电流强度变化、电极表面现象、电解质溶液温度变化等),感受“氧化剂和还原剂直接接触”的原电池装置在实现能量转化的过程中存在效率问题,进一步体会能量间可以相互转化及转化过程中能量守恒。 2、通过观察“Cu-Zn(盐桥)”原电池装置特点及产生电流的实验现象,分析形成电流的微观过程,了解盐桥的作用,进一步了解“氧化剂和还原剂完全隔离”的原电池装置的反应原理。 3、能够根据电极材料、氧化还原反应原理判断电池正、负极,写出电极反应式和电池反应方程式。 4、能够根据具体的氧化还原反应,设计简单原电池装置。 5、经历“Cu-Zn(CuSO4溶液)”原电池装置到“Cu-Zn(盐桥)”原电池装置改进的分析过程,感受科学研究中发现问题、分析问题、解决问题的探究过程。 第二节 化学电源 1、能够说出常见化学电池的分类、优点及质量优劣的判断标准。 2、知道一次电池、二次电池、燃料电池的基本构造、工作原理、性能和适用范围。 3、在给定电极材料、氧化还原反应原理等信息(查阅资料)的情况下,能够写出常见化学电源的电极反应式和总反应方程式。并形成书写电池电极反应式的一般思路:了解电池结构 ——明确存在的微粒——判断氧化、还原——分析电子得失——确定化合价变化——判断产物存在形式 4、通过学习各类电池的实际应用感受化学给人类带来的进步和文明。通过了解废旧电池对环境的危害,树立环保意识。 第三节 电解池 1、通过宏观(实验现象)——微观(电子、离子间的相互作用与运动方向)——符号(电解方程式)三重表征形成电解池的工作原理。知道电解质溶液的导电过程,就是电解质的电解过程,能够说出电离与电解的区别和联系。 2、通过观察,知道电解池装置的基本构造(包括电极与直流电源的连接方式)。通过与原电池装置进行比较,能够从电极名称、电极反应、能量转变形式、反应驱动力等方面进一步认识电解池与原电池的工作原理。 3、能够根据电解质溶液的组成和电极特点,运用氧化还原知识判断电解产物,并形成分析判断电极产物的一般思路:电极材料及电极的极性——溶液中存在的微粒——微粒的运动方向——分析得失电子的能力判断——化合价变化——产物存在形式。 4、通过查阅资料、观看录像等方式了解电解原理在工业生产中的应用,感受化学科学对人类生产生活的巨大影响。并能够运用电解原理和判断电极产物的一般思路,分析氯碱工业、电镀、铜的精炼、金属电冶炼等过程中的能量与物质的转化。 第四节 金属的电化学腐蚀与防护 1、通过查阅资料、观看录像和图片等方式了解金属腐蚀的严重性和危害性,认识防止金属腐蚀的重要意义。 2、了解金属的化学腐蚀和电化学腐蚀的涵义,通过实验认识钢铁的吸氧腐蚀和析氢腐蚀发生的条件及原理,会书写电极反应式和总反应式。 3、运用原电池和电解池知识探究防止金属腐蚀的思路和方法,并通过实验验证牺牲阳极保护法的效果,感受运用化学知识解决实际问题的过程,激发学习兴趣。查看更多