- 2021-04-19 发布 |
- 37.5 KB |
- 5页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
中考化学总复习资料解题技巧与说明已调整
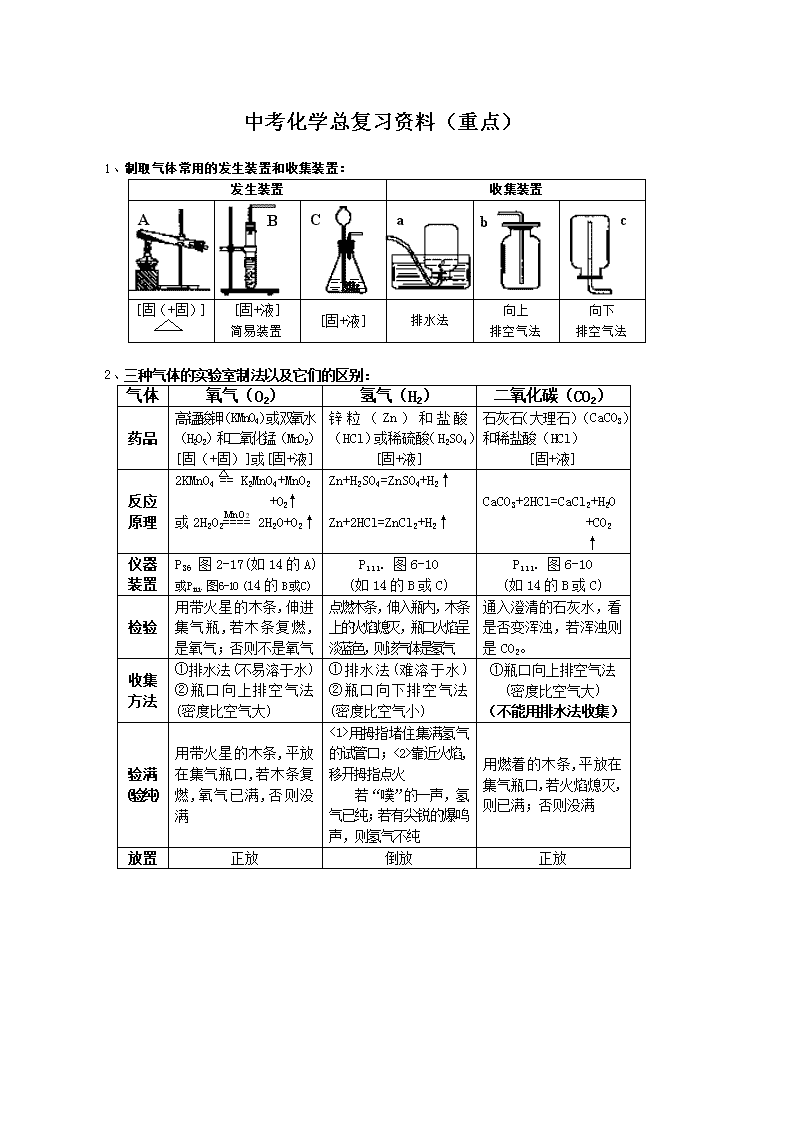
CA B a b c 中考化学总复习资料(重点) 1、制取气体常用的发生装置和收集装置: 发生装置 收集装置 [固(+固)] [固+液] 简易装置 [固+液] 排水法 向上 排空气法 向下 排空气法 2、三种气体的实验室制法以及它们的区别: 气体 氧气(O2) 氢气(H2) 二氧化碳(CO2) 药品 高锰酸钾(KMnO4)或双氧水 (H2O2)和二氧化锰(MnO2) [固(+固)]或[固+液] 锌 粒 ( Zn ) 和 盐 酸 (HCl)或稀硫酸(H2SO4) [固+液] 石灰石(大理石)(CaCO3) 和稀盐酸(HCl) [固+液] 反应 原理 2KMnO4 == K2MnO4+MnO2 +O2↑ 或 2H2O2==== 2H2O+O2↑ Zn+H2SO4=ZnSO4+H2↑ Zn+2HCl=ZnCl2+H2↑ CaCO3+2HCl=CaCl2+H2O +CO2 ↑ 仪器 装置 P36 图 2-17(如 14 的 A) 或P111. 图6-10(14 的 B或C) P111. 图 6-10 (如 14 的 B 或 C) P111. 图 6-10 (如 14 的 B 或 C) 检验 用带火星的木条,伸进 集气瓶,若木条复燃, 是氧气;否则不是氧气 点燃木条,伸入瓶内,木条 上的火焰熄灭,瓶口火焰呈 淡蓝色,则该气体是氢气 通入澄清的石灰水,看 是否变浑浊,若浑浊则 是 CO2。 收集 方法 ①排水法(不易溶于水) ②瓶口向上排空气法 (密度比空气大) ① 排水法(难溶于水) ②瓶口向下排空气法 (密度比空气小) ①瓶口向上排空气法 (密度比空气大) (不能用排水法收集) 验满 (验纯) 用带火星的木条,平放 在集气瓶口,若木条复 燃,氧气已满,否则没 满 <1>用拇指堵住集满氢气 的试管口;<2>靠近火焰, 移开拇指点火 若“噗”的一声,氢 气已纯;若有尖锐的爆鸣 声,则氢气不纯 用燃着的木条,平放在 集气瓶口,若火焰熄灭, 则已满;否则没满 放置 正放 倒放 正放 MnO2 注意 事项 ①检查装置的气密性 (当用第一种药品制取 时以下要注意) ②试管口要略向下倾 斜(防止凝结在试管口 的小水珠倒流入试管 底部使试管破裂) ③加热时应先使试管均匀受 热,再集中在药品部位加热。 ④排水法收集完氧气 后,先撤导管后撤酒精 灯(防止水槽中的水倒 流,使试管破裂) ①检查装置的气密性 ②长颈漏斗的管口要 插入液面下; ③点燃氢气前,一定要 检验氢气的纯度(空气 中,氢气的体积达到总 体积的 4%—74.2%点燃 会爆炸。) ①检查装置的气密性 ②长颈漏斗的管口要 插入液面下; ③不能用排水法收集 解题技巧和说明 一、 推断题解题技巧:看其颜色,观其状态,察其变化,初代验之,验而得之。 1、常见物质的颜色:多数气体为无色,多数固体化合物为白色,多数溶液为无色。 2、 一些特殊物质的颜色: 黑色:MnO2、CuO、Fe3O4、C、FeS(硫化亚铁) 蓝色:CuSO4•5H2O、Cu(OH)2、CuCO3、含 Cu2+ 溶液、 液态固态 O2(淡蓝色) 红色:Cu(亮红色)、Fe2O3(红棕色)、红磷(暗红色) 黄色:硫磺(单质 S)、含 Fe3+ 的溶液(棕黄色) 绿色:FeSO4•7H2O、含 Fe2+ 的溶液(浅绿色)、碱式碳酸铜[Cu2(OH)2CO3] 无色气体:N2、CO2、CO、O2、H2、CH4 有色气体:Cl2(黄绿色)、NO2(红棕色) 有刺激性气味的气体:NH3(此气体可使湿润 pH 试纸变蓝色)、SO2 有臭鸡蛋气味:H2S 3、常见一些变化的判断: ① 白色沉淀且不溶于稀硝酸或酸的物质有:BaSO4、AgCl(就这两种物质) ② 蓝色沉淀:Cu(OH)2、CuCO3 ③ 红褐色沉淀:Fe(OH)3 Fe(OH)2 为白色絮状沉淀,但在空气中很快变成灰绿色沉淀,再变成 Fe(OH)3 红褐色沉淀 ④ 淀能溶于酸并且有气体(CO2)放出的:不溶的碳酸盐 ⑤ 淀能溶于酸但没气体放出的:不溶的碱 二、解实验题:看清题目要求是什么,要做的是什么,这样做的目的是什么。 (一)、实验用到的气体要求是比较纯净,除去常见杂质具体方法: ① 除水蒸气可用:浓流酸、CaCl2固体、碱石灰、无水CuSO4(并且可以检验杂 质中有无水蒸气,有则颜色由白色→蓝色)、生石灰等 ② 除CO2可用:澄清石灰水(可检验出杂质中有无CO2)、NaOH 溶液、KOH 溶液、碱石灰等 ③ 除HCl 气体可用:AgNO3溶液(可检验出杂质中有无HCl)、石灰水、 NaOH 溶液、KOH 溶液 除气体杂质的原则:用某物质吸收杂质或跟杂质反应,但不能吸收或跟有效成份反应,或 者生成新的杂质。 (二)、实验注意的地方: ①防爆炸:点燃可燃性气体(如 H2、CO、CH4)或用 CO、H2 还原 CuO、Fe2O3 之前,要 检验气体纯度。 ②防暴沸:稀释浓硫酸时,将浓硫酸倒入水中,不能把水倒入浓硫酸中。 ③防中毒:进行有关有毒气体(如:CO、SO2、NO2)的性质实验时,在 通风厨中进行;并要注意尾气的处理:CO 点燃烧掉; SO2、NO2 用碱液吸收。 ④防倒吸:加热法制取并用排水法收集气体,要注意熄灯顺序。 (三)、常见意外事故的处理: ①酸流到桌上,用 NaHCO3 冲洗;碱流到桌上,用稀醋酸冲洗。 ⑥ 沾到皮肤或衣物上: Ⅰ、酸先用水冲洗,再用 3 - 5% NaHCO3 冲洗; Ⅱ、碱用水冲洗,再涂上硼酸; Ⅲ、浓硫酸应先用抹布擦去,再做第Ⅰ步。 (四)、实验室制取三大气体中常见的要除的杂质: 1、制 O2 要除的杂质:水蒸气(H2O) 2、用盐酸和锌粒制 H2 要除的杂质:水蒸气(H2O)、氯化氢气体(HCl,盐酸酸雾)(用 稀硫酸没此杂质) 3、制 CO2 要除的杂质:水蒸气(H2O)、氯化氢气体(HCl) 除水蒸气的试剂:浓流酸、CaCl2 固体、碱石灰(主要成份是 NaOH 和 CaO)、生石灰、 无水 CuSO4(并且可以检验杂质中有无水蒸气,有则颜色由白色→ 蓝色)等 除 HCl 气体的试剂:AgNO3 溶液(并可检验出杂质中有无 HCl)、澄清石灰水、NaOH 溶液(或固体)、KOH 溶液(或固体) [生石灰、碱石灰也可以跟 HCl 气体反应] (五)、常用实验方法来验证混合气体里含有某种气体 1、有 CO 的验证方法:(先验证混合气体中是否有 CO2,有则先除掉) 将混合气体通入灼热的 CuO,再将经过灼热的 CuO 的混合气体通 入澄清石灰水。现象:黑色 CuO 变成红色,且澄清石灰水要变浑 浊。 2、有 H2 的验证方法:(先验证混合气体中是否有水份,有则先除掉) 将混合气体通入灼热的 CuO,再将经过灼热的 CuO 的混合气体通入 盛有无水 CuSO4 中。现象:黑色 CuO 变成红色,且无水 CuSO4 变蓝 色。 3、有 CO2 的验证方法:将混合气体通入澄清石灰水。现象:澄清石灰水变浑浊。 (六)、自设计实验 1、 试设计一个实验证明蜡烛中含有碳氢两种元素。 实验步骤 实验现象 结论 ①将蜡烛点燃,在火焰上方罩一 个干燥洁净的烧杯 烧杯内壁有小水 珠生成 证 明 蜡 烛 有氢元素 ②在蜡烛火焰上方罩一个蘸有 澄清石灰水的烧杯 澄清石灰水变浑 浊 证 明 蜡 烛 有碳元素 2、试设计一个实验来证明 CO2 具有不支持燃烧和密度比空气大的性质。 实验步骤 实验现象 结论 图 把两支蜡烛放到具有 阶梯的架上,把此架放 在烧杯里(如图),点 燃蜡烛,再沿烧杯壁倾 倒 CO2 阶 梯 下 层 的 蜡烛先灭,上 层的后灭。 证明 CO2 具 有 不 支 持 燃 烧 和 密 度 比 空 气 大的性质 三、解计算题: 计算题的类型有:①有关质量分数(元素和溶质)的计算 ②根据化学方程式进行计算 ③由①和②两种类型混合在一起计算 (一)、溶液中溶质质量分数的计算 溶质质量分数 = ╳ 100% (二)、化合物(纯净物)中某元素质量分数的计算 某元素质量分数= ╳ 100% (三)、混合物中某化合物的质量分数计算 化合物的质量分数= ╳ 100% (四)、混合物中某元素质量分数的计算 某元素质量分数= ╳ 100% 或:某元素质量分数= 化合物的质量分数 ╳ 该元素在化合物中的质量分数 (五)、解题技巧 1、审题:看清题目的要求,已知什么,求什么,有化学方程式的先写出化学方程式。找 出解此题的有关公式。 2、根据化学方程式计算的解题步骤: ①设未知量 ②书写出正确的化学方程式 ③写出有关物质的相对分子质量、已知量、未知量 ④列出比例式,求解 ⑤答。 溶质质量 溶液质量 某元素相对原子质量╳原子个数 化合物的相对分子质量 元素质量 混合物质量 化合物质量 混合物质量 特征的反应 一、7 个分解反应: ⑴ Cu2(OH)2CO3 △ 2CuO+H2O+CO2↑; ⑵ 2H2O 通电 2H2↑+O2 ↑; ⑶ 2KMnO4 △ K2MnO4+MnO2+O2↑; ⑷ 2KClO3 MnO2 2KCl+3O2 ↑; ⑸ H2CO3 = H2O + CO2↑; ⑹ CaCO3 高温 CaO + CO2↑; ⑺ 2HgO △ 2Hg+O2↑ 二、3 类置换反应: ⑴金属与酸:Zn+H2SO4 = ZnSO4+H2↑; Zn+2HCl = ZnCl2+H2↑ Mg+H2SO4 = MgSO4+H2↑; Mg+2HCl = MgCl2+H2↑ Fe+H2SO4 = FeSO4+H2↑; Fe+2HCl = FeCl2+H2↑ 2Al+3H2SO4 = Al2(SO4)3+3H2↑; 2Al+6HCl = 2AlCl3+3H2↑ ⑵铁与硫酸铜:Fe+CuSO4 = FeSO4+Cu ⑶氢气或碳做还原剂:H2 + CuO △ Cu + H2O; 3H2+Fe2O3 高温 2Fe+3H2O C+2CuO 高温 2Cu+CO2↑; 3C+2Fe2O3 高温 4Fe+3CO2↑ 三、3 种氧化还原反应: ⑴氢气做还原剂: H2 + CuO △ Cu + H2O; 3H2+Fe2O3 高温 2Fe+3H2O ⑵碳做还原剂: C+2CuO 高温 2Cu+CO2↑; 3C+2Fe2O3 高温 4Fe+3CO2↑ ⑶一氧化碳做还原剂:CO+CuO △ Cu+CO2; 3CO+Fe2O3 高温 2Fe+3CO2 四、两种沉淀: ⑴ Ca(OH)2+CO2 = CaCO3↓+H2O ⑵ 2NaOH+CuSO4 = Cu(OH)2↓+Na2SO4 白色沉淀 蓝色沉淀 △查看更多