2020届高考化学二轮复习化学平衡状态化学平衡移动学案
1.了解化学反应的可逆性及化学平衡的建立。
2.掌握化学平衡的特征。
3.理解外界条件(浓度、温度、压强、催化剂等)对化学平衡的影响,能用相关理论解释其一般规律。
4.了解化学平衡的调控在生活、生产和科学研究领域中的重要作用。
考点一 化学平衡状态及其移动
一、化学平衡状态
1.化学平衡研究的对象——可逆反应
2.化学平衡状态
(1)概念
一定条件下的可逆反应,当反应进行到一定程度时,正反应速率和逆反应速率相等,反应物的浓度和生成物的浓度不再改变,我们称为“化学平衡状态”,简称化学平衡。
(2)建立过程
在一定条件下,把某一可逆反应的反应物加入固定容积的密闭容器中。反应过程如下:
以上过程可用如图表示:
(3)平衡特点
3.化学平衡状态的判断
化学反应
mA(g)+nB(g) pC(g)+qD(g)
是否平衡
混合物体系中各成分的含量
①各物质的物质的量或物质的量分数一定
平衡
②各物质的质量或质量分数一定
平衡
③各气体的体积或体积分数一定
平衡
④总体积、总压强、总物质的量一定
不一定平衡
正、逆反
应速率之
间的关系
①单位时间内消耗了m mol A,同时也生成了m mol A
平衡
②单位时间内消耗了n mol B,同时也消耗了p mol C
平衡
③v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q
不一定平衡
④单位时间内生成了n mol B,同时也消耗了q mol D
不一定平衡
压强
①其他条件一定、总压强一定,且m+n≠p+q
平衡
②其他条件一定、总压强一定,且m+n=p+q
不一定平衡
混合气体的平均相对分子质量
①平均相对分子质量一定,且m+n≠p+q
平衡
②平均相对分子质量一定,且m+n=p+q
不一定平衡
温度
任何化学反应都伴随着能量变化,当体系温度一定时
平衡
气体密度(ρ)
①只有气体参加的反应,密度保持不变(恒容密闭容器中)
不一定平衡
②m+n≠p+q时,密度保持不变(恒压容器中)
平衡
③m+n=p+q时,密度保持不变(恒压容器中)
不一定平衡
颜色
反应体系内有色物质的颜色稳定不变(其他条件不变)
平衡
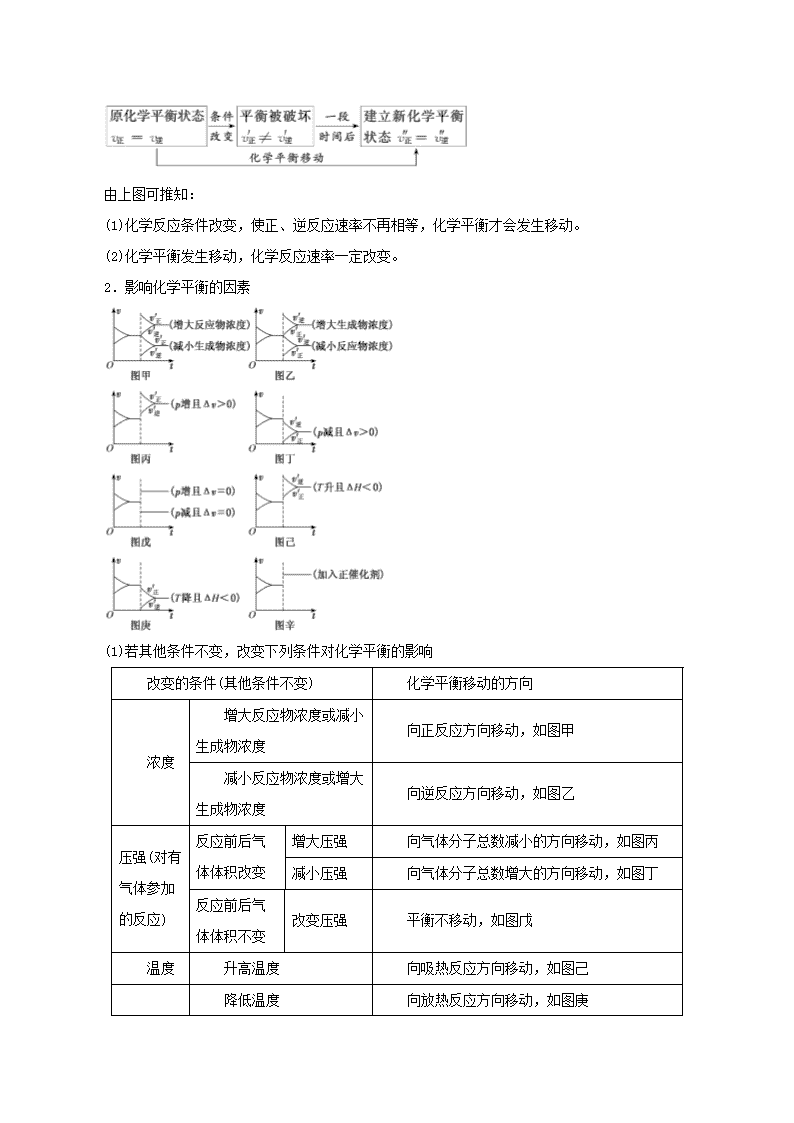
二、化学平衡移动
1.化学平衡移动的过程
原化学平衡状态
由上图可推知:
(1)化学反应条件改变,使正、逆反应速率不再相等,化学平衡才会发生移动。
(2)化学平衡发生移动,化学反应速率一定改变。
2.影响化学平衡的因素
(1)若其他条件不变,改变下列条件对化学平衡的影响
改变的条件(其他条件不变)
化学平衡移动的方向
浓度
增大反应物浓度或减小生成物浓度
向正反应方向移动,如图甲
减小反应物浓度或增大生成物浓度
向逆反应方向移动,如图乙
压强(对有气体参加的反应)
反应前后气体体积改变
增大压强
向气体分子总数减小的方向移动,如图丙
减小压强
向气体分子总数增大的方向移动,如图丁
反应前后气体体积不变
改变压强
平衡不移动,如图戊
温度
升高温度
向吸热反应方向移动,如图己
降低温度
向放热反应方向移动,如图庚
催化剂
同等程度改变v正、v逆,平衡不移动,如图辛
【特别提醒】
压强对化学平衡的影响主要看改变压强能否引起反应物和生成物的浓度变化,只有引起物质的浓度变化才会造成平衡移动,否则压强对平衡无影响。
(2)浓度的“决定性”作用
①恒温、恒容条件
原平衡体系体系总压强增大―→体系中各组分的浓度不变―→平衡不移动。
②恒温、恒压条件
原平衡体系容器容积增大,各反应气体的
3.化学平衡移动与化学反应速率的关系
v正>v逆
平衡向正反应方向移动
v正=v逆
反应达到平衡状态,不发生平衡移动
v正<v逆
平衡向逆反应方向移动
4.勒夏特列原理
如果改变影响化学平衡的条件之一(如温度、压强、以及参加反应的化学物质的浓度),平衡将向着能够减弱这种改变的方向移动。
【特别提醒】
①由“化学平衡”可知:勒夏特列原理的适用对象是可逆过程。
②由“减弱”可知:只能减弱改变,而不能消除改变。
【典例1】(福建厦门一中2019届模拟)一定条件下,对于可逆反应X(g)+3Y(g) 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断正确的是( )
A.c1∶c2=3∶1
B.平衡时,Y和Z的生成速率之比为2∶3
C.X、Y的转化率不相等
D.c1的取值范围为0 mol·L-1
v(逆);M点为刚达到平衡点;M点后为平衡受温度的影响情况,即升温,A的百分含量增加或C的百分含量减少,平衡左移,故ΔH<0。
(2)对于化学反应:mA(g)+nB(g) pC(g)+qD(g),L线上所有的点都是平衡点。L线的上方(E点),A的百分含量大于此压强时平衡体系中A的百分含量,所以E点满足v(正)>v(逆);同理L线的下方(F点)满足v(正)c,正反应为吸热反应
B.T1>T2,p1p2,a+bT2,p1>p2,a+b>c,正反应为放热反应
【答案】B
【解析】由(T1,p1)和(T1,p2)两条曲线可以看出:温度相同(T1),但压强为p2时达到平衡所需的时间短,即反应速率大,所以p2>p1;压强较大(即压强为p2)时对应的w(B)较大,说明增大压强平衡逆向移动,则a+bT2;温度较高(即温度为T1)时对应的w(B)较小,说明升高温度平衡正向移动,故正反应为吸热反应。
考点一 化学平衡状态的判断
【典例3】(2019·浙江选考)下列说法正确的是( )
A.H(g)+I2(g) ⇌ 2HI(g),其他条件不变,缩小反应容器体积,正逆反应速率不变
B.C(s)+H2O(g) ⇌ H2(g)+CO(g),碳的质量不再改变说明反应已达平衡
C.若压强不再随时间变化能说明反应2A(?)+B(g) ⇌ 2C(?)已达平衡,则A、C不能同时是气体
D.1 mol N2和3 mol H2反应达到平衡时H2转化率为10%,放出的热量为Q1;在相同温度和压强下,当2 mol NH3分解为N2和H2的转化率为10%时,吸收的热量为Q2,Q2不等于Q1
【答案】B
【解析】该可逆反应的反应前后气体计量数不发生变化,当缩小反应容器体积,相当于加压,正逆反应速率同等程度增加,A项错误;在建立平衡前,碳的质量不断改变,达到平衡时,质量不变,因而碳的质量不再改变说明反应已达平衡,B项正确;若压强不再改变说明反应达到平衡,表明反应前后气体的计量数不等,故A、C不可能均为气体,C项错误;易知N2(g)+3H2(g)⇌2NH3(g) ΔH,合成氨气实际参与反应n(H2)=3×10%=0.3mol,因而Q1=0.3/3×|ΔH|=0.1|ΔH|,分解氨气时实际消耗的n(NH3)=2×10%=0.2mol,Q2=0.2/2×|ΔH|=0.1|ΔH|,则Q1=Q2,D项错误。
【举一反三】(山东日照一中2019届模拟)用Cl2生产某些含氯有机物时会生成副产物HCl,利用下列反应可实现氯的循环利用:4HCl(g)+O2(g) 2Cl2(g)+2H2O(g) ΔH=-115.6 kJ·mol-1。恒温恒容的密闭容器中,充入一定量的反应物发生上述反应,能充分说明该反应达到化学平衡状态的是( )
A.气体的质量不再改变
B.氯化氢的转化率不再改变
C.断开4 mol H—Cl键的同时生成4 mol H—O键
D.n(HCl)∶n(O2)∶n(Cl2)∶n(H2O)=4∶1∶2∶2
【答案】B
【解析】反应物和生成物均为气体,气体的总质量始终不变,A错误;反应正向进行时,HCl的转化率升高;反应逆向进行时,HCl的转化率降低,当HCl的转化率不再改变时,可以说明可逆反应达到平衡状态,B正确;断开4 mol H—Cl键和生成4 mol H—O键均表示正反应方向的反应速率,不能据此判断反应是否达到平衡状态,C错误;反应达到平衡状态时,各反应物和生成物的物质的量保持不变,但各物质的物质的量之比等于对应的化学计量数之比,不能判断反应是否达到平衡状态,D错误。
【方法技巧】判断化学平衡状态的方法——“正逆相等,变量不变”
【变式3】(湖北荆州中学2019届质检) 在一定条件下,可逆反应N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,达到化学平衡状态时,下列说法正确的是( )
A.降低温度,可提高反应速率
B.反应物和生成物的浓度都不再发生变化
C.N2的正反应速率等于NH3的逆反应速率
D.加入合适的催化剂,可提高N2的转化率
【答案】B
【解析】降低温度,反应速率减慢,A项错误;反应达到平衡时,反应物和生成物的浓度都不变,B项正确;反应达到平衡时,N2的正反应速率等于NH3的逆反应速率的,C项错误;加入合适的催化剂,反应速率加快,但平衡不移动,N2的转化率不变,D项错误。
考点二 考查“极值”思想在化学平衡计算中的应用
【典例4】(广东执信中学2019届模拟)可逆反应N2+3H22NH3,在容积为10 L的密闭容器中进行,开始时加入2 mol N2和3 mol H2,达平衡时,NH3的浓度不可能达到( )
A.0.1 mol·L-1 B.0.2 mol·L-1
C.0.05 mol·L-1 D.0.15 mol·L-1
【答案】B
【解析】2 mol N2和3 mol H2反应,假设反应能够进行到底,则3 mol H2完全反应,生成2 mol NH3,此时NH3浓度为0.2 mol·L-1,但由于反应是可逆反应,H2不能完全反应,所以NH3浓度达不到0.2 mol·L-1。
【变式4】(广西桂林十八中2019届模拟)一定条件下,对于可逆反应X(g)+3Y(g) 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断正确的是( )
A.c1∶c2=3∶1
B.平衡时,Y和Z的生成速率之比为2∶3
C.X、Y的转化率不相等
D.c1的取值范围为0v(逆),a点反应物浓度大于b点,故a点正反应速率大于b点,故C正确;b点时环戊二烯浓度由1.5mol/L减小到0.6mol/L,减少了0.9mol/L,因此生成二聚体0.45mol/L,故D正确。
【举一反三】(2016·全国卷Ⅱ节选)丙烯腈(CH2===CHCN)是一种重要的化工原料,工业上可用“丙烯氨氧化法”生产,主要副产物有丙烯醛(CH2===CHCHO)和乙腈(CH3CN)等。回答下列问题:
(1)以丙烯、氨、氧气为原料,在催化剂存在下生成丙烯腈(C3H3N)和副产物丙烯醛(C3H4O)的热化学方程式如下:
①C3H6(g)+NH3(g)+O2(g)===C3H3N(g)+3H2O(g)ΔH=-515 kJ·mol-1
②C3H6(g)+O2(g)===C3H4O(g)+H2O(g)ΔH=-353 kJ·mol-1
有利于提高丙烯腈平衡产率的反应条件是___________________________________
________________________________________________________________________;
提高丙烯腈反应选择性的关键因素是______________________________________。
(2)图(a)为丙烯腈产率与反应温度的关系曲线,最高产率对应的温度为460 ℃。低于460 ℃时,丙烯腈的产率________(填“是”或“不是”)对应温度下的平衡产率,判断理由是________________________________________________________________________;
高于460 ℃时,丙烯腈产率降低的可能原因是________(双选,填标号)。
A.催化剂活性降低 B.平衡常数变大
C.副反应增多 D.反应活化能增大
【解析】(1)由题给生成丙烯腈的热化学方程式①可知其反应的特点:正反应为放热反应,正反应方向是气体物质的量增加的反应;故降低温度或降低压强,平衡均向正反应方向移动,有利于提高丙烯腈的平衡产率。
在化工生产中由于此反应会伴随副反应发生,为提高丙烯腈反应的选择性,使用合适催化剂十分重要。
(2)由图(a)可知,低于460 ℃时丙烯腈的产率随温度的升高而增大,高于460 ℃时丙烯腈的产率随温度的升高而降低,当460 ℃时丙烯腈的产率最高,而根据反应①可知反应放热,其丙烯腈的产率理应随着温度的升高而降低。图(a)展示的产率变化与反应①应该呈现的产率变化相矛盾的原因是低于460 ℃时,图(a)中呈现的产率变化是未达到平衡时的产率变化,当460 ℃时达到平衡,高于460 ℃时呈现的产率变化才是平衡产率。
【答案】(1)降低温度、降低压强 催化剂
(2)不是 该反应为放热反应,平衡产率应随温度升高而降低 AC
【方法技巧】化工生产适宜条件选择的一般原则
条件
原则
从化学反应速率分析
既不能过快,又不能太慢
从化学平衡移动分析
既要注意外界条件对速率和平衡影响的一致性,又要注意二者影响的矛盾性
从原料的利用率分析
增加易得廉价原料,提高难得高价原料的利用率,从而降低生产成本
从实际生产能力分析
如设备承受高温、高压能力等
从催化剂的使用活性分析
注意催化剂的活性对温度的限制
【变式6】(四川棠湖中学2019届模拟)工业上利用焦炭与水蒸气生产H2的反应原理为C(s)+H2O(g)CO(g)+H2(g) ΔH>0;CO(g)+H2O(g)CO2(g)+H2(g) ΔH<0;第二步生产的原料CO来源于第一步的产物。为提高原料的利用率及H2的日产量,下列措施中不可取的是( )
①第一步产生的混合气直接作为第二步的反应物
②第二步生产应采用适当的温度和催化剂
③第一、二步生产中均充入足量水蒸气
④第二步应在低温下进行
⑤第二步生产采用高压
⑥第二步生产中增大CO的浓度
A.①③⑤ B.②④⑥
C.②③⑤ D.①④⑤⑥
【答案】D
【解析】第一步产生的H2使第二步的平衡逆向移动,故应先进行分离,①错误;第二步反应为放热反应,温度过低,反应速率太小而影响H2的日产量,温度过高则平衡逆向移动,且要考虑催化剂的活性,故应选择适当的温度和催化剂,故②正确、④错误;增大廉价易得的水蒸气浓度可提高焦炭的利用率,③正确;压强对第二步反应无影响,不必采取高压,⑤错误;增大CO浓度并未提高主要原材料焦炭的利用率,⑥错误。