天津专用2020高考化学二轮复习专题能力训练7化学反应与热能含解析
专题能力训练七 化学反应与热能
(时间:45分钟 满分:100分)
一、选择题(共7小题,每小题6分,共42分。每小题只有1个选项符合题意)
1.下列说法或表示方法正确的是( )
A.反应物的总能量低于生成物的总能量时,该反应一定不能发生
B.强酸跟强碱反应放出的热量就是中和热
C.大多数化合反应发生时,断键时吸收的热量小于成键时放出的热量
D.在101 kPa、25 ℃时,12 g C完全燃烧生成CO,放出110.35 kJ热量,则C的燃烧热为110.35 kJ·mol-1
答案:C
解析:反应物的总能量低于生成物的总能量即吸热反应,可以发生,A错误;中和热是指强酸强碱的稀溶液完全中和生成1mol水时放出的热量,B错误;大多数化合反应是放热反应,C正确;1mol可燃物充分燃烧,生成稳定的氧化物时所放出的热量才是燃烧热,D错误。
2.下列有关叙述正确的是( )
A.已知反应2H2(g)+O2(g)2H2O(g)的ΔH=-483.6 kJ·mol-1,则氢气的燃烧热为241.8 kJ·mol-1
B.已知3O2(g)2O3(g) ΔH>0,则臭氧比氧气稳定
C.含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ 的热量,则该反应的热化学方程式为:NaOH(aq)+HCl(aq)NaCl(aq)+H2O(l) ΔH=-57.4 kJ·mol-1
D.已知2C(s)+2O2(g)2CO2(g) ΔH1,2C(s)+O2(g)2CO(g) ΔH2,则ΔH1>ΔH2
答案:C
解析:1mol可燃物充分燃烧,生成稳定的氧化物所放出的热量是燃烧热,生成的水应该为液态,A错误;物质具有的能量越低越稳定,氧气更稳定,B错误;20.0gNaOH为0.5mol,故1molNaOH与HCl完全中和放热28.7×2kJ,C正确;ΔH为负值,放热越多值越小,D错误。
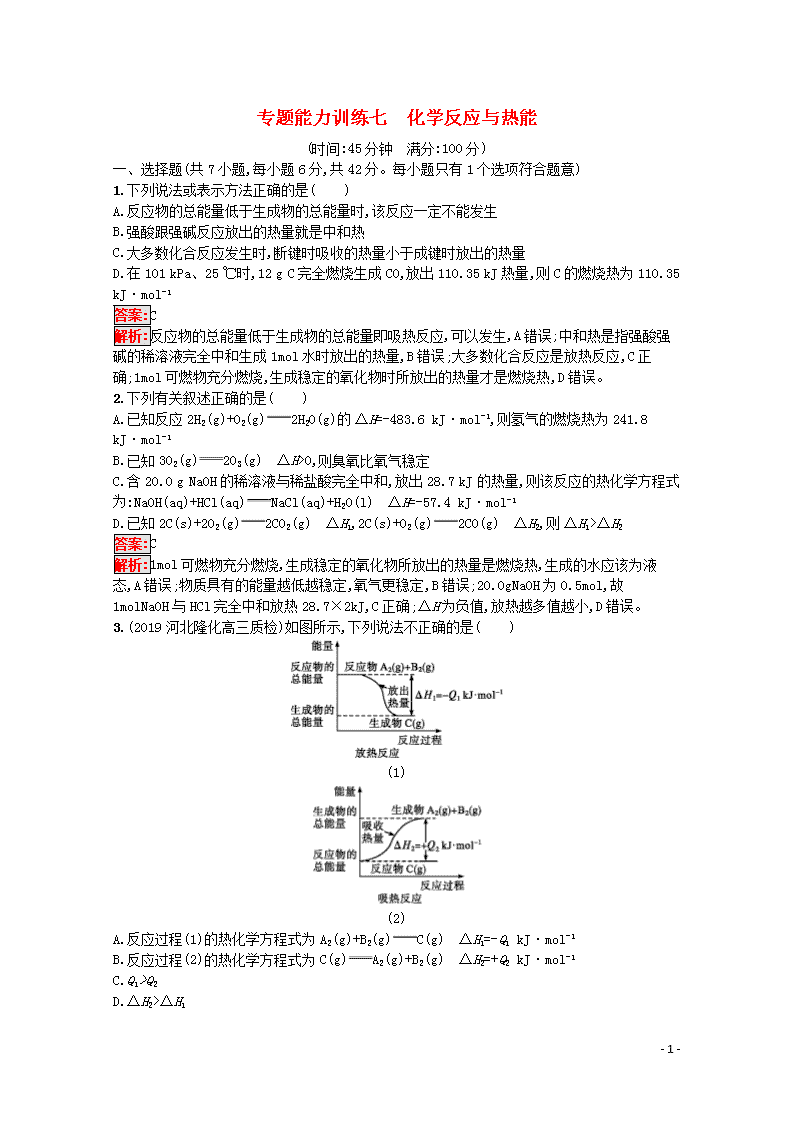
3.(2019河北隆化高三质检)如图所示,下列说法不正确的是( )
(1)
(2)
A.反应过程(1)的热化学方程式为A2(g)+B2(g)C(g) ΔH1=-Q1 kJ·mol-1
B.反应过程(2)的热化学方程式为C(g)A2(g)+B2(g) ΔH2=+Q2 kJ·mol-1
C.Q1>Q2
D.ΔH2>ΔH1
- 7 -
答案:C
解析:由图像数据可知,反应过程(1)的热化学方程式为A2(g)+B2(g)C(g) ΔH1=-Q1kJ·mol-1,反应过程(2)的热化学方程式为C(g)A2(g)+B2(g) ΔH2=+Q2kJ·mol-1,故A、B两项正确;反应过程(1)与反应过程(2)中,反应物、生成物所涉及物质及状态均相同,只是过程相反,故Q1=Q2,C项不正确;ΔH1为负值,ΔH2为正值,故ΔH2>ΔH1,D项正确。
4.下列有关叙述正确的是( )
A.CO(g)的燃烧热是283.0 kJ·mol-1,则CO2分解的热化学方程式为:2CO2(g)2CO(g)+O2(g)
ΔH=+283.0 kJ·mol-1
B.向1 L 0.5 mol·L-1的NaOH溶液中加入下列物质:①稀醋酸 ②浓硫酸 ③稀硝酸恰好完全反应,其焓变ΔH1、ΔH2、ΔH3的关系是:ΔH1<ΔH3<ΔH2
C.一定条件下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)2NH3(g) ΔH=-38.6 kJ·mol-1
D.已知氯气、溴蒸气分别与氢气的反应可表示为(Q1、Q2的值均大于零):
H2(g)+Cl2(g)2HCl(g) ΔH=-Q1 kJ·mol-1
H2(g)+Br2(g)2HBr(g) ΔH=-Q2 kJ·mol-1
则Q1>Q2
答案:D
解析:燃烧热是指1mol可燃物充分燃烧,生成稳定的氧化物所放出的热量,所以CO2分解的热化学方程式为2CO2(g)2CO(g)+O2(g) ΔH=+566.0kJ·mol-1,A错误;醋酸是弱电解质,电离时吸热,浓硫酸溶于水时放热,放热多少排序为浓硫酸>稀硝酸>稀醋酸,又因为放热反应中ΔH为负值,故ΔH2<ΔH3<ΔH1,B错误;因为N2与H2的反应为可逆反应,0.5molN2(g)与1.5molH2(g)只能部分反应,无法计算焓变,C错误;氢气与氯气反应放出的热量多,D正确。
5.(2019天津第一中学高三月考)下列说法正确的是( )
A.CH4(g)+2O2(g)CO2(g)+2H2O(g) ΔH=-801.3 kJ·mol-1,结论:CH4的燃烧热为801.3 kJ·mol-1
B.稀溶液中有H+(aq)+OH-(aq)H2O(l) ΔH=-57.3 kJ·mol-1,结论:将盐酸与稀氨水混合后,若生成1 mol H2O,则会放出57.3 kJ的能量
C.Sn(s,灰)Sn(s,白) ΔH=+2.1 kJ·mol-1(灰锡为粉末状),结论:锡制品在寒冷的冬天因易转化为灰锡而损坏
D.C(s,石墨)+O2(g)CO2(g) ΔH=-393.5 kJ·mol-1,C(s,金刚石)+O2(g)CO2(g) ΔH=-395 kJ·mol-1,结论:相同条件下金刚石性质比石墨稳定
答案:C
解析:1mol物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热,生成物中水应为液态水,A项错误;强酸与强碱的稀溶液发生中和反应生成1mol液态水时放出的热量叫中和热,H+(aq)+OH-(aq)H2O(l) ΔH=-57.3kJ·mol-1,NH3·H2O是弱碱,电离需要吸热,反应放出的热量小于57.3kJ,B项错误;冬天温度低,平衡逆向移动,锡制品转化为粉末状的灰锡而损坏,C项正确;C(s,石墨)+O2(g)CO2(g) ΔH=-393.5kJ·mol-1 ①;C(s,金刚石)+O2(g)CO2(g) ΔH=-395kJ·mol-1 ②;①-②得C(s,石墨)C(s,金刚石) ΔH=+1.5kJ·mol-1,说明石墨变成金刚石要吸收热量,即金刚石比石墨能量高,物质所含能量越低越稳定,所以石墨更稳定,D项错误。
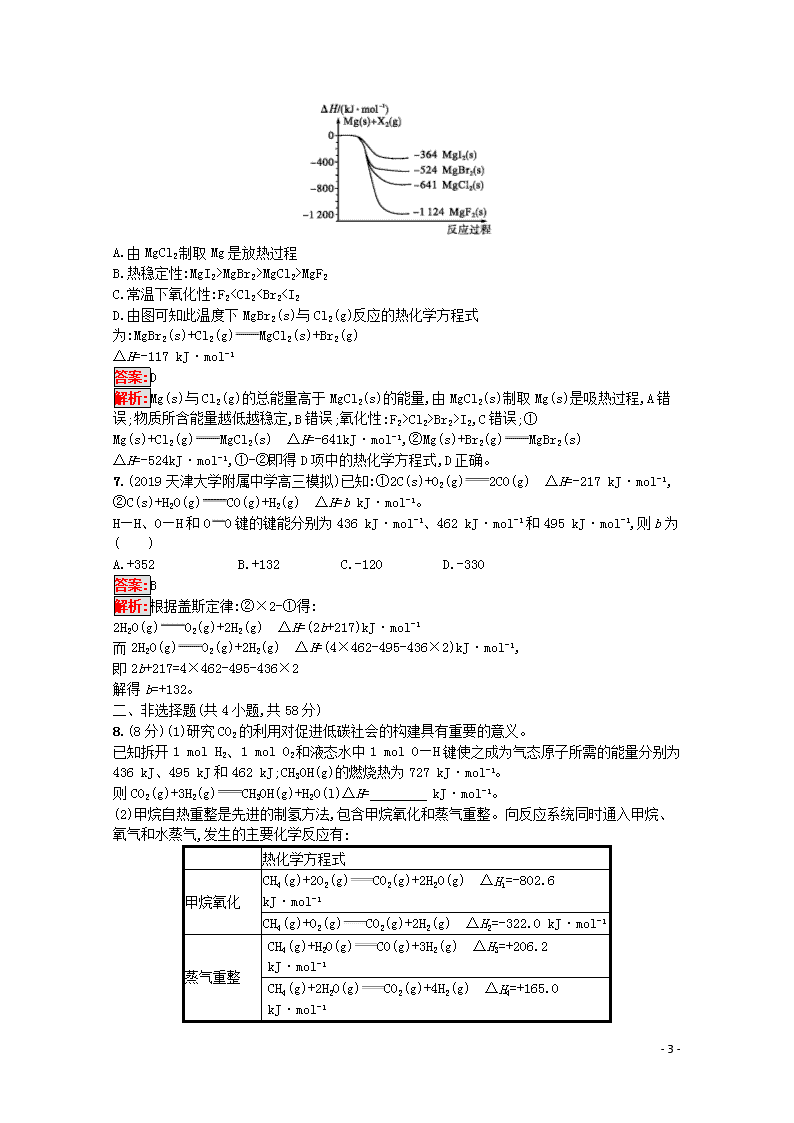
6.下图是镁与卤素单质(X2)反应的能量变化示意图。下列说法正确的是( )
- 7 -
A.由MgCl2制取Mg是放热过程
B.热稳定性:MgI2>MgBr2>MgCl2>MgF2
C.常温下氧化性:F2
Cl2>Br2>I2,C错误;①Mg(s)+Cl2(g)MgCl2(s) ΔH=-641kJ·mol-1,②Mg(s)+Br2(g)MgBr2(s) ΔH=-524kJ·mol-1,①-②即得D项中的热化学方程式,D正确。
7.(2019天津大学附属中学高三模拟)已知:①2C(s)+O2(g)2CO(g) ΔH=-217 kJ·mol-1,
②C(s)+H2O(g)CO(g)+H2(g) ΔH=b kJ·mol-1。
H—H、O—H和OO键的键能分别为436 kJ·mol-1、462 kJ·mol-1和495 kJ·mol-1,则b为( )
A.+352 B.+132 C.-120 D.-330
答案:B
解析:根据盖斯定律:②×2-①得:
2H2O(g)O2(g)+2H2(g) ΔH=(2b+217)kJ·mol-1
而2H2O(g)O2(g)+2H2(g) ΔH=(4×462-495-436×2)kJ·mol-1,
即2b+217=4×462-495-436×2
解得b=+132。
二、非选择题(共4小题,共58分)
8.(8分)(1)研究CO2的利用对促进低碳社会的构建具有重要的意义。
已知拆开1 mol H2、1 mol O2和液态水中1 mol O—H键使之成为气态原子所需的能量分别为436 kJ、495 kJ和462 kJ;CH3OH(g)的燃烧热为727 kJ·mol-1。
则CO2(g)+3H2(g)CH3OH(g)+H2O(l)ΔH= kJ·mol-1。
(2)甲烷自热重整是先进的制氢方法,包含甲烷氧化和蒸气重整。向反应系统同时通入甲烷、氧气和水蒸气,发生的主要化学反应有:
热化学方程式
甲烷氧化
CH4(g)+2O2(g)CO2(g)+2H2O(g) ΔH1=-802.6 kJ·mol-1
CH4(g)+O2(g)CO2(g)+2H2(g) ΔH2=-322.0 kJ·mol-1
蒸气重整
CH4(g)+H2O(g)CO(g)+3H2(g) ΔH3=+206.2 kJ·mol-1
CH4(g)+2H2O(g)CO2(g)+4H2(g) ΔH4=+165.0 kJ·mol-1
- 7 -
已知反应CO(g)+H2O(g)CO2(g)+H2(g)ΔH= kJ·mol-1。
答案:(1)-5.5 (2)-41.2
解析:(1)根据题意,可得①H2(g)+12O2(g)H2O(l)ΔH=(436+495×12-462×2)kJ·mol-1=-240.5kJ·mol-1
②CH3OH(g)+32O2(g)CO2(g)+2H2O(l) ΔH=-727kJ·mol-1,则所求热化学方程式可由①×3-②得到,根据盖斯定律,ΔH=-5.5kJ·mol-1。
(2)将已知热化学方程式依次编号为①、②、③、④,则所求热化学方程式可由④-③得到,根据盖斯定律,ΔH=-41.2kJ·mol-1。
9.(15分)(1)已知:
①CH3OH(g)+H2O(g)CO2(g)+3H2(g)ΔH=+86.89 kJ·mol-1
②CH3OH(g)+32O2(g)CO2(g)+2H2O(g)ΔH=-638.51 kJ·mol-1
已知水的汽化热为44 kJ·mol-1,则表示氢气燃烧热的热化学方程式为 。
(2)以CO2与NH3为原料可合成化肥尿素[分子式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)NH2CO2NH4(s)
ΔH=-159.5 kJ·mol-1
②NH2CO2NH4(s)CO(NH2)2(s)+H2O(g) ΔH=+116.5 kJ·mol-1
③H2O(l)H2O(g) ΔH=+44.0 kJ·mol-1
写出CO2与NH3合成尿素和液态水的热化学反应方程式 。
答案:(1)H2(g)+12O2(g)H2O(l)ΔH=-285.8 kJ·mol-1
(2)2NH3(g)+CO2(g)CO(NH2)2(s)+H2O(l)ΔH=-87.0 kJ·mol-1
解析:(1)①CH3OH(g)+H2O(g)CO2(g)+3H2(g)ΔH=+86.89kJ·mol-1
②CH3OH(g)+32O2(g)CO2(g)+2H2O(g)ΔH=-638.51kJ·mol-1
③H2O(l)H2O(g) ΔH=+44kJ·mol-1
根据盖斯定律,13×(②-①)得④H2(g)+12O2(g)H2O(g) ΔH=-241.8kJ·mol-1,④-③得H2(g)+12O2(g)H2O(l) ΔH=-285.8kJ·mol-1。
(2)根据盖斯定律,①+②-③:2NH3(g)+CO2(g)CO(NH2)2(s)+H2O(l) ΔH=-87.0kJ·mol-1。
10.(2018全国Ⅲ)(15分)三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料。回答下列问题。
(1)SiHCl3在常温常压下为易挥发的无色透明液体,遇潮气时发烟生成(HSiO)2O等,写出该反应的化学方程式: 。
(2)SiHCl3在催化剂作用下发生反应:
2SiHCl3(g)SiH2Cl2(g)+SiCl4(g)
ΔH1=48 kJ·mol-1
3SiH2Cl2(g)SiH4(g)+2SiHCl3(g)
ΔH2=-30 kJ·mol-1
则反应4SiHCl3(g)SiH4(g)+3SiCl4(g)的ΔH为 kJ·mol-1。
- 7 -
(3)对于反应2SiHCl3(g)SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323 K和343 K时SiHCl3的转化率随时间变化的结果如图所示。
①343 K时反应的平衡转化率α= %。平衡常数K343 K= (保留2位小数)。
②在343 K下:要提高SiHCl3转化率,可采取的措施是 ;要缩短反应达到平衡的时间,可采取的措施有 、 。
③比较A、B处反应速率大小:vA (填“大于”“小于”或“等于”)vB。反应速率v=v正-v逆=k正xSiHCl32-k逆xSiH2Cl2xSiCl4,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算A处的v正v逆= (保留1位小数)。
答案:(1)2SiHCl3+3H2O(HSiO)2O+6HCl
(2)114 (3)①22 0.02 ②及时移去产物 改进催化剂
提高反应物压强(浓度) ③大于 1.3
解析:(1)SiHCl3与H2O反应生成(HSiO)2O为非氧化还原反应,由原子守恒配平:2SiHCl3+3H2O(HSiO)2O+6HCl。
(2)2SiHCl3(g)SiH2Cl2(g)+SiCl4(g)ΔH1=48kJ·mol-1①
3SiH2Cl2(g)SiH4(g)+2SiHCl3(g)ΔH2=-30kJ·mol-1②
根据盖斯定律:①×3+②即可得4SiHCl3(g)SiH4(g)+3SiCl4(g) ΔH=114kJ·mol-1。
(3)①由图根据“先拐先平速率大”可知A点所在曲线温度较高,则343K时平衡转化率为22%;
设SiHCl3起始物质的量为1mol,则有
2SiHCl3(g)SiH2Cl2(g)+SiCl4(g)
起始物质的量/mol 1 0 0
转化物质的量/mol 0.22 0.11 0.11
平衡物质的量/mol 0.78 0.11 0.11
平衡常数K343K=0.11×0.11(0.78)2≈0.02。
③A处反应相当于在B处反应的基础上升高温度,反应速率vA大于vB;
达平衡时v正、v逆相等,k正xSiHCl32=k逆xSiH2Cl2xSiCl4
k正k逆=xSiH2Cl2·xSiCl4xSiHCl32=K343K=0.02
A处SiHCl3转化率为20%,设起始时SiHCl3物质的量为1mol,则有:
2SiHCl3(g)SiH2Cl2(g)+SiCl4(g)
起始物质的量/mol 1 0 0
转化物质的量/mol 0.2 0.1 0.1
A点物质的量/mol 0.8 0.1 0.1
此时SiHCl3、SiH2Cl2、SiCl4的物质的量分数分别为0.8、0.1、0.1,
v正v逆=k正xSiHCl32k逆xSiH2Cl2xSiCl4=0.02×0.820.1×0.1=1.28≈1.3。
- 7 -
11.(20分)(1)在化工生产过程中,少量CO的存在会引起催化剂中毒。为了防止催化剂中毒,常用SO2将CO氧化,SO2被还原为S。已知:
①C(s)+12O2(g)CO(g)ΔH1=-126.4 kJ·mol-1
②C(s)+O2(g)CO2(g)ΔH2=-393.5 kJ·mol-1
③S(s)+O2(g)SO2(g)ΔH3=-296.8 kJ·mol-1
则SO2氧化CO的热化学方程式为 。
(2)用O2将HCl转化为Cl2,可提高效率,减少污染。传统上该转化通过下图所示的催化循环实现。
其中,反应①为2HCl(g)+CuO(s)H2O(g)+CuCl2(s)
ΔH1
反应②生成1 mol Cl2的反应热为ΔH2,则总反应的热化学方程式为 (反应热用ΔH1和ΔH2表示)。
(3)将CH4与H2O(g)通入聚焦太阳能反应器,可发生反应:
①CH4(g)+H2O(g)CO(g)+3H2(g),该反应的ΔH=+206 kJ·mol-1
已知:②CH4(g)+2O2(g)CO2(g)+2H2O(g) ΔH=-802 kJ·mol-1,写出由CO2和H2O(g)生成CO的热化学方程式: 。
(4)工业上合成氨用的H2有多种制取的方法:
①用焦炭与水反应:C(s)+H2O(g)CO(g)+H2(g);
②用天然气与水蒸气反应:CH4(g)+H2O(g)CO(g)+3H2(g)
已知有关反应的能量变化如下图所示,则方法②中反应的ΔH= 。
答案:(1)SO2(g)+2CO(g)S(s)+2CO2(g)ΔH=-237.4 kJ·mol-1
(2)2HCl(g)+12O2(g)H2O(g)+Cl2(g) ΔH=ΔH1+ΔH2
(3)CO2(g)+3H2O(g)2O2(g)+CO(g)+3H2(g)ΔH=+1 008 kJ·mol-1
(4)(a+3b-c) kJ·mol-1
解析:(1)由盖斯定律可知,待求反应式可通过反应2×②-2×①-③得到,进而求出待求反应的ΔH。
(2)反应②的热化学方程式为CuCl2(s)+12O2(g)CuO(s)+Cl2(g) ΔH2。
- 7 -
故总反应2HCl(g)+12O2(g)H2O(g)+Cl2(g)ΔH=ΔH1+ΔH2。
(3)由①式-②式得CO2(g)+3H2O(g)2O2(g)+CO(g)+3H2(g) ΔH=+206kJ·mol-1-(-802kJ·mol-1)=+1008kJ·mol-1。
(4)由图可知:
Ⅰ.CO(g)+12O2(g)CO2(g) ΔH=-akJ·mol-1;
Ⅱ.12O2(g)+H2(g)H2O(g) ΔH=-bkJ·mol-1;
Ⅲ.CH4(g)+2O2(g)CO2(g)+2H2O(g)ΔH=-ckJ·mol-1。
根据盖斯定律可知反应②的ΔH为(-c+3b+a)kJ·mol-1。
- 7 -