- 2021-04-18 发布 |
- 37.5 KB |
- 64页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
【创新设计】高考化学二轮复习简易通知能提升课件:第10讲 金属元素及其化合物(高考命题视角+考场失分防范+学科素养提升)
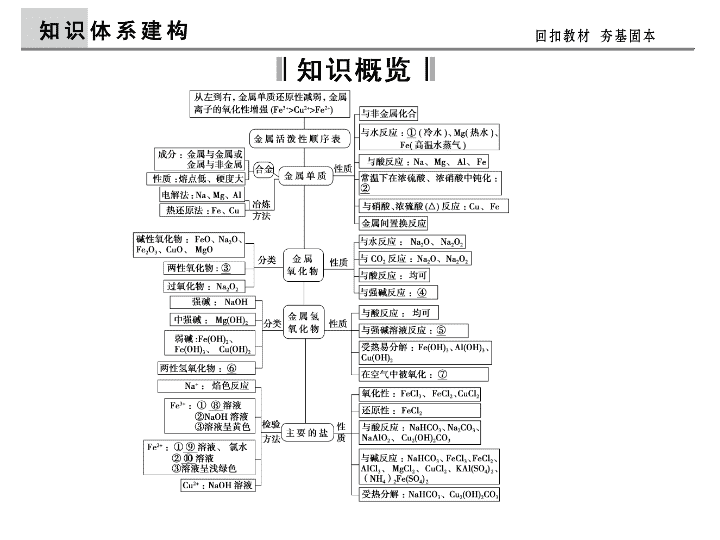
第10讲 金属元素及其化合物 【考纲点击】 1.常见金属元素(如Na、Al、Fe、Cu等) (1)了解常见金属的活动顺序。 (2)了解常见金属及其重要化合物的主要性质并了解其应用。 (3)了解合金的概念及重要合金的应用。 2.以上各部分知识的综合应用。 【自查自纠】 ①Na ②Fe、Al ③Al2O3 ④Al2O3 ⑤Al(OH)3 ⑥Al(OH)3 ⑦Fe(OH)2 ⑧KSCN ⑨KSCN溶液 ⑩NaOH 1.1 mol金属Na被氧化成Na2O和Na2O2时转移的电子数后者多于前者吗? 答案 金属钠的化合价都由0价变为+1价,转移的电子数相等。 2.Fe在Cl2中燃烧时,是否是Fe过量生成FeCl2,Cl2过量生成FeCl3? 答案 Fe在氯气中燃烧与氯气过量与否没有关系,只能生成FeCl3 。 3.焰色反应是大多金属元素的性质,属于化学变化。钠元素焰色为黄色, 钾元素的焰色为紫色,这种说法对吗? 答案 焰色反应是大多金属元素的性质,属于物理变化。钠元素焰色 为黄色,钾元素焰色为紫色(透过蓝色钴玻璃片观察)。 4.如何检验出某含Fe3+的溶液中含有Fe2+? 答案 向溶液中滴加少量酸性KMnO4溶液,溶液褪色,说明含有Fe2 +。 5.Fe(OH)2制备有哪些方法? 答案 (1)因Fe(OH)2易被氧化,在实验室制取Fe(OH)2时,一定要用 新制的亚铁盐和先加热驱赶O2后的NaOH溶液,且滴管末端插入试管内的液 面下再滴加NaOH溶液。(2)也可以在反应液面上滴加植物油或苯等物质进行 液封,避免Fe(OH)2与O2接触。(3)另外用铁作阳极,石墨作阴极,电解 NaOH溶液或NaCl溶液,利用新产生的Fe2+与OH-反应制取。 知识链接 (1)钠及其化合物之间的转化关系 考点一 钠及其化合物 角度1 钠及其化合物间的转化关系(2010·浙江,25) 角度2 过氧化钠的性质(2011·上海,20) (2)Na2O2的弱氧化性:Na2O2遇KMnO4等强氧化剂时,表现出氧 化性,氧化产物为O2。 (3)有关Na2O2与CO2、H2O的反应 2CO2+2Na2O2===2Na2CO3+O2 2H2O+2Na2O2===4NaOH+O2↑ 注意:①反应前后的“四种关系”即气体的物质的量关系、气体的 体积关系、电子转移关系、固体质量关系;②一定量的Na2O2与一 定量的CO2和H2O(g)的混合物的反应,可看做Na2O2先与CO2反应, 待CO2反应完全后,Na2O2再与H2O(g)发生反应。 角度发散 Na2O2与(CO)m(H2)n的燃烧产物反应前后的质量变化。 角度3 Na2CO3和NaHCO3鉴别、转化和除杂(2011·北京理 综,11) 3.除杂 角度发散 Na2CO3和NaHCO3溶液与同浓度酸反应的图像分析。 混合物 除杂方法及试剂 Na2CO3固体(NaHCO3) 加热 NaHCO3溶液(Na2CO3) 通入足量CO2气体 Na2CO3溶液(NaHCO3) 加入适量NaOH溶液 [高考印证] 1.(2010·浙江,25)汽车安全气囊是行车安全的重要保障。当车辆发生碰撞 的瞬间,安全装置通电点火使其中的固体粉末分解释放出大量的氮气形成气 囊,从而保护司机及乘客免受伤害。为研究安全气囊工作的化学原理,取安 全装置中的固体粉末进行实验。经组成分析,确定该粉末仅含Na、Fe、N、 O四种元素。水溶性实验表明,固体粉末部分溶解。经检测,可溶物为化合 物甲;不溶物为红棕色固体,可溶于盐酸。 取13.0 g化合物甲,加热使其完全分解,生成氮气和单质乙,生成的氮气折合 成标准状况下的体积为6.72 L。单质乙在高温隔绝空气的条件下与不溶物红棕 色粉末反应生成化合物丙和另一种单质。化合物丙与空气接触可转化为可溶 性盐。 请回答下列问题: (1)甲的化学式为________,丙的电子式为________。 (2)若丙在空气中转化为碳酸氢盐,则反应的化学方程式为 __________________________________________________。 (3)单质乙与红棕色粉末发生反应的化学方程式为 ____________________________,安全气囊中红棕色粉末的作用是 __________________________。 (4)以下物质中,有可能作为安全气囊中红棕色粉末替代品的是________。 A.KCl B.KNO3 C.Na2S D.CuO (5)设计一个实验方案,探究化合物丙与空气接触后生成可溶性盐的成分(不考 虑结晶水合物)____________________________ ___________________________________________________________________ _________________________________________。 ①定量分析:准确称取一定量的可溶性盐试样,加热至恒重后,如试样无失 重,则为Na2CO3;如加热后失重,根据失重的量在试样总质量中的比例,即 可推断出试样为NaHCO3,或Na2CO3与NaHCO3的混合物。 ②定性分析:NaHCO3受热后能产生使澄清石灰水变浑浊的无色、无味气体, Na2CO3无此性质。检验出有NaHCO3后,另取少量试样加入CaCl2溶液中,若产 生白色沉淀,则有碳酸钠,而仅有碳酸氢钠则无此现象。 1.(2013·湖州检测 )下列说法错误的是 ( )。 A.Na2O、Na2O2组成元素相同,与CO2反应产物也相同 B.将一定量的Na2O2和Na2CO3的混合物放在一密闭容器中 充 分加热后,所得固体中一定含有Na2CO3 C.Na2O2与H2O反应中,Na2O2既作氧化剂又作还原剂 D.在一定条件下将10 LCO2和水蒸气的混合气体,通入足 量 的Na2O2充分反应,恢复到原条件,剩余5 L气体 解析 Na2O与CO2反应产物只有Na2CO3,Na2O2与CO2反应产物有 Na2CO3和O2。 答案 A [应用体验] 知识链接 (1)Al、Al2O3、Al(OH)3与H+、OH-的反应及量的关系: 考点二 镁、铝及其化合物 角度1 Al、Al2O3和Al(OH)3的性质及应用(2013·山东理综,9) 角度2 (2)两个Al(OH)3沉淀图像分析 角度发散 有关Al(OH)3沉淀的计算。 知识链接 (1)镁可以通过电解熔融的氯化镁来制取。(2)镁不仅可置换酸中的氢, 也可与水解呈酸性的盐溶液反应产生H2,如Mg条置于NH4Cl溶液中可产生 H2和NH3。(3)MgO为碱性氧化物,能与水缓慢反应生成Mg(OH)2,能与酸、 NH4Cl溶液反应。(4)Mg(OH)2在较高温度分解成MgO和H2O,能与酸、 NH4Cl溶液反应。(5)由于Ksp[Mg(OH)2]<Ksp(MgCO3),故碱性溶液中Mg2 +总是转化为Mg(OH)2沉淀。 角度发散 Mg与N2、CO2的反应。 角度3 镁及其化合物的性质[2013·浙江,26(3)] 2.(2013·高考题汇编)镁、铝及其化合物在生产生活中用途广泛。 (1)足量下列物质与等质量的铝反应放出氢气且消耗溶质物质的量最 少的是________。 (2013·山东理综,9) A.NaOH溶液 B.稀H2SO4 C.盐酸 D.稀HNO3 (2)H2SO4溶解Al2O3的离子方程式是________。 [2013·北京理综,27(11)] [高考印证] 2.(2013·宁波模拟)化学在生产和日常生活中有着重要的应用。下列说法正 确的是 ( )。 A.明矾水解形成Al(OH)3胶体能吸附水中悬浮物,可用于 水 的消毒杀菌 B.铝既能与酸反应,又能与碱反应,因此铝是两性金属 C.MgO的熔点很高,可用于制作耐高温材料 D.电解MgCl2饱和溶液,可制得金属镁 [应用体验] 解析 Al3+水解生成的Al(OH)3,起净水作用,A项错误;铝虽既与酸又与 碱反应,但铝只体现的它的强还原性,不是两性金属,B项错误;利用MgO 的熔点高制作耐高温材料,C项正确;由于Mg2+的氧化性小于H+,电解时 在阴极H+放电,最终得到的是Mg(OH)2,D项错误。 答案 C 知识链接 “铁三角”中的转化关系 角度发散 Fe(OH)2的制备。 考点三 铁、铜及其化合物 角度1 铁的三角关系(2013·安徽,9C) 知识链接 1.直接观察颜色 Fe2+溶液呈浅绿色,Fe3+溶液呈棕黄色。 角度2 Fe2+与Fe3+的检验(2013·广东,10B) 2.利用显色反应(形成络离子) 3.利用Fe(OH)3沉淀的颜色 4.利用Fe3+的氧化性 5.利用Fe2+的还原性 角度3 铜及其化合物的转化关系(2013·浙江,26) [高考印证] 物质 Cu(OH)2 Fe(OH)3 CuCl CuI Ksp 2.2×10-20 2.6×10-39 1.7×10-7 1.3×10-12 (1)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2·2H2O晶体, 加入________,调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶 液中的c(Fe3+)=________。过滤后,将所得滤液低温蒸发、浓缩结晶,可得 到CuCl2·2H2O晶体。 (2)在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuCl2,原因是 ________________________(用化学方程式表示)。由CuCl2·2H2O晶体得到纯 的无水CuCl2的合理方法是 __________________________________________________。 (3)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I -发生反应的氧化性杂质)的纯度,过程如下:取0.36 g试样溶于水,加入过 量KI固体,充分反应,生成白色沉淀。用0.100 0 mol·L-1 Na2S2O3标准溶液 滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。 ①可选用________作滴定指示剂,滴定终点的现象是 __________________________________________________。 ②CuCl2溶液与KI反应的离子方程式为 __________________________________________________。 ③该试样中CuCl2·2H2O的质量百分数为________。 解析 (1)Fe(OH)3、Cu(OH)2 的 Ksp 分别为 2.6×10-39、2.2× 10-20,则 Fe3+、Cu2+开始产生沉淀时 c(OH-)分别为 3×10-10 mol·L-1、3.53×10-7 mol·L-1。除去酸性 CuCl2 溶液中的少量 FeCl3,可加入 Cu(OH2)或 Cu2(OH)2CO3 调节溶液的 pH,使 Fe3+先转化为沉淀析出。pH=4 时,c(H+)=10-4 mol·L-1,则 c(OH-)=1×10-14 10-4 mol·L-1=1×10-10 mol·L-1,此时 c(Fe3+)= Ksp[FeOH3] c3OH- =2.6×10-39 1×10-103 mol·L-1=2.6×10-9 mol·L-1。 ②CuCl2 与 KI 发生氧化还原反应,离子方程式为 2Cu2++4I-===2CuI↓+I2。 ③由题给信息可得关系式:2Cu2+~I2~2S2O2- 3 ,则有 n(CuCl2·2H2O)=n(Cu2+)=n(S2O2- 3 )=0.100 0 mol· L-1×20.00×10-3 L=2.000 ×10-3 mol,m(CuCl2·2H2O)= 2.000×10-3 mol×171 g·mol-1=0.342 g,试样中 CuCl2·2H2O 的质量分数为0.342 g 0.36 g ×100%=95%。 3.(2013·金华调研 )向含有Cu(NO3)2、Zn(NO3)2、Fe(NO3)3、AgNO3各0.1 mol 的混合溶液中加入0.1 mol铁粉,充分搅拌后,Fe溶解,溶液中不存在Fe3 +,同时析出0.1 mol Ag。下列结论错误的是 ( )。 A.氧化性:Zn2+>Cu2+>Fe3+>Ag+ B.Fe3+的氧化性大于Cu2+ C.溶液中Cu2+与Fe2+的物质的量之比为1∶ 2 D.1 mol Fe可还原2 mol Fe3+ [应用体验] 解析 根据金属活泼性顺序,Ag的还原性较弱,一旦失去电子变成Ag+,其 氧化性较强。Fe先与Ag+反应,再与Fe3+反应,由得失电子守恒知,Ag+、 Fe3+完全反应后Fe没有剩余,B、C选项正确。由铁的核心反应Fe+ 2FeCl3===3FeCl2知D项正确。 答案 A 知识链接 钠与水反应的实质是钠失去的电子转移给水电离出的H+,从而置换 出H2。由于酸中的H+浓度大,钠与酸反应的速率更快。钠与碱溶液反应的 实质是钠与水反应,钠与盐溶液的反应是先与溶液中的水反应,生成的 NaOH再与盐中的成分反应。因此,钠与水、酸和盐溶液的反应均是钠失去 的电子转移给水或溶液中的H+,H+浓度越大反应速率越快。 防范1 对钠与水、酸、碱和盐溶液反应的实质理解不清 1.将钠投入到下列溶液中,反应的剧烈程度由强到弱的是 ( )。 ①水 ②NaOH ③0.1mol·L-1盐酸 ④0.1 mol·L-1 FeCl3溶液 A.④③②① B.④③①② C.③④①② D.①③④② 解析 由于钠与水和溶液反应的实质是钠失去的电子转移给水或溶液 中的H+,H+浓度越大反应速率越快。由于Fe3+水解使溶液呈酸性, NaOH溶液呈碱性,H+浓度最小。故C项正确。 答案 C [防范演练] 知识链接 (1)熟练掌握“铝三角”的转化关系: 防范2 对铝及其化合物的转化不能灵活应用 2.对金属制品进行抗腐蚀处理,可延长其使用寿命。以下为铝材表面处理 的一种方法: [防范演练] 碱洗的目的是除去铝材表面的自然氧化膜,碱洗时常有气泡冒出,原因是 __________________(用离子方程式表示)。 为将碱洗槽液中铝以沉淀形式回收,最好向槽液中加入下列试剂中的 ________。 a.NH3 B.CO2 c.NaOH D.HNO3 化学工艺流程题主要包括物质的制备和提纯两大类型,主要考查:(1)化 工生产条件的控制;(2)化学实验操作及化工流程的设计与评价;(3)金属、非 金属单质和化合物的性质与转化;(4)关于化工生产的相关计算。 化学工艺流程题的解题技巧 1.物质制备类化工生产流程题的解题策略:(1)审题干:明确原始物质及目 标物质,分析题目信息(如原料成分、产品成分、某种新物质的性质、及相关 反应等),进而分析每个生产环节所发生的反应和操作目的;(2)审流程图: 明确化工生产流程的特点:原料→对原料的预处理→核心化学反应→产品的 提纯分离→目标产物;其中箭头进入的是投料(反应物),箭头出去的是生成 物(包括主产物和副产物),返回的箭头一般是被”循环利用“的物质;(3)熟 悉常用的与化工生产相关的操作方法及其作用。 2.提纯类化工生产流程题的解题策略:(1)明确原料中含有的杂质和目标物 质;(2)阅读流程图,明确提纯的流程;(3)明确提纯的方法:水溶法、酸溶法、 碱溶法、氧化或还原法、加热灼烧法、调节溶液的pH法、杂质转化法、吸收 洗涤法、加热升华法等;(4)明确常用的分离方法:过滤、萃取和分液、蒸发 结晶、冷却结晶、蒸馏或分馏、冷却法等;同时还要注意物质分离、提纯的 原则及注意事项等。 (2013·杭州模拟)明矾石的主要成分是K2SO4·Al2(SO4)3·2Al2O3·6H2O, 此外还含有少量Fe2O3杂质。利用明矾石制备氢氧化铝的流程如图所示。 [应用体验] 解析 (1)根据“焙烧”过程中的反应,遵循质量守恒定律,可知另一产物为 SO2,由化合价变化关系可知,Al2(SO4)3为氧化剂。(2)Al2O3是两性氧化物, 加入氢氧化钠能够使其溶解。(3)“调节pH”后过滤、洗涤Al(OH)3沉淀,证明 已洗涤干净的实验操作和现象是取最后一次洗涤液于试管中,滴加BaCl2溶液, 若无白色沉淀生成则说明已洗涤干净。(4)母液中有K2SO4和Na2SO4,都可以 回收。查看更多