- 2021-04-17 发布 |
- 37.5 KB |
- 23页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学一轮总复习第6章化学反应与能量第3节化学能转化为电能-电池检测鲁科版
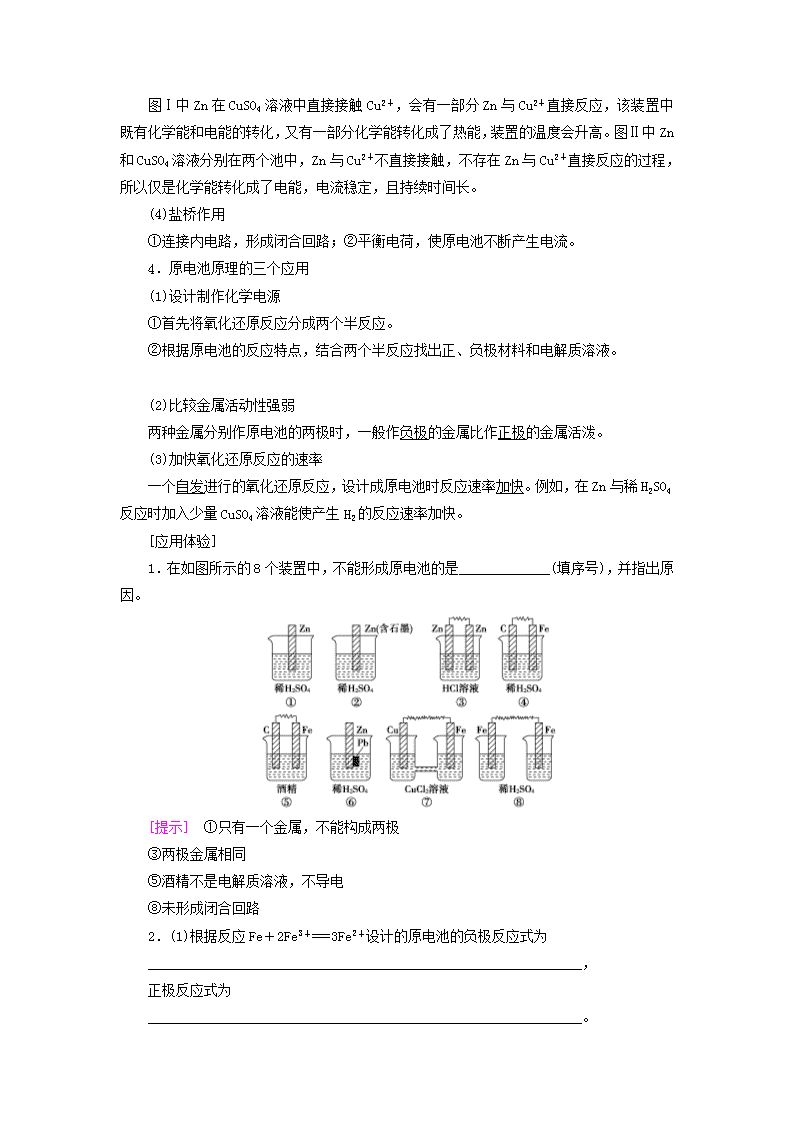
第 3 节 化学能转化为电能——电池 考纲定位 考情播报 1.理解原电池的构成、工作原理及应用,能 写出电极反应和总反应方程式。 2.了解常见化学电源的种类及其工作原理。 2016·全国甲卷 T11/全国丙卷 T11 2015·全国卷ⅠT11/全国卷ⅡT26(1)(2) 2014·全国卷ⅡT12 2013·全国卷ⅠT10、T27(5)、T28(5)/全国卷ⅡT11 2012·全国卷 T26(4) 考点 1| 原电池的工作原理及应用 [基础知识自查] 1.概念及反应本质 电化学上将能把化学能转化为电能的装置,其本质是发生了氧化还原反应。 2.构成条件 (1)有两个活动性不同的电极(常见为金属或石墨)。 (2)将电极插入电解质溶液中。 (3)两电极间构成闭合回路(两电极接触或用导线连接)。 (4)能自发发生氧化还原反应。 3.工作原理 如图是 Cu-Zn 原电池,请填空: (1)反应原理 电极名称 负极 正极 电极材料 Zn Cu 电极反应 Zn-2e-===Zn2+ Cu2++2e-===Cu 反应类型 氧化反应 还原反应 (2)原电池中的三个方向 ①电子方向:从负极流出沿导线流入正极; ②电流方向:从正极沿导线流向负极; ③离子的迁移方向:电解质溶液中,阴离子向负极迁移,阳离子向正极迁移。 (3)两种装置的比较 图Ⅰ中 Zn 在 CuSO4 溶液中直接接触 Cu2+,会有一部分 Zn 与 Cu2+直接反应,该装置中既 有化学能和电能的转化,又有一部分化学能转化成了热能,装置的温度会升高。图Ⅱ中 Zn 和 CuSO4 溶液分别在两个池中,Zn 与 Cu2+不直接接触,不存在 Zn 与 Cu2+直接反应的过程, 所以仅是化学能转化成了电能,电流稳定,且持续时间长。 (4)盐桥作用 ①连接内电路,形成闭合回路;②平衡电荷,使原电池不断产生电流。 4.原电池原理的三个应用 (1)设计制作化学电源 ①首先将氧化还原反应分成两个半反应。 ②根据原电池的反应特点,结合两个半反应找出正、负极材料和电解质溶液。 (2)比较金属活动性强弱 两种金属分别作原电池的两极时,一般作负极的金属比作正极的金属活泼。 (3)加快氧化还原反应的速率 一个自发进行的氧化还原反应,设计成原电池时反应速率加快。例如,在 Zn 与稀 H2SO4 反应时加入少量 CuSO4 溶液能使产生 H2 的反应速率加快。 [应用体验] 1.在如图所示的 8 个装置中,不能形成原电池的是_____________(填序号),并指出原 因。 [提示] ①只有一个金属,不能构成两极 ③两极金属相同 ⑤酒精不是电解质溶液,不导电 ⑧未形成闭合回路 2.(1)根据反应 Fe+2Fe3+===3Fe2+设计的原电池的负极反应式为 ______________________________________________________________, 正极反应式为 ______________________________________________________________。 (2)根据 2Cu+O2+2H2SO4===2CuSO4+2H2O 设计的原电池的正极反应式为 ______________________________________________________________。 [提示] (1)Fe-2e-===Fe2+ 2Fe3++2e-===2Fe2+ (2)O2+4e-+4H+===2H2O [考点多维探究] 角度 1 原电池的工作原理及电极判断 1.(2015·天津高考)锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水 分子通过,下列有关叙述正确的是( ) 【导学号:99682209】 A.铜电极上发生氧化反应 B.电池工作一段时间后,甲池的 c(SO2- 4 )减小 C.电池工作一段时间后,乙池溶液的总质量增加 D.阴阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡 C [A.Cu 作正极,电极上发生还原反应,错误;B.电池工作过程中,SO 2- 4 不参加电极 反应,故甲池的 c(SO2- 4 )基本不变;C.电池工作时,甲池反应为 Zn-2e-===Zn2+,乙池反应 为 Cu2++2e-===Cu,甲池中 Zn2+会通过阳离子交换膜进入乙池,以维持溶液中电荷平衡,由 电极反应式可知,乙池中每有 64 g Cu 析出,则进入乙池的 Zn2+为 65 g,溶液总质量略有 增加,正确;D.由题干信息可知,阴离子不能通过阳离子交换膜。] 2.控制适合的条件,将反应 2Fe3++2I- 2Fe2++I2 设计成如图所示的原电池。下列 判断不正确的是( ) A.反应开始时,乙中石墨电极上发生氧化反应 B.反应开始时,甲中石墨电极上 Fe3+被还原 C.电流表读数为零时,反应达到化学平衡状态 D.电流表读数为零后,在甲中溶入 FeCl2 固体,乙中的石墨电极为负极 D [由图示结合原电池原理分析可知,Fe3+得电子变成 Fe2+被还原,I-失去电子变成 I2 被氧化,所以 A、B 正确;电流表读数为零时,Fe3+得电子速率等于 Fe2+失电子速率,反应 达到平衡状态,C 正确;D 项在甲中溶入 FeCl2 固体,平衡 2Fe3++2I- 2Fe2++I2 向左移 动,I2 被还原为 I-,乙中石墨为正极,D 不正确。] 3.分析下图所示的四个原电池装置,其中结论正确的是( ) A.①②中 Mg 作负极,③④中 Fe 作负极 B.②中 Mg 作正极,电极反应式为 6H2O+6e-===6OH-+3H2↑ C.③中 Fe 作负极,电极反应式为 Fe-2e-===Fe2+ D.④中 Cu 作正极,电极反应式为 2H++2e-===H2↑ B [②中 Mg 不与 NaOH 溶液反应,而 Al 能和 NaOH 溶液反应失去电子作负极;③中 Fe 在浓 HNO3 中钝化,Cu 和浓 HNO3 反应失去电子作负极,则 Fe 作正极,A、C 错误;②中电池 总反应为 2Al+2NaOH+6H2O===2Na[Al(OH)4]+3H2↑,负极反应式为 2Al+8OH - -6e - ===2[Al(OH)4]-,二者相减得到正极反应式为 6H2O+6e-===6OH-+3H2↑,B 正确;④中 Cu 作正极,电极反应式为 O2+2H2O+4e-===4OH-,D 错误。] 原电池的工作原理简图 注意:①一般负极金属较活泼,正极金属或非金属不活泼。 ②一般负极溶解或质量减轻,正极有气泡或质量增重。 ③若有盐桥,盐桥中的阴离子移向负极区,阳离子移向正极区。 角度 2 原电池原理的应用 4.有 A、B、C、D、E 五块金属片,进行如下实验,试比较金属活动性的强弱: 【导学号:99682210】 (1)A、B 用导线相连后,同时浸入稀 H2SO4 溶液中,A 极为负极,活动性________; (2)C、D 用导线相连后,同时浸入稀 H2SO4 溶液中,电流由 D→导线→C,活动性________; (3)A、C 相连后,同时浸入稀 H2SO4 溶液中,C 极产生大量气泡,活动性________; (4)B、D 相连后,同时浸入稀 H2SO4 溶液中,D 极发生氧化反应,活动性________; (5)用惰性电极电解含 B 离子和 E 离子的溶液,E 先析出,活动性________。 综上所述,这五种金属的活动性从强到弱的顺序为________。 [答案] (1)A>B (2)C>D (3)A>C (4)D>B (5)B>E A>C>D>B>E 5.把适合题意的图像填在横线上(用 A、B、C、D 表示) (1)将等质量的两份锌粉 a、b 分别加入过量的稀硫酸,同时向 a 中加入少量的 CuSO4 溶 液,产生 H2 的体积 V(L)与时间 t(min)的关系是________。 (2)将过量的两份锌粉 a、b 分别加入定量的稀硫酸,同时向 a 中加入少量的 CuSO4 溶液, 产生 H2 的体积 V(L)与时间 t(min)的关系是________。 (3)将(1)中的 CuSO4 溶液改成 CH3COONa 溶液,其他条件不变,则图像是________。 [解析] (1)a 中加入 CuSO4,消耗一部分 Zn,Cu、Zn 形成原电池,反应速率加快,所 以 a 放出 H2 的量减少,但速率加快。 (2)a 中加入 CuSO4 消耗 Zn,但不影响产生 H2 的量,速率也加快。 (3)CH3COONa 与 H2SO4 反应后生成弱酸 CH3COOH,从而减慢反应速率,但产生 H2 的量没发 生变化。 [答案] (1)A (2)B (3)C 6.请运用原电池原理设计实验,验证 Cu2+、Fe3+氧化性的强弱。请写出电极反应式, 负极:_____________________________________________, 正极:_____________________________________________, 并在方框内画出实验装置图,要求用烧杯和盐桥,并标出外电路电子流向。 [答案] Cu-2e-===Cu2+ 2Fe3++2e-===2Fe2+ 原电池设计的思维模板 (1)正、负极材料的选择:根据氧化还原关系找出正、负极材料,一般选择活泼性较强 的金属作为负极;活泼性较弱的金属或可导电的非金属(如石墨等)作为正极。 (2)电解质溶液的选择:电解质溶液一般要能够与负极发生反应,或者电解质溶液中溶 解的其他物质能与负极发生反应(如溶解于溶液中的空气)。但如果氧化反应和还原反应分别 在两个容器中进行(中间连接盐桥),则两个容器中的电解质溶液选择与电极材料相同的阳离 子。 (3)画装置图:注明电极材料与电解质溶液。但应注意盐桥不能画成导线,要形成闭合 回路。 考点 2| 常见化学电源的原理及电极反应式的书写 [基础知识自查] 1.一次电池(以碱性锌锰干电池为例) 总反应为 Zn+MnO2+H2O===Mn(OH)2+ZnO。 负极:Zn+2OH--2e-===ZnO+H2O; 正极:MnO2+2H2O+2e-===Mn(OH)2+2OH-。 2.二次电池 (1)铅蓄电池是最常见的二次电池,总反应为 Pb+PbO2+2H2SO4 放电 充电 2PbSO4+2H2O (2)二次电池充电时的电极连接 3.燃料电池 氢氧燃料电池是目前最成熟的燃料电池,可分为酸性和碱性两种。 介质 酸性 碱性 负极反应式 2H2-4e-===4H+ 2H2+4OH--4e-===4H2O 正极反应式 O2+4H++4e-===2H2O O2+2H2O+4e-===4OH- 电池总反应式 2H2+O2===2H2O 注:①燃料电池的电极不参加电极反应,外通入的燃料发生负极反应,O2 发生正极反应。 ②书写电极反应时,注意介质的参与反应。 [应用体验] 1.已知某镍镉电池的电解质溶液为 KOH 溶液,其充、放电按下式进行: Cd+2NiOOH+2H2O 放电 充电 Cd(OH)2+2Ni(OH)2 请回答下列问题: (1)放电时,负极反应式为____________________________, 正极反应式为______________________________________。 (2)充电时,阴极反应式为____________________________, 阳极反应式为______________________________________。 (3)放电时,K+向________极迁移,负极的溶液 pH 的变化为________。 (4)充电时,镍镉电池的负极应与外接电源的________极相连。 [提示] (1)Cd-2e-+2OH-===Cd(OH)2 2NiOOH+2e-+2H2O===2Ni(OH)2+2OH- (2)Cd(OH)2+2e-===Cd+2OH- 2Ni(OH)2+2OH--2e-===2NiOOH+2H2O (3)正 减小 (4)负 2.以 CO 为燃料气,请分别写出电解质符合下列条件的正、负极的电极反应式和总反应 式(填入表格中)。 [提示] ①O2+4e-+4H+===2H2O 2CO-4e-+2H2O===2CO2+4H+ 2CO+O2===2CO2 ②O2+4e-+2H2O===4OH- 2CO-4e-+8OH-===2CO2- 3 +4H2O 2CO+O2+4OH-===2CO2- 3 +2H2O ③O2+4e-===2O2- 2CO-4e-+2O2-===2CO2 2CO+O2===2CO2 ④O2+4e-+2CO2===2CO2- 3 2CO-4e-+2CO2- 3 ===4CO2 2CO+O2===2CO2 [考点多维探究] 角度 1 常见化学电源的原理分析 1.(2017·长沙模拟)比亚迪双模电动汽车使用的是高铁电池,其总反应为 3Zn(OH)2+ 2Fe(OH)3+4KOH 充电 放电 3Zn+2K2FeO4+8H2O,下列说法正确的是( ) A.放电时,若有 6 mol 电子发生转移,则有 2 mol K2FeO4 被氧化 B.放电时,正极反应为 FeO2- 4 +4H2O-3e-===Fe(OH)3+5OH- C.充电时,电池的负极与外接电源的负极相连 D.充电时,阴极附近溶液的 pH 变小 C [由反应方程式可知,放电时,K2FeO4 被还原,A 项错误;放电时正极得电子,电极 反应为 FeO2- 4 +4H2O+3e-===Fe(OH)3+5OH-,B 项错误;充电时,电池的负极与外接电源的 负极相连,C 项正确;充电时,阴极附近溶液的 pH 变大,D 项错误。] 2 . (2017· 信 阳 市 一 模 ) 某 充 电 宝 锂 离 子 电 池 的 总 反 应 为 xLi + Li1 - xMn2O4 放电 充电 LiMn2O4,某手机镍氢电池总反应为 NiOOH+MH 放电 充电 M+Ni(OH)2(M 为储氢金 属或合金),有关上述两种电池的说法不正确的是( ) A.锂离子电池放电时,Li+向正极迁移 B.镍氢电池放电时,正极的电极反应式:NiOOH+H2O+e-===Ni(OH)2+OH- C.如图表示用锂离子电池给镍氢电池充电 D.锂离子电池充电时,阴极的电极反应式:LiMn2O4-xe-===Li1-xMn2O4+xLi+ D [A 项,锂离子电池放电时阳离子移向正极,所以 Li+向正极迁移,故 A 正确;B 项, 放电时,正极发生还原反应,方程式为 NiOOH+e-+H2O===Ni(OH)2+OH-,故 B 正确;C 项, 题图表示用锂离子电池为放电过程,而镍氢电池为充电过程,故负极 Li 接 M 极发生 M+H+ +e-===MH,故 C 正确;D 项,锂离子电池充电时,阴极的电极反应式:Li++e-===Li,故 D 错误。] 3.(2016·全国丙卷)锌—空气燃料电池可用作电动车动力电源,电池的电解质溶液为 KOH 溶液,反应为 2Zn+O2+4OH-+2H2O===2Zn(OH)2- 4 。下列说法正确的是( ) A.充电时,电解质溶液中 K+向阳极移动 B.充电时,电解质溶液中 c(OH-)逐渐减小 C.放电时,负极反应为:Zn+4OH--2e-===Zn(OH)2- 4 D.放电时,电路中通过 2 mol 电子,消耗氧气 22.4 L(标准状况) C [A 项,充电时,电解质溶液中 K+向阴极移动,错误;B 项,充电时,总反应方程式 为 2Zn(OH)2- 4 ===== 通电 2Zn+O2+4OH-+2H2O,所以电解质溶液中 c(OH-)逐渐增大,错误;C 项, 在碱性环境中负极 Zn 失电子生成的 Zn2+将与 OH―结合生成 Zn(OH)2- 4 ,正确;D 项,O2~4e-, 故电路中通过 2 mol 电子时,消耗氧气 0.5 mol,在标准状况体积为 11.2 L,错误。] 角度 2 常见电源电极反应式的书写 4.(1)Fe-Cu-稀 H2SO4 组成的原电池中,负极反应为__________, 正极反应为________________________, 电池总反应为_________________________________________。 (2)Mg-Al-NaOH 溶液组成的原电池中,负极反应为________________,正极反应为 _______________________________, 电池总反应为___________________________________。 (3)(2015·全国卷Ⅱ节选)酸性锌锰干电池是一种一次性电池,外壳为金属锌,中间是 碳棒,其周围是由碳粉、MnO2、ZnCl2 和 NH4Cl 等组成的糊状填充物。该电池放电过程产生 MnOOH。回收处理该废电池可得到多种化工原料。回答下列问题: ①该电池的正极反应式为_______________________________________, 电池反应的离子方程式为_______________________________________。 ②维持电流强度为 0.5 A,电池工作 5 分钟,理论上消耗锌________g。(已知 F=96 500 C·mol-1) (4)(2012·全国卷节选)与 MnO2-Zn 电池类似,K2FeO4-Zn 也可以组成碱性电池,K2FeO4 在电池中作为正极材料,其电极反应式为_____________________, 该电池总反应的离子方程式为___________________________________。 (5)用吸收 H2 后的稀土储氢合金作为电池负极材料(用 MH 表示),NiOOH 作为电池正极材 料,KOH 溶液作为电解质溶液,可制得高容量、长寿命的镍氢电池。电池充放电时的总反应 为: NiOOH+MH 放电 充电 Ni(OH)2+M 电池放电时,负极的电极反应式为____________________, 充电时,阳极反应式为________________________________。 [解析] (1)Fe 作负极,电极反应:Fe-2e-===Fe2+;Cu 作正极,电极反应:2H++2e- ===H2↑。 (2)Al 作负极,电极反应:Al-3e-+4OH-===[Al(OH)4]-;Mg 作正极,电极反应:2H2O +2e-===H2↑+2OH-。 (3)①根据酸性锌锰干电池的构造可知,放电时,负极 Zn 失去电子生成 Zn2+,正极 MnO2 得到电子生成 MnOOH,从而可写出正极和负极的电极反应式,然后在遵循电子守恒的前提下 将两极反应式加合可得电池反应的离子方程式。②电池工作 5 分钟,通过的电量 Q=It=0.5 A×5 min×60 s/min = 150 C , 因 此 通 过 电 子 的 物 质 的 量 n(e - ) = Q F = 150 C 96 500 C/mol ≈1.554×10-3 mol,则理论消耗 Zn 的质量是 m(Zn)=1.554×10-3 mol 2 ×65 g/mol≈0.05 g。 (4)K2FeO4-Zn 组成碱性电池,K2FeO4 在电池中作为正极材料,FeO 2- 4 中+6 价铁元素被 还原为 Fe(OH)3 中+3 价铁元素,其电极反应式为 FeO2- 4 +3e-+4H2O===Fe(OH)3+5OH-;书写 总反应的离子方程式时,关键是抓住 Fe 和 Zn 的存在形式分别是 Fe(OH)3 和 Zn(OH)2。 (5)负极实际上是稀土储氢合金吸附的 H2 失去电子生成 H+,H+再与 OH-结合生成 H2O, 所以负极的电极反应式为 MH-e-+OH-===M+H2O。充电时阳极发生氧化反应,反应式为 Ni(OH)2-e-+OH-===NiOOH+H2O。 [答案] (1)Fe-2e-===Fe2+ 2H++2e-===H2↑ Fe+2H+===Fe2++H2↑ (2)Al-3e-+4OH-===[Al(OH)4]- 2H2O+2e-===H2↑+2OH- 2Al+2OH-+6H2O===2[Al(OH)4]-+3H2↑ (3)①MnO2+H++e-===MnOOH 2MnO2+Zn+2H+===2MnOOH+Zn2+ ②0.05 (4)FeO2- 4 +3e-+4H2O===Fe(OH)3+5OH- 2FeO2- 4 +8H2O+3Zn===2Fe(OH)3+3Zn(OH)2+4OH- (5)MH-e-+OH-===M+H2O Ni(OH)2-e-+OH-===NiOOH+H2O 化学电源中电极反应书写的思维模板 (1)明确直接产物:根据负极氧化、正极还原,明确两极的直接产物; (2)确定最终产物:根据介质环境和共存原则,找出参与的介质粒子,确定最终产物; (3)配平:根据电荷守恒、原子守恒配平电极反应式。 注意:①H+在碱性环境中不存在;②O2-在水溶液中不存在,在酸性环境中结合 H+,生 成 H2O,在中性或碱性环境结合 H2O,生成 OH-;③若已知总反应式时,可先写出较易书写的 一极的电极反应式,然后在电子守恒的基础上,总反应式减去较易写出的一极的电极反应式, 即得到较难写出的另一极的电极反应式。 考点 3| 金属的腐蚀与防护 [基础知识自查] 1.金属腐蚀的两种类型 类型 化学腐蚀 电化学腐蚀 条件 金属跟具有腐蚀性的化学物质接触 不纯金属或合金跟电解质溶液接触 现象 无电流产生 有电流产生 本质 金属被氧化 较活泼金属被氧化 联系 两者往往同时发生,电化学腐蚀更普遍 2.钢铁电化学腐蚀的两种类型 3.金属的防护 (1)电化学防护 ①牺牲阳极保护法—原电池原理 a.负极:比被保护金属活泼的金属; b.正极:被保护的金属。 ②外加电流的阴极保护法—电解原理 a.阴极:被保护的金属; b.阳极:惰性金属。 (2)改变金属的内部结构,如制成合金、不锈钢等。 (3)加防护层,如在金属表面喷油漆、涂油脂、电镀、喷镀或表面钝化等方法。 [应用体验] 实验探究(如图所示) (1)若棉团浸有 NH4Cl 溶液,铁钉发生______________腐蚀,正极反应式为 ____________________________________________________________, 右试管中现象是____________________________________________。 (2)若棉团浸有 NaCl 溶液,铁钉发生________腐蚀,正极反应式为 ______________________________________________________________, 右试管中现象是_________________________________________。 [提示] (1)析氢 2H++2e-===H2↑ 有气泡冒出 (2)吸氧 O2+4e-+2H2O===4OH- 导管内液面上升 [考点多维探究] 角度 1 析氢腐蚀与吸氧腐蚀的判断与原理分析 1.利用下图装置进行实验,开始时,a、b 两处液面相平,密封好,放置一段时间。下 列说法不正确的是( ) A.a 处溶液的 pH 增大,b 处溶液的 pH 减小 B.一段时间后,a 管液面高于 b 管液面 C.a 管发生吸氧腐蚀,b 管发生析氢腐蚀 D.a、b 两处具有相同的电极反应式:Fe-2e-===Fe2+ A [左边是发生吸氧腐蚀,右边发生析氢腐蚀。a 处氧气得电子和水反应生成氢氧根离 子,铁失电子生成二价铁离子,氢氧根离子和二价铁离子反应生成氢氧化亚铁沉淀,所以溶 液的 pH 值变化不大,b 处氢离子发生还原反应生成氢气,溶液的 pH 增大,故 A 错误。] 2. 如图装置中,小试管内为红墨水,具支试管内盛有 pH=4 久置的雨水和生铁片。实 验时观察到:开始时导管内液面下降,一段时间后导管内液面回升,略高于小试管内液面。 【导学号:99682211】 (1)开始时,生铁发生________腐蚀,负极反应式为__________________。 (2)一段时间后,生铁发生______________腐蚀,正极反应式为__________, 具支试管内雨水的 pH 的变化情况为_______________________________, 最后生铁片表面形成红棕色铁锈(Fe2O3·xH2O),那么后期溶液中发生的反应方程式有 ________________________、2Fe(OH)3===Fe2O3·xH2O+(3-x)H2O。 [解析] 开始时,溶液酸性强发生析氢腐蚀,析氢腐蚀消耗 H+,酸性减弱,一段时间 后又发生吸氧腐蚀。 [答案] (1)析氢 Fe-2e-===Fe2+ (2)吸氧 O2 +2H2O+4e -===4OH- 增大 Fe2++2OH-===Fe(OH)2↓、4Fe(OH)2 +O2+ 2H2O===4Fe(OH)3 (1)对于活泼金属判断析氢腐蚀和吸氧腐蚀的关键看介质的酸碱性。酸性介质发生析氢 腐蚀,碱性、中性介质发生吸氧腐蚀。 (2)对于氢后的不活泼金属只能发生吸氧腐蚀(如 Cu)。 角度 2 金属腐蚀的快慢与防护 3.如图所示,各烧杯中盛有海水,铁(含杂质 C)在其中被腐蚀由快到慢的顺序为( ) 【导学号:99682212】 A.②①③④⑤⑥ B.⑤④③①②⑥ C.⑤④②①③⑥ D.⑤③②④①⑥ C [②③④是原电池,⑤⑥是电解池,金属被腐蚀由快到慢的顺序是:电解池的阳极> 原电池的负极>原电池的正极>电解池的阴极。] 4.(2017·江门模拟)利用如图装置可以模拟铁的电化学防护。下列说法不正确的是 ( ) A.若 X 为锌棒,开关 K 置于 M 处,可减缓铁的腐蚀速率 B.若 X 为锌棒,开关 K 置于 M 处,铁的保护属于牺牲阳极的阴极保护法 C.若 X 为碳棒,开关 K 置于 N 处,铁的保护属于外接电流的阴极保护法 D.若 X 为碳棒,开关 K 置于 N 处,X 极发生还原反应 D [若 X 为碳棒,开关 K 置于 N 处,X 极为阳极,发生氧化反应。] 5.(2015·重庆高考节选)如图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图。 【导学号:99682213】 (1)腐蚀过程中,负极是________(填图中字母“a”或“b”或“c”); (2)环境中的 Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈 Cu2(OH)3Cl,其离子方程式为_______________________________; (3)若生成 4.29 g Cu2(OH)3Cl,则理论上耗氧体积为________L(标准状况)。 [解析] (1)负极发生失电子的反应,铜作负极失电子,因此负极为 c。负极反应:Cu -2e-===Cu2+,正极反应:O2+2H2O+4e-===4OH-。 (2)正极产物为 OH-,负极产物为 Cu2+,两者与 Cl-反应生成 Cu2(OH)3Cl,其离子方程式 为 2Cu2++3OH-+Cl-===Cu2(OH)3Cl↓。 (3)4.29 g Cu2(OH)3Cl 的物质的量为 0.02 mol,由 Cu 元素守恒知,发生电化学腐蚀失 电子的 Cu 单质的物质的量为 0.04 mol,失去电子 0.08 mol,根据电子守恒可得,消耗 O2 的物质的量为 0.02 mol,所以理论上消耗氧气的体积为 0.448 L(标准状况)。 [答案] (1)c (2)2Cu2++3OH-+Cl-===Cu2(OH)3Cl↓ (3)0.448 判断金属腐蚀快慢的方法 (1)对同一电解质溶液来说,腐蚀的快慢:电解池原理引起的腐蚀>原电池原理引起的腐 蚀>化学腐蚀>有防护措施的腐蚀。 (2)对同一金属来说,腐蚀的快慢:强电解质溶液中>弱电解质溶液中>非电解质溶液中。 (3)活泼性不同的两种金属,活泼性差异越大,腐蚀越快。 (4)对同一种电解质溶液来说,电解质浓度越大,金属腐蚀速率越快。 专项突破 7 特定新型电池的命题分析 命题点 1 特定装置的新型电池原理分析 (1)特定装置的新型电池的命题点 ①两极的判断及电极反应式的书写与判断。 ②两极产物及反应类型判断。 ③电子、电流、离子的移动方向的判断。 ④电池总反应式的书写与判断。 ⑤转移电子及产物的计算。 (2)特定装置的新型电池的分析思路 ①分析装置中提供的信息:如反应物或产物、介质粒子成分、交换膜的类型、离子移动 方向、电极材料等。 ②分析两极反应原理及电极反应或总反应。 ③完成有关问题。 [对点训练 1] (2015·全国卷Ⅰ)微生物电池是指在微生物的作用下将化学能转化为 电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是( ) A.正极反应中有 CO2 生成 B.微生物促进了反应中电子的转移 C.质子通过交换膜从负极区移向正极区 D.电池总反应为 C6H12O6+6O2===6CO2+6H2O A [图示所给出的是原电池装置。A.有氧气反应的一极为正极,发生还原反应,因为有 质子通过,故正极电极反应式为 O2+4e-+4H+===2H2O,C6H12O6 在微生物的作用下发生氧化反 应,电极反应式为 C6H12O6-24e-+6H2O===6CO2+24H+,负极上有 CO2 产生,故 A 不正确。B. 微生物电池是指在微生物作用下将化学能转化为电能的装置,所以微生物促进了反应中电子 的转移,故 B 正确。C.质子是阳离子,阳离子由负极区移向正极区,故 C 正确。D.正极的电 极反应式为 6O2+24e-+24H+===12H2O,负极的电极反应式为 C6H12O6-24e-+6H2O===6CO2+24H +,两式相加得电池总反应为 C6H12O6+6O2===6CO2+6H2O,故 D 正确。] [对点训练2] (2014·全国卷Ⅱ)2013年3月我国科学家报道了如图所示的水溶液锂离 子电池体系。下列叙述错误..的是( ) 【导学号:99682214】 A.a 为电池的正极 B.电池充电反应为 LiMn2O4===Li1-xMn2O4+xLi C.放电时,a 极锂的化合价发生变化 D.放电时,溶液中 Li+从 b 向 a 迁移 C [图示所给出的是原电池装置。A.由图示分析,金属锂易失电子,由原电池原理可知, 含有锂的一端为原电池的负极,即 b 为负极,a 为正极,故正确。B.电池充电时为电解池, 反应式为原电池反应的逆反应,故正确。C.放电时,a 极为原电池的正极,发生还原反应的 是 Mn 元素,锂元素的化合价没有变化,故不正确。D.放电时为原电池,锂离子为阳离子, 应向正极(a 极)迁移,故正确。] [对点训练 3] (2016·全国甲卷)Mg-AgCl 电池是一种以海水为电解质溶液的水激活 电池。下列叙述错误的是( ) 【导学号:99682215】 A.负极反应式为 Mg-2e-===Mg2+ B.正极反应式为 Ag++e-===Ag C.电池放电时 Cl-由正极向负极迁移 D.负极会发生副反应 Mg+2H2O===Mg(OH)2+H2↑ B [根据题意,Mg-海水-AgCl 电池总反应式为 Mg+2AgCl===MgCl2+2Ag。A 项,负极 反应式为 Mg-2e-===Mg2+,正确;B 项,正极反应式为 2AgCl+2e-===2Cl-+ 2Ag,错误;C 项,对原电池来说,阴离子由正极移向负极,正确;D 项,由于镁是活泼金属,则负极会发 生副反应 Mg+2H2O===Mg(OH)2+H2↑,正确。] [对点训练 4] (1)如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能, 非常适合进行现场酒精检测。负极反应式为__________________, 正极反应式为__________________________________________。 (2)浓差电池中的电动势是由于电池中存在浓度差而产生的。某浓差电池的原理如图所 示,该电池从浓缩海水中提取 LiCl 的同时又获得了电能。 ①X 为________极,Y 电极反应式为______________________________。 ②Y 极生成 1 mol Cl2 时,________ mol Li+移向________极(填 X 或 Y)。 (3)一种以肼(N2H4)为液体燃料的电池装置如图所示。该电池用空气中的氧气作氧化剂, KOH 作电解质。 负极反应式为_______________________________________, 正极反应式为______________________________________。 [解析] (1)根据装置可知 O2 得电子,在正极反应生成 H+,呼气中的 C2H5OH 失电子,在 负极反应生成 CH3COOH。 (2)根据装置可知生成 H2 的电极为正极,生成 Cl2 的电极为负极。 (3)根据装置可知 N2H4→N2 为氧化反应,在负极上反应。 [答案] (1)C2H5OH-4e-+H2O===CH3COOH+4H+ O2+4e-+4H+===2H2O (2)①正 2Cl--2e-===Cl2↑ ②2 X (3)N2H4-4e-+4OH-===N2↑+4H2O O2+4e-+2H2O===4OH- 命题点 2 特定介质燃料电池的原理分析 四类介质环境下的两极反应原理(以甲醇 CH3OH 为例) (1)酸性溶液或质子交换膜条件: 正极:3O2+12H++12e-===6H2O, 负极:2CH3OH-12e-+2H2O===2CO2↑+12H+ (2)碱性溶液条件: 正极:3O2+6H2O+12e-===12OH-, 负极:2CH3OH-12e-+16OH-===2CO2- 3 +12H2O (3)固体氧化物(传导 O2-)条件: 正极:3O2+12e-===6O2-, 负极:2CH3OH-12e-+6O2-===2CO2↑+4H2O (4)熔融碳酸盐(含 CO2- 3 )条件: 正极:3O2+12e-+6CO2===6CO2- 3 , 负极:2CH3OH-12e-+6CO2- 3 ===8CO2↑+4H2O [对点训练 5] (2017·武汉模拟)下图是以葡萄糖为燃料的微生物燃料电池结构示意 图。关于该电池的叙述不正确的是( ) 【导学号:99682216】 A.该电池不能在高温下工作 B.电池的负极反应为 C6H12O6+6H2O-24e-===6CO2↑+24H+ C.放电过程中,电子从正极区向负极区每转移 1 mol,便有 1 mol H+从阳极室进入阴 极室 D.微生物燃料电池具有高能量转换效率、原料广泛、操作条件温和、有生物相容性等 优点,值得研究与推广 C [高温条件下微生物会死亡,该电池不能正常工作,A 选项正确;电池的负极失电子, 发生氧化反应,即葡萄糖失电子生成二氧化碳气体,B 选项正确;放电过程中,电子从负极 区向正极区转移,C 选项错误;结合题给条件分析,D 选项正确。] [对点训练 6] 近年来 AIST 报告正在研制一种“高容量、低成本”锂-铜空气燃料电 池。该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为 2Li+Cu2O+H2O===2Cu +2Li++2OH-,下列说法不正确的是( ) A.放电时,Li+透过固体电解质向 Cu 极移动 B.放电时,负极的电极反应式为 Cu2O+H2O+2e-===2Cu+2OH- C.通空气时,铜被腐蚀,表面产生 Cu2O D.整个反应过程中,铜相当于催化剂 B [放电时,负极反应为 Li -e-===Li+,Li+透过固体电解质向 Cu 极移动,A 项正确; 正极反应为 Cu2O+2e-+H2O===2Cu+2OH-,B 项错误;通空气时,铜被氧化为 Cu2O:4Cu+ O2===2Cu2O,总反应为 4Li+O2+2H2O===4LiOH,铜相当于催化剂,C、D 正确。] [对点训练 7] (2017·烟台一模)LED 系列产品是一类新型节能产品,图甲是 NaBH4/H2O2 燃料电池,图乙是 LED 发光二极管的装置示意图。下列叙述错误的是( ) A.电池 A 极区的电极反应式为 H2O2+2e-===2OH- B.电池放电过程中,Na+从负极区向正极区移动 C.每有 1 mol NaBH4 参加反应转移电子数为 4NA D.要使 LED 发光二极管正常发光,图乙中的导线 a 应与图甲中的 B 极相连 C [A 项,根据图甲知,双氧水得电子发生还原反应,则 A 电极为正极,正极电极反应 式为 H2O2+2e-===2OH-,故 A 正确;B 项,电池放电过程中,阳离子移向正极,Na+从负极区 向正极区移动,故 B 正确;C 项,负极发生氧化反应生成 BO- 2 ,电极反应式为 BH- 4 +8OH-- 8e-===BO- 2 +6H2O,有 1 mol NaBH4 参加反应转移电子数为 8NA,故 C 错误;D 项,要使 LED 发光二极管正常发光,图乙中的导线 a 阴极应与图甲中的 B 极负极相连,故 D 正确。] [对点训练 8] (1)(2013·全国卷Ⅰ节选)二甲醚(OCH3CH3)直接燃料电池具有启动快、 效率高等优点,其能量密度高于甲醇直接燃料电池(5.93 kW·h·kg-1)。若电解质为酸性, 二甲醚直接燃料电池的负极反应为__________________________,1 个二甲醚分子经过电化 学氧化,可以产生________个电子的电量;该电池的理论输出电压为 1.20 V,能量密度 E =______________(列式计算。能量密度=电池输出电能/燃料质量,1 kW·h=3.6×106 J)。 (2)一种熔融碳酸盐燃料电池原理示意图如图所示。 ①电极 A 为________极,CO 和 H2 按体积比 1∶1 发生的电极反应式为 ______________________________________________________________。 ②电极 B 的反应式为____________________________________。 ③CO 2- 3 向________极迁移(填 A 或 B)。 [解析] (1)由题意可得:CH3OCH3-12e-+3H2O===2CO2+12H+,1 个 CH3OCH3 产生 12 个电 子。 (2)CO、H2 为燃料,在负极上反应。 [答案] (1)CH3OCH3-12e-+3H2O===2CO2+12H+ 12 1.20 V×1 000 g 46 g·mol-1 ×12×96 500 C·mol-1 1 kg ÷(3.6×106 J·kW-1·h-1)≈8.39 kW·h·kg -1 (2)①负 CO+H2-4e-+2CO2- 3 ===3CO2+H2O ②O2+4e-+2CO2===2CO2- 3 ③A [课堂小结·反馈达标 1+1] 全新理念 探究高考 明确考向 1.一组判断,展示高考易误点 (1)在化学反应中,所有自发的放热反应均可以设计成原电池。( ) (2)原电池中,负极发生氧化反应,正极发生还原反应。( ) (3)Mg-Al 形成的原电池,Mg 一定作负极。( ) (4)Cu、Al、浓 HNO3 构成的原电池的负极反应为 Al-3e-===Al3+。( ) (5)在原电池中,正极本身一定不参与电极反应,负极本身一定要发生氧化反应。( ) (6)相同情况下,带有“盐桥”的原电池比不带“盐桥”的原电池电流持续时间长。 ( ) (7)以熔融 Na2CO3 为介质的 H2 燃料电池的负极反应为 H2-2e-===2H+。( ) (8)化学电源工作时,内电路介质中的阳离子一定向正极迁移。( ) (9)实验室制备 H2 时,用粗锌(含 Cu、Fe 等)代替纯锌与盐酸反应效果更佳。( ) (10)原电池反应时,电子从负极流出经导线流入正极,然后通过溶液流回负极。( ) (11)二次电池充电时,二次电池的负极连接电源的负极,发生还原反应。( ) [ 答 案 ] (1)× (2)√ (3)× (4)× (5)× (6)√ (7)× (8)√ (9)√ (10)× (11)√ 2.一题串知,覆盖高考考什么 (1)(2015·全国卷Ⅰ)微生物电池是指在微生物的作用下将化学能转化为电能的装置, 其工作原理如图所示。 ①右电极是________极,发生________反应。[考查原电池中电极判断及反应原理] ②两极反应式,负极______________________________________________, 正极____________________________________________。 [考查电极反应式的书写] ③质子向________极迁移(填“正”或“负”,下同),电子从________极流出。[考查 原电池反应时离子、电子移向] ④当有 1 mol O2 消耗时,C6H12O6 消耗________ mol。[考查原电池的有关计算] (2)(2016·全国丙卷)锌—空气燃料电池可用作电动车动力电源,电池的电解值溶液为 KOH 溶液,反应为 2Zn+O2+4OH-+2H2O===2Zn(OH)2- 4 。 ①该燃料电池的负极材料是________,正极电极反应式为_______。[考查化学电源放电 原理和电极反应式] ②充电时,外接电源负极的燃料电池电极是________极,其电极反应式为 ______________________________________________________________。 [考查化学电源充电原理] ③充电时,溶液中 K+向燃料电池的________极迁移(填“正”或“负”)。[考查化学电 源充电时,离子迁移方向] [答案] (1)①正 还原 ②C6H12O6 +6H2O-24e- ===6CO2 +24H + 6O2 +24e- +24H+ ===12H2O ③正 负 ④0.17 或1 6 (2)①Zn O2+4e-+2H2O===4OH- ②负 Zn(OH)2- 4 +2e-===Zn+4OH- ③负查看更多