2020年高考真题+高考模拟题 专项版解析汇编 化学——10 水溶液中的离子平衡(教师版)
专题10 水溶液中的离子平衡
2020年高考真题
1.【2020年7月浙江选考】下列物质在熔融状态下不导电的是( )
A. B. C. D.
【答案】C
【解析】A.NaOH属于离子化合物,其在熔融状态下能电离成自由移动的Na+和OH-,故其在熔融状态下能导电,A不符合题意;
B.CaCl2属于离子化合物,其在熔融状态下能电离成自由移动的Ca2+和Cl-,故其在熔融状态下能导电,B不符合题意;
C.HCl是共价化合物,其在熔融状态下不能电离成离子,故其在熔融状态下不导电,C符合题意;
D.K2SO4属于离子化合物,其在熔融状态下能电离成自由移动的K+和SO,故其在熔融状态下能导电,D不符合题意。
综上所述,本题答案为C。
2.【2020年7月浙江选考】水溶液呈酸性的是( )
A. B. C. D.
【答案】B
【解析】A.NaCl是强酸强碱盐,其不能水解,故其水溶液呈中性,A不符合题意;
B.NaHSO4是强酸的酸式盐,其属于强电解质,其在水溶液中的电离方程式为NaHSO4=Na++H++SO,故其水溶液呈酸性,B符合题意;
C.HCOONa属于强碱弱酸盐,其在水溶液中可以完全电离,其电离产生的HCOO-可以发生水解,其水解的离子方程式为HCOO-+H2O⇌HCOOH+OH-,故其水溶液呈碱性,C不符合题意;
D.NaHCO3是强碱弱酸盐,既能发生电离又能发生水解,但其水解程度大于电离程度,故其水溶液呈碱性,D不符合题意。
综上所述,本题答案为B。
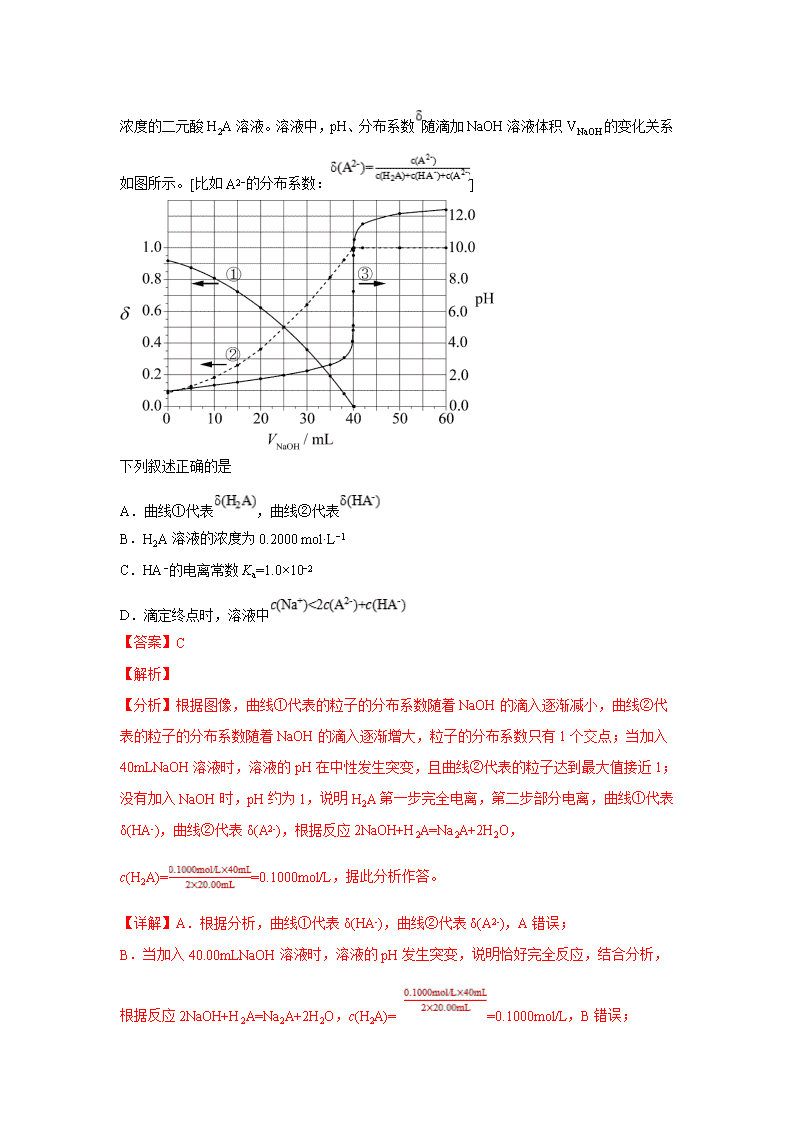
3.【2020年新课标】以酚酞为指示剂,用0.1000 mol·L−1的NaOH溶液滴定20.00
mL未知浓度的二元酸H2A溶液。溶液中,pH、分布系数随滴加NaOH溶液体积VNaOH的变化关系如图所示。[比如A2−的分布系数:]
下列叙述正确的是
A.曲线①代表,曲线②代表
B.H2A溶液的浓度为0.2000 mol·L−1
C.HA−的电离常数Ka=1.0×10−2
D.滴定终点时,溶液中
【答案】C
【解析】
【分析】根据图像,曲线①代表的粒子的分布系数随着NaOH的滴入逐渐减小,曲线②代表的粒子的分布系数随着NaOH的滴入逐渐增大,粒子的分布系数只有1个交点;当加入40mLNaOH溶液时,溶液的pH在中性发生突变,且曲线②代表的粒子达到最大值接近1;没有加入NaOH时,pH约为1,说明H2A第一步完全电离,第二步部分电离,曲线①代表δ(HA-),曲线②代表δ(A2-),根据反应2NaOH+H2A=Na2A+2H2O,c(H2A)==0.1000mol/L,据此分析作答。
【详解】A.根据分析,曲线①代表δ(HA-),曲线②代表δ(A2-),A错误;
B.当加入40.00mLNaOH溶液时,溶液的pH发生突变,说明恰好完全反应,结合分析,根据反应2NaOH+H2A=Na2A+2H2O,c(H2A)= =0.1000mol/L,B错误;
C.根据曲线当δ(HA-)=δ(A2-)时溶液的pH=2,则HA-的电离平衡常数Ka==c(H+)=1×10-2,C正确;
D.用酚酞作指示剂,酚酞变色的pH范围为8.2~10,终点时溶液呈碱性,c(OH-)>c(H+),溶液中的电荷守恒为c(Na+)+c(H+)=2c(A2-)+c(HA-)+c(OH-),则c(Na+)>2c(A2-)+c(HA-),D错误;
答案选C。
【点睛】本题的难点是判断H2A的电离,根据pH的突变和粒子分布分数的变化确定H2A的电离方程式为H2A=H++A2-,HA-⇌H++A2-;同时注意题中是双纵坐标,左边纵坐标代表粒子分布分数,右边纵坐标代表pH,图像中δ(HA-)=δ(A2-)时溶液的pH≠5,而是pH=2。
4.【2020年新课标Ⅱ】二氧化碳的过量排放可对海洋生物的生存环境造成很大影响,其原理如下图所示。下列叙述错误的是
A.海水酸化能引起浓度增大、浓度减小
B.海水酸化能促进CaCO3的溶解,导致珊瑚礁减少
C.CO2能引起海水酸化,其原理为H++
D.使用太阳能、氢能等新能源可改善珊瑚的生存环境
【答案】C
【解析】A.海水酸化,H+浓度增大,平衡H++⇌正向移动,浓度减小,浓度增大,A正确;
B.海水酸化,浓度减小,导致CaCO3溶解平衡正向移动,促进了CaCO3溶解,导致珊瑚礁减少,B正确;
C.CO2引起海水酸化的原理为:CO2+H2O⇌H2CO3⇌H++,⇌H++,导致H+浓度增大,C错误;
D.使用太阳能、氢能等新能源,可以减少化石能源的燃烧,从而减少CO2的排放,减弱海水酸化,从而改善珊瑚礁的生存环境,D正确;
答案选C。
5.【2020江苏卷】常温下,下列各组离子在指定溶液中能大量共存的是
A.氨水溶液:Na+、K+、OH-、NO
B.盐酸溶液:Na+、K+、SO、SiO
C.KMnO4溶液:NH、Na+、NO、I-
D.AgNO3溶液:NH、Mg2+、Cl-、SO
【答案】A
【解析】A.在0.1mol/L氨水中,四种离子可以大量共存,A选;
B.在0.1mol/L盐酸中含有大量氢离子,四种离子中硅酸根可以与氢离子反应生成硅酸沉淀,故不能共存,B不选;
C.具有强氧化性,可以将碘离子氧化成碘单质,故不能共存,C不选;
D.在0.1mol/L硝酸银溶液中,银离子可以与氯离子、硫酸根离子反应生成氯化银、硫酸银沉淀,不能共存,D不选;
故选A。
6.【2020天津卷】常温下,下列有关电解质溶液的说法错误的是
A.相同浓度的 HCOONa和NaF两溶液,前者的pH较大,则
B.相同浓度的CH3COOH和CH3COONa两溶液等体积混合后pH约为4.7,则溶液中
C.FeS溶于稀硫酸,而CuS不溶于稀硫酸,则
D.在溶液中,
【答案】A
【解析】A.HCOONa和NaF的浓度相同,HCOONa溶液的pH较大,说明HCOO-
的水解程度较大,根据越弱越水解,因此甲酸的电离平衡常数较小,即Ka(HCOOH)<Ka(HF),故A错误;
B.相同浓度的CH3COOH和CH3COONa两溶液等体积混合后pH约为4.7,此时溶液呈酸性,氢离子浓度大于氢氧根浓度,说明溶液中醋酸电离程度大于水解程度,则醋酸根浓度大于钠离子浓度,则溶液中c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故B正确;
C.CuS的溶解度较小,将CuS投入到稀硫酸溶液中,CuS溶解平衡电离出的S2−不足以与H+发生反应,而将FeS投入到稀硫酸后可以得到H2S气体,说明Ksp(FeS)>Ksp(CuS),故C正确;
D.根据溶液中的物料守恒定律,1 mol∙L−1 Na2S溶液中所有含S元素的粒子的总物质的量的浓度为1 mol∙L−1,即c(S2−)+c(HS-)+c(H2S)=1 mol∙L−1,故D正确;
综上所述,答案为A。
7.【2020年7月浙江选考】下列说法不正确的是( )
A.的盐酸中
B.将溶液从常温加热至,溶液的变小但仍保持中性
C.常温下,溶液呈碱性,说明是弱电解质
D.常温下,为3的醋酸溶液中加入醋酸钠固体,溶液增大
【答案】A
【解析】A.盐酸的浓度为2.0×10-7 mol/L,完全电离,接近中性,溶剂水电离出的氢离子浓度的数量级与溶质HCl电离的氢离子浓度相差不大,则计算中氢离子浓度时,不能忽略水中的氢离子浓度,其数值应大于2.0×10-7 mol/L,故A错误;
B.KCl溶液为中性溶液,常温下pH=7,加热到80时,水的离子积Kw增大,对应溶液的氢离子浓度随温度升高会增大,pH会减小,但溶液溶质仍为KCl,则仍呈中性,故B正确;
C.NaCN溶液显碱性,说明该溶质为弱酸强碱盐,即CN-对应的酸HCN为弱电解质,故C正确;
D.醋酸在溶液中会发生电离平衡:CH3COOHCH3COO-+H+,向溶液中加入醋酸钠固体,根据同离子效应可知,该平衡会向生成弱电解质的方向(逆向)移动,使溶液中的氢离子浓度减小,pH增大,故D正确;
答案选A。
8.【2020年7月浙江选考】常温下,用氨水滴定浓度均为的和的混合液,下列说法不正确的是( )
A.在氨水滴定前,和的混合液中
B.当滴入氨水时,
C.当滴入氨水时,
D.当溶液呈中性时,氨水滴入量大于,
【答案】D
【解析】A.未滴定时,溶液溶质为HCl和CH3COOH,且浓度均为0.1mol/L,HCl为强电解质,完全电离,CH3COOH为弱电解质,不完全电离,故,c(Cl-)>c(CH3COO-),A正确;
B.当滴入氨水10mL时,n(NH3·H2O)=n(CH3COOH),则在同一溶液中c(NH4+)+ c(NH3·H2O)=c(CH3COOH)+ c(CH3COO-),B正确;
C. 当滴入氨水20mL时,溶液溶质为NH4Cl和CH3COONH4,质子守恒为c(CH3COOH)+c(H+)= c(NH4+)+c(OH-),C正确;
D.当溶液为中性时,电荷守恒为:c(NH4+)+c(H+)= c(CH3COO-)+c(Cl-)+ c(OH-),因为溶液为中性,则c(H+)=c(OH-),故c(NH4+)>c(Cl-),D不正确;
故选D。
9.(2020年江苏卷)室温下,将两种浓度均为的溶液等体积混合,若溶液混合引起的体积变化可忽略,下列各混合溶液中微粒物质的量浓度关系正确的是
A.混合溶液(pH=10.30):
B.氨水-NH4Cl混合溶液(pH=9.25):
C.混合溶液(pH=4.76):
D.混合溶液(pH=1.68,H2C2O4为二元弱酸):
【答案】AD
【解析】A.NaHCO3水溶液呈碱性,说明的水解程度大于其电离程度,等浓度的NaHCO3和Na2CO3水解关系为:,溶液中剩余微粒浓度关系为:,和水解程度微弱,生成的OH-浓度较低,由NaHCO3和Na2CO3化学式可知,该混合溶液中Na+浓度最大,则混合溶液中微粒浓度大小关系为:,故A正确;
B.该混合溶液中电荷守恒为:,物料守恒为:,两式联立消去c(Cl-)可得:,故B错误;
C.若不考虑溶液中相关微粒行为,则c(CH3COOH)=c(CH3COO-)=c(Na+),该溶液呈酸性,说明CH3COOH电离程度大于CH3COONa水解程度,则溶液中微粒浓度关系为:c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+),故C错误;
D.该混合溶液中物料守恒为:,电荷守恒为:,两式相加可得:,故D正确;
综上所述,浓度关系正确的是:AD。
10.(2020年山东省新高考)25℃时,某混合溶液中,1gc( CH3COOH)、1gc(CH3COO-)、lgc(H+)和1gc(OH-)随pH变化的关系如下图所示。Ka为CH3COOH的电离常数,下列说法正确的是
A.O点时,
B.N点时,
C.该体系中,
D.pH由7到14的变化过程中, CH3COO-的水解程度始终增大
【答案】BC
【解析】
【分析】根据图像分析可知,随着pH的升高,氢氧根离子和醋酸根离子浓度增大,氢离子和醋酸离子浓度减小,又pH=7的时候,氢氧根离子浓度等于氢离子浓度,故可推知,图中各曲线代表的浓度分别是:曲线1为lgc(CH3COO-)随pH的变化曲线,曲线2为lgc(H+)随pH的变化曲线,曲线3为lgc(OH-)随pH的变化曲线,曲线4为lgc(CH3COOH)随pH的变化曲线,据此结合水溶液的平衡分析作答。
【详解】A.根据上述分析可知,O点为曲线2和曲线3的交点,对应的pH=7,应该得出的结论为:c(H+)= c(OH-),故A错误;
B.N点为曲线1和曲线4的交点, lgc(CH3COO-)=lgc(CH3COOH),即c(CH3COO-)=c(CH3COOH),因Ka=,代入等量关系并变形可知pH=-lgKa,故B正确;
C.c(CH3COO-)+c(CH3COOH)=0.1mol/L,则c(CH3COO-)=0.1mol/L- c(CH3COOH),又Ka=,联立两式消去c(CH3COO-)并化简整理可得出,c(CH3COOH)=mol/L,故C正确;
D.醋酸根离子的水解平衡为:CH3COO-+H2O CH3COOH +OH-,pH由7到14的变化过程中,碱性不断增强,c(OH-
)不断增大,则使不利于醋酸根离子的水解平衡,会使其水解程度减小,故D错误;
答案选BC。
2020届高考模拟试题
11.(2020届广东省深圳市高三第一次调研)常温下,向溶液中加入足量的镁条,该体系随时间变化的曲线如图所示。实验观察到点开始溶液中有白色沉淀生成,已知。下列说法错误的是
A.常温下,的水解平衡常数数量级为
B.体系中,水的电离程度大小关系为
C.点时,溶液中
D.点溶液中,
【答案】B
【解析】A.常温下,氯化铵的水解平衡式为:NH4++H2O⇌NH3∙H2O+H+,则Kh= ,由于氨水和氢离子浓度几乎相等,根据图像可知,没加镁之前,溶液的pH=5,c(NH3·H2O)≈c(H+)=10-5mol/L,c(NH4+)= 1mol/L,则Kh= =10-10,水解平衡常数数量级为,故A正确;
B.氯化铵的水解平衡式为:NH4++H2O⇌ NH3∙H2O +H+,加入镁单质时,消耗了氢离子,使平衡正向移动,促进铵根离子的水解,即促进了水的电离,故水的电离程度大小关系为c>b>a,故B错误;
C.点时,,pH=9,c(H+)=10-9mol/L,c(OH-)=10-5,c(Mg2+)=,故C正确;
D.点溶液中,电荷守恒式为:,故
,故D正确;
答案选B。
12.(2020届河南省郑州市高三第二次质检)25℃时,用 0.1mol•L-1NaOH溶液滴定 20 mL 0.1 mol•L-1 某二元弱酸 H2A ( Ka1 =1.1×10-3,Ka2= 3.9×10-6 )溶液,滴定过程中溶液的 pH 变化曲线如图所示。下列说法正确的是
A.a 点的pH 大于2
B.b 点溶液中c(H2A) > c(A2-)
C.c 点溶液中c( HA-) + 2c(H2A ) = c( OH- )-c(H+)
D.d 点溶液中c (Na+) +c(H+) =c(A2-) +c(HA-) +c(OH-)
【答案】C
【解析】A. a 点发生H2A的电离且Ka1>>Ka2,故Ka1=c(HA−)×c(H+)/c(H2A)=1.1×10-3,则c2(H+)=1.1×10-3×0.1,解得c(H+)≈1.05×10-2,故pH小于2,A项错误;
B. b点酸碱恰好完全反应生成NaHA,溶液显酸性,溶液中电荷守恒c(Na+)+c(H+)=c(HA-)+c(OH-)+2c(A2-),物料守恒c(Na+)=c(HA-)+c(A2-)+c(H2A),得到:c(H2A)+c(H+)=c(A2-)+c(OH-),则c(H2A)<c(A2-),B项错误;
C. c点为Na2A,溶液显碱性,溶液中电荷守恒c(Na+)+c(H+)=c(HA-)+c(OH-)+2c(A2-),物料守恒c(Na+)=2c(HA-)+2c(A2-)+2c(H2A),得到:c(HA-)+2c(H2A )=c(OH- )-c(H+),C项正确;
D. d点为Na2A和NaOH的混合物,溶液显碱性,溶液中电荷守恒c(Na+)+c(H+)=c(HA-)+c(OH-)+2c(A2-),D项错误;
答案选C。
13.(2020届安徽省江淮十校联考)工业上常用(NH4)2SO3溶液吸收废气中的SO2,室温下测得溶液中lgY[Y=或],与pH的变化关系如图所示。则下列说法一定错误的是
A.通入少量SO2的过程中,直线Ⅱ中的N点向M点移动
B.α1=α2一定等于45°
C.当对应溶液的pH处于1.81
c(SO32-)>c(H2SO3)
D.直线Ⅱ中M、N点一定存在c2(HSO3-)>c(SO32-)·c(H2SO3)
【答案】C
【解析】A.通入少量二氧化硫的过程中,溶液的酸性增强,直线Ⅱ中的N点向M点移动;
B. ,则,,同理可得,故α1=α2一定等于45°;
C.由图像可知,当对应溶液的pH处于1.810,溶液中c(H2SO3)、c(SO32-)的大小无法确定;
D.由于Ka1>Ka2,,则c2(HSO3-)>c(SO32-)·c(H2SO3);
答案选C。
14.(2020届广东省佛山市质检)向废水中加入硫化物可以依次获得CuS、 ZnS纳米粒子。常温下,H2S的Ka1=1.3×10-7,Ka2=7.1×10-15,溶液中平衡时相关离子浓度的关系如图,下列说法错误的是
A.Ksp(CuS)的数量级为10-37
B.a点对应的CuS溶液为不饱和溶液
C.向p点的溶液中加入少量NaS固体,溶液组成由p向q方向移动
D.H2S+Zn2+ZnS + 2H+平衡常數很大,反应趋于完全
【答案】D
【解析】A.由图中数据可知当c(Cu2+)=10-18mol/L时,c(S2-)=10-18.3mol/L,则数量级为10-37,故A正确;
B.计算a点的离子浓度积为<则溶液为不饱和溶液,故B正确;
C.向p点的溶液中加入少量NaS固体,溶液中c(S2-)增大,则c(Cu2+)减小,故C正确;
D.H2S+Zn2+ZnS + 2H+平衡常數平衡常数不是很大,反应不趋于完全,故D错误;
故答案选:D。
15.(2020届湖北省七市州教科研协作5月高三联合)常温下,已知醋酸的电离常数为1.75×10-5,向20mL0.01mol·L-1CH3COOH溶液中逐滴加入0.01mol·L-1的NaOH溶液,溶液中水电离的c(H+)随加入NaOH溶液的体积变化如图所示,下列说法正确的是(已知=4.2)
A.b、d两点溶液的pH相同
B.b点溶液中离子浓度大小顺序是:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C.e点所示溶液中,c(Na+)=2[c(CH3COO-)+c(CH3COOH)]=0.005mol/L
D.a点坐标为(0,2.4×10-11)
【答案】D
【解析】A. CH3COOH溶液中加入NaOH发生CH3COOH+NaOH=CH3COONa+H2O,b点消耗NaOH的体积为10mL,NaOH和CH3COOH的物质的量浓度相等,则此时溶液中溶质为CH3COOH和CH3COONa,且两者物质的量相等,CH3COO-的水解常数为<1.75×10-5,CH3COOH的电离大于CH3COO-水解,即b点溶液显酸性,d点溶质为CH3COONa和NaOH,溶液显碱性,b、d两点pH不相同,故A错误;
B. 根据A选项分析,b点溶液中溶质为CH3COOH和CH3COONa,且两者物质的量相等,CH3COOH的电离大于CH3COO-的水解,因此离子浓度大小顺序是c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故B错误;
C. e点溶质为CH3COONa和NaOH,且两者物质的量相等,根据物料守恒,因此有c(Na+)=2[c(CH3COOH)+c(CH3COO-)]=,故C错误;
D. CH3COO发生电离:CH3COOH CH3COO-+H+,电离平衡常数Ka==1.75×10-5,因此有c2(H+)=1.75×10-7,即c(H+)=4.2×10-4mol·L-1
,根据水的离子积,则溶液中c(OH-)=≈2.4×10-11 ,即水电离出的c(H+)=2.4×10-11mol·L-1,故D正确;
答案:D。
16.(2020届广东省汕头市高三一模)在某温度时,将 n mol·L-1氨水滴入 10 mL 1.0 mol·L-1盐酸中,溶液 pH 和温度随加入氨水体积变化曲线如图所示。下列有关说法错误的是
A.c 点存在守恒关系:c(NH4+)=c(Cl-)
B.b 点:c(Cl-)> c(NH4+)>c(H+)>c(OH-)
C.水的电离程度:b > c > a > d
D.25℃时 ,NH4Cl 水解平衡常数为(n-1)×10-7(用 n 表示)
【答案】C
【解析】A.c点溶液呈中性,所以c(H+)=c(OH-),由电荷守恒分析c(NH4+)+c(H+)=c(Cl-)+c(OH-),所以c(NH4+)=c(Cl-),A正确;
B.b点溶液为NH4Cl溶液,此溶液中离子浓度大小为c(Cl-)>c(NH4+)>c(H+)>c(OH-),B正确;
C.b点溶液温度最高,说明此时两溶液恰好反应生成氯化铵,铵根离子水解促进了水的电离,则a、d两点都抑制了水的电离,则b点水的电离程度最大;由于d点混合液的pH不知,则无法判断a、d两点水的电离程度大小,C错误;
D.根据图象可知,25℃时溶液的pH=7,则:c(H+)=c(OH-)=10-7mol/L,c(NH4+)=c(Cl-)=0.5mol/L,根据物料守恒可知:c(NH3·H2O)=(0.5n-0.5)mol/L,则25℃时NH4Cl水解常数为Kh==(n-1)10-7,D正确;
故选C。
17.(2020届广东省茂名市高三二模)
某些难溶性铅盐可用作涂料,如秦俑彩绘中使用的铅白(PbCO3)和黄金雨中黄色的PbI2。室温下,PbCO3 和 PbI2 在不同的溶液中分别达到溶解平衡时-lgc(Pb2+)与-lgc(CO32-)或-lgc(I-)的关系如图所示。下列说法错误的是
A.Ksp(PbCO3)的数量级为 10-14
B.相同条件下,水的电离程度 p 点大于 q 点
C.L1 对应的是-lgc(Pb2+)与-lgc(I-)的关系变化
D.p 点溶液中加入 Na2CO3 浓溶液,可得白色沉淀
【答案】B
【解析】A. 由上述分析可知图像L2 对应的是-lgc(Pb2+)与-lgc(CO32-)的关系变化,则数量级为 10-14,故A正确;
B. 相同条件下,P点和Q点的铅离子浓度相同,P点为碘化铅的饱和溶液,Q点为碳酸铅的饱和溶液,由于碘离子不水解,则CO32-可以发生水解,其水解促进了水的电离,则水的电离程度 p 点小于 q 点,故B错误;
C. L1 对应的是-lgc(Pb2+)与-lgc(I-)的关系变化,故C正确;
D. ,,,则p 点溶液中加入 Na2CO3 浓溶液,可得白色沉淀,故D正确;
故答案选:B。
18.(2020届广东省茂名市高三综合测试)常温下,在“H2S—HS-—S2-”的水溶液体系中,H2S、HS-、S2-三种微粒的物质的量分数随溶液pH变化(仅用H2S和NaOH调节pH)的关系如图所示。下列说法正确的是
A.Kal(H2S)的数量级为10-6
B.NaHS溶液中,c(Na+)>c(HS-)>c(S2-)>c(H2S)
C.当体系呈中性时,>
D.加入Na2S沉降废水中的Cu2+,废水的pH对沉降效果没有影响
【答案】C
【解析】A.c(HS−)=c(H2S)时,Ka1(H2S)= =c(H+)=10−6.9,数量级为10-7,故A错误;
B.c(HS-)和c(S2-)时,Ka2(H2S)= = c(H+)=10−13,NaHS溶液中,Kh===10-7.1> Ka2(H2S)=10−13,溶液呈碱性,说明HS−水解程度大于电离程度,则c(S2−)c(H2S),则>1、根据电荷守恒得c(Na+)=c(HS−)+2c(S2−),所以=1,则>,故C正确;
D.当加入Na2S沉降废水中的Cu2+,溶液中c(Cu2+)减小,Cu2+水解程度较小,则溶液的pH增大,故D错误;
答案选C。
19.(2020届五岳(湖南、河南、江西)高三线上联考)常温下,相同浓度的两种一元酸HX、HY分别用同一浓度的NaOH标准溶液滴定,滴定曲线如图所示。下列说法正确的是
A.HX、HY起始溶液体积相同
B.均可用甲基橙作滴定指示剂
C.pH相同的两种酸溶液中:
D.同浓度KX与HX的混合溶液中,粒子浓度间存在关系式:
【答案】D
【解析】A.反应达到终点时,HX与HY消耗NaOH溶液的体积分别是30mL和40mL,故起始酸的体积比为3:4,故A错误;
B.NaOH滴定HX达到滴定终点时,溶液pH约为8,而甲基橙的变色范围是,故不能用甲基橙做指示剂,故B错误;
C.由图像中两种酸浓度相同时的pH可知,HY的酸性强于HX的酸性,pH相同的两种酸溶液中,,故C错误;
D.同浓度的KX和HX的混合溶液中,存在电荷守恒为,物料守恒为,将物料守恒带入电荷守恒可得,故D正确;
答案选D。
20.(2020届四川省成都市6月三诊)如图为室温下某二元酸H2M溶液中H2M、HM-、M2-的浓度对数lgc随pH的变化图象。下列分析错误的是
A.该二元酸溶液浓度为0.010 mol/L
B.pH=1.89时,c(H2M)=c(HM-)>c(M2-)
C.pH=7.0时,lgc(M2-)-lgc(HM-)=0.77
D.在NaHM溶液中,水的电离受到抑制
【答案】A
【分析】据图可知溶液中H2M、HM-、M2-三种微粒可以同时存在,所以H2M应为二元弱酸, pH增大的过程中发生反应:H2M+OH-=HM-+H2O、HM-+OH-=M2-+H2O;
【详解】A.起点处,溶液中主要存在H2MHM-+H+,据图可知c(H2M)=0.1mol/L,c(HM-)=0.001mol/L,根据物料守恒,二元酸的浓度应为0.1mol/L+0.001mol/L=0.101mol/L,故A错误;
B.据图可知pH=1.89时c(H2M)=c(HM-)>c(M2-),故B正确;
C.lgc(M2-)-lgc(HM-)=lg,Ka2=,据图可知pH=6.23时,=1,所以Ka2=10-6.23,温度不变平衡常数不变,所以pH=7.0时=,所以lg=0.77,故C正确;
D.在NaHM溶液中含M元素主要以HM-的形式存在,据图可知当溶液中c(HM-)最大时,溶液呈酸性,说明HM-的电离程度大于水解程度,而电离抑制水的电离,水解促进水的电离,所以水的电离受到的抑制作用更大,故D正确;
故答案为A。
21.(2020届安徽省皖南八校高三临门一卷)常温下向一定浓度的Na2X溶液中滴入盐酸,粒子浓度与混合溶液的pH变化的关系如图所示,已知:H2X是二元弱酸,Y表示
或,pY=-lgY。下列叙述错误的是
A.曲线n表示与pH的变化关系
B.Ka1(H2X)=1.0×10-10.3
C.NaHX溶液中c(OH-)>c(H+)
D.当pH=7时,混合溶液中c(Na+)=c(HX-)+2c(X2-)+c(Cl-)
【答案】B
【分析】H2X为二元弱酸,以第一步电离为主,则Ka1(H2X)>Ka2(H2X),则pH相同时<,pY=-lgY,则p>p,则m、n分别表示pH与p、p的变化关系,据此结合选项分析解答。
【详解】A.根据分析可知,n表示pH与p的变化关系,A选项正确;
B.M点pH=9.3,c(H+)=10-9.3mol/L,p=-lg=1,则=0.1,所以Ka2(H2X)=×c(H+)=10-9.3×0.1=1.0×10-10.3,N点pH=7.4,c(H+)=10-7.4mol/L,p=-lg=-1,则=10,所以Ka1(H2X)=×c(H+)=10-7.4×10=1.0×10-6.4,B选项错误;
C.根据B可知HX﹣的电离平衡常数为1.0×10﹣10.3;曲线n表示pH与p
的变化关系,n点pH=7.4,p=-lg=-1,=10,所以HX-的水解平衡常数Kh===1.0×10-7.6>1.0×10-10.3,说明HX-的水解程度大于其电离程度,则NaHX溶液溶液呈碱性,c(H+)<c(OH-),C选项正确;
D.当溶液呈中性时,c(H+)=c(OH-),根据电荷守恒可知:c(Na+)=c(HX-)+2c(X2-)+c(Cl-),D选项正确;
答案选B。
22.(2020届河南省六市高三第二次联合调研)常温时,向120 mL 0.005 mol·L-1 CaCl2溶液中逐滴加入0.1 mol·L-1 Na2CO3溶液,混合溶液的电导率变化曲线如图所示。已知25℃时,Ksp(CaCO3)=3.36×10-9,忽略CO32-水解。下列说法正确的是
A.a点对应的溶液中Ca2+开始形成沉淀,溶液中c(Ca2+)=c(CO32-)
B.b点对应的溶液中Ca2+已完全沉淀,且存在关系:c(Na+)+c(H+)=c(Cl-)+c(OH-)
C.在滴加Na2CO3溶液的过程中,混合溶液的pH先减小后增大
D.右图可以说明CaCO3在溶液中存在过饱和现象
【答案】D
【解析】A.由图可知,a点对应的溶液导电能力急剧下降,说明Ca2+开始形成沉淀,而溶液中的钙离子和碳酸根离子分别来源于CaCl2溶液和Na2CO3溶液,CaCO3形成沉淀时,Ca2+和CO32-不一定相等,故A错误;
B.原溶液中n(Ca2+)=120mL×0.005mol·L-1=0.6mmol,要使钙离子完全沉淀,需要碳酸钠溶液的体积为=6mL,向b点中对应的溶液中加入碳酸钠溶液的体积小于6mL,不能使钙离子完全沉淀,电荷守恒关系式为:2c(Ca2+)+c(Na+)+c(H+)=c(Cl-)+c(OH-)+2c(CO32-),故B错误;
C.不忽略CO32-水解的情况下,在加入碳酸钠溶液后没有沉淀析出,溶液pH变大,析出碳酸钙时,溶液的pH突然变小,在Ca2+完全沉淀之前,混合溶液的pH值几乎不变,当所有的钙离子转化为碳酸钙沉淀后,继续滴加碳酸钠溶液,溶液的pH值变大,直至与碳酸钠溶液的pH几乎相同,忽略CO32-水解的情况下,水溶液的pH不发生变化,故C错误;
D.理论上Ca2+开始形成沉淀,c(CO32-)≈mol·L-1≈10-6mol·L-1,加入碳酸钠溶液的体积为≈10-2mL,即1滴碳酸钠溶液就能使溶液中的离子积>Ksp(CaCO3),而向a点对应的溶液加入碳酸钠溶液的体积为2.2ml,此时,溶液处于过饱和溶液,故D正确;
故选D。
23.(2020届广东省茂名市高三综合测试)在两只锥形瓶中分别加入浓度均为l mol•L-1 的盐酸和NH4Cl溶液,将温度和pH 传感器与溶液相连,往瓶中同时加入过量的质量、形状均相同的镁条,实验结果如下图。关于该实验的下列说法,正确的是
A.P点溶液:c(NH4+) + 2c(Mg2+) >c(Cl-)
B.反应剧烈程度:NH4Cl >HCl
C.Q点溶液显碱性是因为MgCl2发生水解
D.1000s后,镁与NH4Cl溶液反应停止
【答案】A
【分析】
浓度均为l mol•L-1的盐酸和NH4Cl溶液中加入过量的质量、形状均相同的镁条,反应的实质都是Mg+2H+==Mg2++H2↑,从图中可以看出,反应初期,盐酸与镁反应速率快,放出的热量多。反应一段时间后,NH4Cl溶液的pH迅速上升,然后基本恒定;盐酸溶液的pH缓慢上升,当反应时间接近3000s时,pH才迅速上升,然后保持恒定。
【详解】
A.从图中可以看出,P点溶液的pH>7,此时c(OH-)>c(H+);依据电荷守恒可知,c(NH4+) + 2c(Mg2+)+c(H+)=c(Cl-)+ c(OH-),所以c(NH4+) + 2c(Mg2+) >c(Cl-),A正确;
B.镁与盐酸反应,溶液温度迅速升高,并达最高点,反应放出的热量多,所以反应剧烈程度:HCl >NH4Cl,B不正确;
C.MgCl2水解时,溶液显酸性,所以Q点溶液显碱性不是MgCl2发生水解所致,C不正确;
D.1000s后,镁与NH4Cl溶液反应温度仍在缓慢上升,溶液的pH仍在缓慢增大,说明反应仍在正向进行,D不正确;
故选A。
24.(2020届宁夏三校高三联考)常温下,在体积均为20mL、浓度均为0.1mol·L-1的HX溶液、HY溶液中分别滴加同浓度的NaOH溶液,反应后溶液中水电离的c(H+)表示为pH水=-lgc(H+)水。pH水与滴加氢氧化钠溶液体积的关系如图所示。
下列推断正确的是
A.HX的电离方程式为HX=H++X-
B.T点时c(Na+)=c(Y-)>c(H+)=c(OH-)
C.常温下用蒸馏水分别稀释N、P点溶液,pH都降低
D.常温下,HY的电离常数
【答案】D
【解析】A.依题意,HX和HY是两种一元酸。由图象知,加入氢氧化钠溶液,水电离程度增大,溶液由酸性逐渐变为中性,当恰好完全反应时溶液呈碱性且水电离程度达到最大值。HX为弱酸,故A错误。
B.T、P点对应的溶液都呈碱性,故B错误。
C.N点呈中性,加入蒸馏水稀释中性溶液,稀释后溶液仍然呈中性,故C错误。
D.取M点计算电离常数,c(H+)=c(OH-)=1×10-7mol·L-1,混合溶液中
,,,故D正确。
故答案选D。
25.(2020届福建省厦门市高三质检)某温度下,分别向10.00mL0.1mol/L的KCl和K2CrO4溶液中滴加0.1mol/LAgNO3溶液,滴加过程中-lgc(M)(M为Cl-或CrO42-)与AgNO3溶液体积(V)的变化关系如图所示(忽略溶液体积变化)。下列说法不正确的是
A.曲线L1表示-lgc(Cl-)与V(AgNO3)的变化关系
B.M点溶液中:c(NO3-)>c(K+)>c(Ag+)>c(H+)>c(OH-)
C.该温度下,Ksp(Ag2CrO4)=4.0×10-12
D.相同实验条件下,若改为0.05mol/L的KCl和K2CrO4溶液,则曲线L2中N点移到Q点
【答案】D
【解析】A.KCl和硝酸银反应的化学方程式为:,铬酸钾和硝酸银反应的化学方程式为:,根据反应方程式可知在相同浓度的KCl和溶液中加入相同浓度的硝酸银溶液,氯离子浓度减小的更快,所以代表是与的变化关系,故 A正确;
B.M点加入的硝酸银溶液体积是15mL,根据反应方程式可知,生成硝酸钾和氯化银,剩余硝酸银,则,银离子水解使溶液表现酸性,则,所以M点溶液中,离子浓度为:,故 B正确;
C.N点纵坐标的数值是4,则在沉淀溶解平衡中,,
,故C正确;
D.相同实验条件下同一种溶液的相同,平衡时溶液中,Q对应的纵坐标数值是,即,曲线中N点移到Q点上方,故D错误。
26.(2020届河南省洛阳市高三第三次统考)25°C时,向NaHCO3溶液中滴入盐酸,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述正确的是
A.图中a=2.6
B.25℃时,HCO3-+H2OH2CO3+OH-的Kh=1.0×10-6.4
C.M点溶液中:
D.若要表示题目条件下pH与lg的变化关系.则曲线应该在平行于曲线的下方
【答案】A
【解析】A.根据N(7.4,1)点,lg=1,则=10,碳酸的一级电离常数Ka1==10×10-7.4=10-6.4,将M点c(H+)带入一级电离常数公式,解得=102.6,a=2.6,A正确;
B.该反应的平衡常数Kh=,根据M点,=10-2.6,c(H+)=10-9,c(OH-)=10-5,带入数值,此反应的平衡常数为10-7.6,B错误;
C.M点溶液中,依据电荷守恒c(H+)+c(Na+)=c(Cl-)+2c(CO32-)+c(OH-)+c(HCO3-),此时溶液为NaHCO3和NaCl的混合溶液,c(Na+)>c(HCO3-)+c(H2CO3),所以c(H+)+c(H2CO3)
查看更多